отек мозга болезнь паркинсона
Болезнь Паркинсона: сколько с ней живут, признаки
Болезнь Паркинсона, сколько с ней живут. Болезнь затрагивает нейроны головного мозга и сокращает выработку дофамина. Данное заболевание хронической формы активно прогрессирует, а данные о предполагаемой продолжительности жизни, к сожалению, отсутствуют.
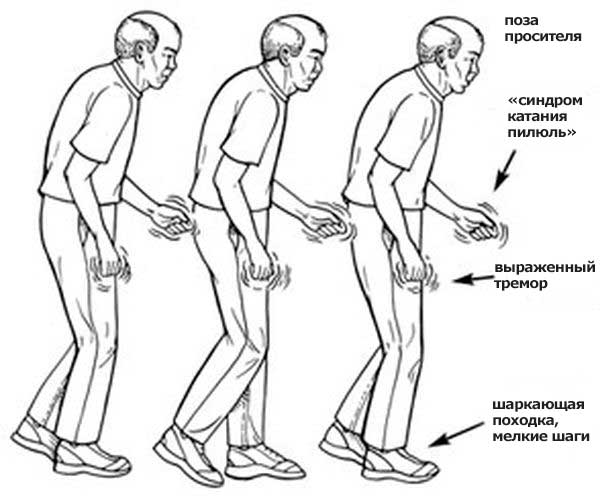
Первые признаки Паркинсона находят свое отражение в нарушении опорно-двигательного аппарата. Можно также наблюдать снижение интеллектуальных способностей.
Как показывают статистические данные, примерно четыре миллиона жителей нашей планеты страдают от симптоматики рассматриваемой патологии. Представители сильного пола чаще подвержены этой болезни.

Причины распространения
Болезнь Паркинсона первые симптомы и признаки. Доктора выделяют определенный комплекс стимулирующих факторов:
В соответствии с причинами распространения классифицируют две формы патологии.
Первичное заболевание может развиться ввиду эпизодического отмирания нейронов. К сожалению, последствия данного явления предотвратить не предоставляется возможным.

Вторичное заболевание связано с многочисленными повреждениями головного мозга. Стоит отметить, что последствия вторичной патологии предотвратимы, но только в случае излечения основной болезни.
Симптоматика и этапы заболевания
В соответствии с комплексностью симптоматики, течение патологии подразделяется на некоторое количество этапов:
Прогнозы при исследуемом заболевании
Паркинсона болезнь симптомы прогноз для жизни связан с многочисленными критериями. Диагностика на первоначальном этапе позволяет увеличить действенность лечения Паркинсонизма. Следование предписаниям докторов позволяет увеличить продолжительность жизни.
Болезнь Паркинсона
Болезнь Паркинсона – это хроническое дегенеративное заболевание нервной системы, сопровождающееся дрожанием рук и ног, обеднением движений и постепенным замедлением мыслительных процессов, и депрессией. Правильно подобранное и своевременно назначенное лечение способно затормозить патологический процесс и продлить жизнь пациента.
Общая информация
Болезнь Паркинсона вдвое чаще поражает мужчин, чем женщин. В большинстве случаев она развивается после 60 лет, но регистрируются случаи раннего начала заболевания (в 30-40 лет), а также ювенильные формы, развивающиеся у двадцатилетних людей.
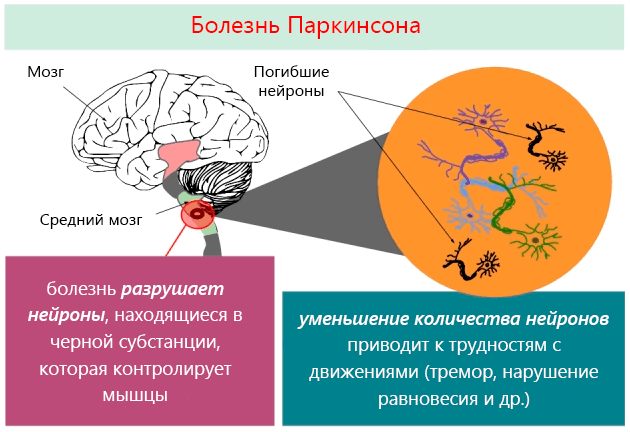
Существует несколько гипотез формирования патологии. В настоящее время точно доказано, что одним из механизмов ее развития является постепенная дегенерация нейронов и снижение выработки дофамина. Это важный нейромедиатор, участвующий в передаче нервных импульсов. В результате формируется специфический комплекс нарушений, который позволяет легко поставить диагноз.
Причины
Точные причины возникновения болезни Паркинсона не выявлены. Ученые смогли определить лишь ряд факторов, повышающих риск развития нейродегенеративных процессов:
Симптомы
Болезнь Паркинсона проявляется специфическими признаками, которые в комплексе составляют четкую картину заболевания:
В отличие от других нейродегенеративных заболеваний, болезнь Паркинсона почти не влияет на интеллект на ранней и средней стадии развития. По мере прогрессирования патологии отмечается снижение скорости мышления и разговора, снижение настроения, депрессия и безучастность ко всему происходящему.
Формы болезни
В зависимости от преобладающей симптоматики, выделяют три формы болезни Паркинсона:
Стадии развития
В настоящее время врачи выделяют 5 стадий болезни Паркинсона, проявляющиеся определенным комплексом симптомов:
Диагностика
Диагноз болезни Паркинсона ставится на основании характерной клинической картины. Пациента осматривает невролог, который отмечает типичные признаки. В обязательном порядке уточняются жалобы, собирается анамнез заболевания (история появления признаков) и жизни (сведения о перенесенных травмах, хронических заболеваниях, хирургических вмешательствах). Лабораторная и инструментальная диагностика используется для уточнения сопутствующей патологии и исключения других причин неврологических нарушений.
Лечение болезни Паркинсона
В настоящий момент успешно подобранное лечение болезни Паркинсона может приостановить процесс деградации и снизить выраженность патологической симптоматики. Болезнь начинает прогрессировать медленнее, что позволяет пациентам дольше оставаться в хорошей форме.
Медикаментозное лечение
Медикаментозное лечение направлено на восстановление баланса дофамина в центральной нервной системе. Используются следующие препараты:
Существуют комбинированные средства, сочетающие несколько действующих веществ для максимально быстрого эффекта.
Немедикаментозное лечение
Медикаментозное лечение дополняется физиотерапией, ЛФК и массажем. Физиотерапия используется для активации процессов метаболизма и усиления кровотока в головном мозге. В зависимости от состояния пациента и сопутствующих заболеваний могут быть назначены:
Массаж направлен на улучшение двигательной активности. Интенсивное разминание мускулатуры и пассивная гимнастика снижает ригидность мышц и обладает общеукрепляющим действием.
Упражнения лечебной физкультуры позволяют:
Большинство упражнений направлены на тренировку чувства равновесия. Комплекс подбирается индивидуально в зависимости от состояния пациента, его возраста и сопутствующих заболеваний.
Хирургическое лечение
Помощь хирургов актуальна на последних стадиях развития заболевания. Наиболее эффективной и безопасной операцией является установка стимулятора головного мозга. Вмешательство не требует вскрытия черепной коробки. В мозг вводятся тонкие электроды, а под кожу ключицы помещается небольшой стимулятор. Прибор программируется на определенную частоту импульсов, кроме того, больной и его родственники могут менять настройки в зависимости от состояния. Использование стимулятора позволяет сократить дозировку препаратов и длительное время держать симптоматику под контролем.
Другие варианты хирургического лечения требуют работы на открытом мозге:
Осложнения
Ограничение работы мускулатуры при болезни Паркинсона неизбежно приводит к уменьшению интенсивности кровотока и снижению уровня обмена веществ. Уже на средних стадиях развития заболевания значительно повышается риск образования тромбов и развития опасных состояний:
Прикованные к постели пациенты нередко сталкиваются с тяжелыми осложнениями, связанные с лежачим положением:
Правильно подобранное лечение значительно снижает риск развития осложнений, вот почему важно своевременно обратиться к врачу.
Профилактика
Профилактика болезни Паркинсона включает:
Лечение в клинике «Энергия здоровья»
Неврологи клиники «Энергия здоровья» придут на помощь при любой стадии болезни Паркинсона. Мы предлагаем комплексное лечение в соответствии с современными стандартами:
Преимущества клиники
Болезнь Паркинсона начинается очень медленно, но остановить этот процесс практически невозможно. Если у Вас или Ваших родных появились подозрительные признаки, не затягивайте с обращением к врачу. Запишитесь на диагностику в клинику «Энергия здоровья».
Болезнь Паркинсона: причины развития и прогноз
11 апреля — Всемирный день борьбы с болезнью Паркинсона (the World Parkinson’s Day). В этот день в 1755 году родился знаменитый врач, который описал заболевание, которое позже назвали его именем. Сегодня известно, что болезнью Паркинсона страдает каждый двадцатый человек после 60 лет, это самый частая нейродегенеративная патология после болезни Альцгеймера. При этом ученые отмечают «омоложение» заболевания, все чаще симптомы проявляются уже с 40 лет.
Болезнь Паркинсона была диагностирована у многих известных людей: Мохаммеда Али, Сальвадора Дали, Папы Римского Иоанна Павла II, Оззи Осборна и Билла Гейтса. Самый молодой из них – Майкл Джей Фокс. Неврологическое заболевание остается неизлечимым, но при качественном уходе позволяет пациентам оставаться активными, продолжать работать и получать удовольствие от жизни.
Наш центр предлагает медицинскую программу реабилитации при болезни Паркинсона. Узнайте подробности по ссылке
Что такое болезнь Паркинсона?
Мозг очень пластичен, приспосабливается к повреждениям, поэтому симптомы болезни Паркинсона проявляются, когда погибает больше половины клеток черной субстанции, а дофамин снижается на 80% и более.
Когда человек стареет, то дофамин снижается естественным способом. После 50 лет каждые десять лет гибнет от 4 до 6% клеток черной субстанции, поэтому болезнь Паркинсона проявляется с возрастом.
Причины развития болезни Паркинсона
Болезнь Паркинсона не имеет четкого набора причин. Ученые сходятся во мнении, что поводом для развития дегенеративного заболевания служит сочетание генетических факторов и особенностей внешней среды. Активность влияния каждого катализатора варьируется от случая к случаю. Почему у одних людей наличие определенного фактора приводит к заболеванию, а других — нет, ученым еще предстоит выяснить.
Возможные факторы снижения риска
Ученые обнаружили определенные факторы, которые могут снизить риск развития болезни Паркинсона. О их влиянии известно недостаточно, поэтому их можно пробовать только под наблюдением врача.
Симптомы
Симптоматика болезни Паркинсона развивается долгие годы. У разных пациентов могут наблюдаться различные проявления заболевания, прогрессирование также очень индивидуально. Интенсивность симптомов может отличаться даже в течение одного дня, изменяться под воздействием препаратов.
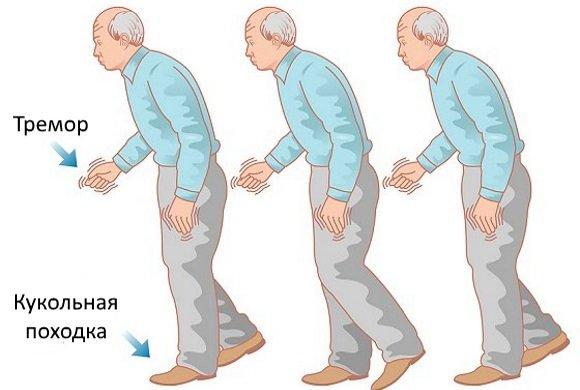
Часто болезнь диагностируют, когда человек начинает испытывать проблемы с двигательными функциями : движения становятся замедленными, он застывает, испытывает сложности при вставании со стула, возникает дрожание и скованность, при изменении положения тела, проявляются нарушения равновесия. Обычно симптоматика отчетливее заметна в одной половине тела.
Неотложные состояния при болезни Паркинсона
Болезнь Паркинсона (БП) – хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка α-синуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психических, вегетативных, сенсорных и др.) [1, 2].
Хроническое медленно прогрессирующее течение процесса при этом заболевании может меняться с развитием острой декомпенсации БП – внезапного нарастания симптомов паркинсонизма, сопровождающегося
существенным ограничением функциональных возможностей пациента и сохраняющегося более 24 часов, несмотря на продолжение или возобновление привычной для пациента противопаркинсонической терапии [3]. Данное расстройство развивается у 0,3-1% больных БП ежегодно, а в 10% случаев приводит к летальному исходу.
— акинетический криз (АК);
— акинетико-гипертермический (злокачественный) синдром (АГС);
— злокачественный нейролептический синдром (ЗНС);
— тяжелые инвалидизирующие дискинезии с гипертермией;
— психоз;
— серотониновый синдром (СС).
Неотложные состояния при БП, в зависимости от состояния и степени вовлеченности дофаминергической системы, условно можно разделить на две группы:
1. Неотложные состояния, возникающие в результате дофаминергического дисбаланса:
А – развивающиеся в период «OFF» или гипофункции дофаминергической системы: синдром паркинсонизм – гиперпирексия или акинетический криз;
Б – развивающиеся в период «ON» или избыточной активности дофаминергической системы: психоз, тяжелая дискинезия с гиперпирексией и т.п.;
2. Неотложные состояния, не связанные напрямую с состоянием дофаминергической системы (серотониновый синдром, электролитные нарушения и т.п.)
Акинетический криз и акинетико-гипертермический (злокачественный) синдром
Акинетический криз – резкое нарастание гипокинезии и ригидности с развитием обездвиженности, спутанности сознания, анартрии, нарушения глотания и вегетативными расстройствами (тахикардия, артериальная
гипотензия, недержание мочи, потоотделение). Для акинетико-гипертермического синдрома характерны симптомы акинетического криза, а также гипертермия (гиперпирексия), вызванная дисфункцией гипоталамуса.
К основным причинам развития АК и АГС относятся:
— изменение дофаминергической терапии;
— блокада дофаминергических рецепторов;
— интеркуррентные состояния;
— нарушение работы системы глубокой электростимуляции (при наличии таковой у пациента).
Точная частота развития АК и АГС не известна. Наиболее цитируемой работой, в которой обсуждается частота встречаемости данных расстройств, является статья M.Serrano-Duenas [4]. Согласно его данным, у 3,6% (11 пациентов из 305) регулярно наблюдаемых им пациентов с БП в течение 9 лет развилось данное расстройство. Среди всех осмотренных за 9 лет пациентов с БП данный процент составил 0,04%. Во всех случаях причиной развития АГС являлась самостоятельная отмена препаратов леводопы без согласования с лечащим врачом. С другой стороны, в исследовании ELLDOPA [5], в которое были включены пациенты с ранней стадией заболевания, в результате двухнедельной отмены леводопы ни у одного из 361 пациента не развился АГС. Данный факт указывает на значение выраженности дегенерации нигростриатного пути, отражающего стадию заболевания в развитииакинетического криза.
Патофизиология акинетического криза окончательно не ясна, однако очевидно, что в основе его развития лежит не только отмена препарата. Особенностью АК является низкая эффективность возобновленной терапии
леводопой, при этом срок начала ответа может достигать 11 дней. Таким образом, во время акинетического криза, по-видимому, развивается временная блокировка ответа на привычную для пациента терапию. В 2014 г. была опубликована работа [6], в которой при помощи SPECT с лигандом [123I] FP-CIT, проведенной до, в период и после акинетического криза, было показано, что в острый период происходит значимое снижение накопления лиганда в пресинаптических терминалях стриатума и его дальнейшее медленное восстановление.
Впервые АГС был описан в 80-е годы ХХ в. у пациентов во время прекращения дофаминергической терапии в рамках проведения «лекарственных каникул». В настоящее время, в связи с пониманием всей опасности «лекарственных каникул», наиболее частой причиной развития АК и АГС называют изменение схемы ранее назначенной терапии (резкое снижение дозы, непропорциональная замена дофаминергического препарата). Прием препаратов, блокирующих дофаминовые рецепторы, таких как типичные нейролептики, метоклопромид, циннаризин, резерпин и др., также может приводить к развитию декомпенсации БП. Более того, существуют сообщения о развитии АК на фоне приема препаратов из группы атипичных нейролептиков. Нельзя забывать и о возможности влияния интеркуррентных заболеваний на течение БП. АГС может развиваться у пациентов с патологией желудочно-кишечного тракта в связи со снижением всасывания дофаминергических препаратов и развития состояния, эквивалентного отмене терапии. К таким состояниям относятся опухоли, резекция кишечника, тяжелые гастроэнтериты, непроходимость. Некоторые сопутствующие заболевания, несмотря на отсутствие прямого влияния на всасывание препаратов, также способны приводить к АК/АГС (инфекции, дегидратация, электролитные расстройства). Основными электролитными расстройствами, способными привести к развитию острой декомпенсации, являются гипо- и даже гипернатриемия, а неадекватная коррекция данных состояний способна вызвать понтинный или экстрапонтинный миелинолиз, усугубив течение АГС. Описаны случаи развития декомпенсации, связанные с менструальным циклом – вероятно за счет отрицательного влияния высокого уровня прогестерона на дофаминергическую систему. В связи с активным внедрением глубокой электростимуляции головного мозга, нельзя забывать о возможности развития декомпенсации у пациентов, перенесших данное оперативное лечение. Акинетический криз может развиться в случае прекращения стимуляции, некорректного программирования стимулятора, разрядки батареи, и даже непреднамеренного отключения стимуляции самим пациентом. При этом описаны случаи развития АГС в результате снижения дозы дофаминергической терапии даже на фоне эффективной глубокой электростимуляции.
Акинетический криз и акинетико-гипертермический синдром – неотложные состояния, требующие срочной госпитализации пациента в отделение интенсивной терапии. При развитии данной патологии в кратчайшие сроки должна быть проведена диагностика возможных интеркуррентных заболеваний (в первую очередь инфекционных), проведен комплекс лабораторных обследований (в первую очередь для исключения водно-электролитного и кислотно-щелочного расстройства). Акинетический криз требует тесного взаимодействия реаниматолога и невролога.
Клиническая картина АГС характеризуется следующими симптомами:
— сроки развития от 18 часов до 7 суток (с момента изменения/прекращения дофаминергической терапии или развития состояния, которое могло спровоцировать декомпенсацию);
— выраженная ригидность/акинезия;
— вегетативные расстройства (тахикардия, тахипноэ, лабильность АД, нарушение мочеиспускания, цианоз, потоотделение);
— через 72-96 часов (в некоторых случаях одновременно с дебютом акинезии) развивается гипертермия (до 41 °С);
— нарушение сознания (от возбуждения до оглушения и комы);
— возможно развитие генерализованных тонико-клонических судорог, миоклоний;
— изменение лабораторных показателей: лейкоцитоз, повышение уровня креатинкиназы (260-50000 Ед/л);
Основными осложнениями АК и АГС являются:
— тромбоз глубоких вен;
— эмболия легочной артерии;
— аспирационная пневмония;
— почечная недостаточность.
Мероприятия, проведение которых необходимо при поступлении больного с акинетическим кризом:
— интубация, проведение ИВЛ (при выраженной дыхательной недостаточности);
— постановка назогастрального зонда, мочевого катетера;
— антибиотикотерапия (в случае выявления инфекционного процесса);
— назначение антипиретиков;
— адекватная инфузионная терапия (коррекция электролитных расстройств);
— гемодиализ (при выявлении почечной недостаточности);
— гепаринотерапия, компрессионный трикотаж (профилактика тромбоза глубоких вен голеней и эмболии легочной артерии);
— позиционирование в кровати (профилактика пролежней).
Основой терапии акинетического криза является восстановление приема дофаминергической терапии в случае ее отмены. Особенности ответа на возобновленную терапию требуют учета следующих аспектов:
— раннее возобновление дофаминергической терапии;
— увеличение исходной дозы дофаминергических препаратов;
— продолжение терапии вне зависимости от наличия ответа (должный ответ может развиться лишь спустя 11 суток);
— невозможность ограничения терапии акинетического криза только дофаминергическими препаратами.
Важным дополнением к терапии является введение раствора амантадина сульфата как препарата, способного снизить активность глутаматной системы, возможно лежащей в основе АГС. Следует придерживаться следующей схемы назначения препарата:
— 500 мл раствора (200 мг амантадина сульфата) 2-3 раза в день в течение 10-14 дней;
— после завершения курса инфузионной терапии обязателен перевод на пероральную форму в таблетках (300-600 мг/сут).
Также в качестве дополнительной терапии рассматриваются апоморфин, дантролен и метилпреднизолон. К сожалению, первые два препарата не зарегистрированы в нашей стране. Метилпреднизолон назначается в дозе 1000 мг/сут в течение 3-5 дней. Терапия метилпреднизолоном существенно улучшает исходы и сокращает сроки акинетического криза. Окончательный механизм действия метилпреднизолона при акинетическом кризе не ясен. В экспериментальной модели на крысах было показано наличие глюкокортикоидных рецепторов на дофаминергических нейронах в вентральной области покрышки, за счет стимуляции которых возможно и развивается эффект метилпреднизолона. Имеется сообщение о применении ротиготина в виде трансдермальной терапевтической системы при акинетическом кризе [7].
Злокачественный нейролептический синдром Злокачественный нейролептический синдром – это ятрогенная, потенциально фатальная патология, которая может развиться на фоне приема любых препаратов, блокирующих дофаминергическую передачу. Чаще всего данный синдром развивается в ответ на прием типичных нейролептиков, однако описаны случаи развития ЗНС и при терапии атипичными нейролептиками. Патогенез ЗНС связан с блокадой дофаминергических структур в базальных ганглиях и гипоталамусе, иммунологическими нарушениями и повышением проницаемости гематоэнцефалического барьера, которые приводят к нейросенсибилизации организма с последующим аутоиммунным поражением ЦНС и висцеральных органов. В патогенезе ЗНС важную роль играет симпатоадреналовая и серотониновая гиперактивность.
Частота встречаемости ЗНС составляет 0,1–1% среди больных, получающих нейролептики. В данную группу попадают и пациенты с БП, течение которой осложнилось психотическими расстройствами. Чаще всего ЗНС развивается в первые дни после начала приема препарата, либо резкого увеличения его дозы. ЗНС может проявиться в любом возрасте, но чаще наблюдается у молодых мужчин. Факторами риска при ЗНС являются интеркуррентная инфекция, физическое истощение, нарушения водно-электролитного баланса (в первую очередь дегидратация), также, как и при АГС.
Клиническая картина ЗНС во многом схожа с АГС: характерно быстрое прогрессирование симптоматики с пиком в течение 72 часов, длительностью 7-14 дней. В случае ЗНС возможно купирование симптоматики без дополнительной терапии.
В 1985 г. Levenson J.L. впервые предложил критерии диагностики данной патологии [8], позже, в 1994 г., новые критерии были предложены в рамках DSM-IV:
Для ЗНС характерны изменения лабораторных показателей:
— повышение креатинкиназы (>90%);
— полиморфонуклеарный лейкоцитоз (75%);
Levenson J.L., 1985
DSM-IV, 1994
Болезнь Паркинсона: причины, признаки и симптомы, стадии, лечение
Что такое болезнь Паркинсона (БП)? Это хроническая патология ЦНС с постепенно прогрессирующим течением, в основе развития которой лежит дегенерация и гибель в черном веществе головного мозга нейронов, синтезирующих дофамин. Дофамин известен как нейромедиатор, который у здорового человека в достаточном количестве поставляется аксонным транспортом к подкорковым ядрам мозга. Этот процесс позволяет держать под контролем двигательную активность и тонус мышц. При болезни Паркинсона выработка биологического вещества сокращается из-за нейродегенерации (разрушения) дофаминовых нейронов, которые постепенно гибнут.
По мере темпов отмирания нервных клеток, синтез дофамина все больше и больше угнетается. Когда уровень погибших нейронов достигает критической отметки, заболевание начинает проявляться. У человека развиваются серьезные двигательные расстройства, которые становятся тяжелейшим испытанием для больного и его родных. Ввиду хронической дегенерации структур черной субстанции головного мозга патологический процесс носит необратимый и постоянный характер.
Причины развития Паркинсона
По сути, в головном мозге каждого человека в некоторой мере нейроны обречены на погибель, что является вполне естественным для физиологии процессом. Специалистами рассчитана даже закономерность утраты нервных клеток мозга у абсолютно всех людей: за 10 лет жизни безвозвратно погибает примерно 4% нейронов. Но головной мозг уникален, поскольку умеет «включать» своеобразные компенсаторные механизмы, чтобы сохранять нормальную работу нервной системы.
Если же потенциалы компенсации иссякли, а вместе с этим экстрапирамидная система (в ее состав входит черное вещество и пр.) лишилась 80% нейронов, возникают типичные для болезни Паркинсона симптомы. То есть, в анормальном положении разрушение соответствующего вида нейронов происходит активнее. И чем старше человек, тем выше вероятность достижения порогового уровня. Медики выдвигают гипотезу, что заболевание связано с увеличением продолжительности жизни, так как недуг преимущественно одолевает лиц пожилой группы.
Более интенсивное уменьшение числа нейронов, чем при нормальной физиологии старения, при болезни Паркинсона начинается задолго до проявления основных симптомов. И только спустя десятилетия человек, достигнув пожилого возраста, понимает, что болен.
Конкретно БП относят к идиопатической форме, что говорит о самостоятельной (первичной) болезни, которая возникает по необъяснимым причинам. Отсюда следует, что она не связана с генетическими факторами или какими-либо другими заболеваниями. При обследовании пациента врачи не могут установить этиологию ее развития.
В медицине существует еще один термин – «паркинсонизм». Паркинсонизм – обобщающее понятие, характеризующее в целом синдром, что связан с поражениями экстрапирамидной системы первичного или вторичного генеза. В отличие от первичной формы (истинной БП), вторичный паркинсонизм имеет первопричину, которая ведет к такому же клиническому исходу. Первопричинами вторичного паркинсонизма могут быть:
Основываясь на клинические данные, в 3/4 случаев синдрома паркинсонизма выявляют именно болезнь Паркинсона, то есть, идиопатическую (включая ювенильную) форму.
Статистика заболеваемости
По частоте развития среди нейродегенеративных патологий БП занимает второе место после болезни Альцгеймера. По данным ВОЗ, болезнь довольно распространена повсеместно: всего в мире насчитывается более 6 млн. людей с таким сложным диагнозом. Уровень заболеваемости по России соответствует 140-160 случаям на каждые 100 тыс. населения. При этом из года в год неуклонный рост прослеживается в распространении патологии даже среди молодых людей в возрасте 30-40 лет. Согласно статистике, каждый 10-й пациент не старше 40 лет. Если дебют БП приходится на любые годы до 40 лет, ее называют ювенильным паркинсонизмом.
На основании предоставленной информации разными авторами, до 55 лет риски заболеваемости в среднем составляют 0,5%, от 55-74 лет – 1,5%, 75-85 лет – 2,5-3%, старше 85 лет – 4-4,5%. Наиболее уязвимый к заболеванию контингент людей – мужчины. Инвалидизация, как правило, наступает спустя 3-5 лет с момента манифестации симптомов. Средний показатель выживаемости – 15 лет. Болезнь Паркинсона относится к числу заболеваний с относительно невысокими цифрами летальности. Причинами смертельных исходов преимущественно являются осложнения после падения, инфекции легких, ТЭЛА, инфекционный патогенез мочевыводящих путей.
Симптомы болезни Паркинсона: от ранних до поздних
Диагностика болезни Паркинсона на ранней стадии сопряжена большими трудностями. Ранняя симптоматика либо вообще отсутствует, либо характеризуется неспецифическими проявлениями, которые могут не восприниматься людьми за серьезную проблему. К числу первых симптомов, которые могут иметь связь с паркинсонизмом, относят:
Клиницисты объясняют развитие таких состояний, предшествующих явным двигательным расстройствам, вовлечением при стартовавшей нейродегенерации значительного количества нервных структур. Заболевание от предсимптомной до симптомной стадии проходит в несколько патоморфологических этапов.
Далее морфологические нарушения продолжаются, и, начиная с 4 этапа, когда дефицит дофамина составит 60%-80%, открываются клинические симптомы. Их спектр достаточно разнообразен, однако наиболее специфичными проявлениями паркинсонизма являются:
Диагностика и лечение болезни Паркинсона
Врачи говорят, что, если выявить и начать лечить патологию еще на ранней стадии (в момент самого начала гибели нейронов), можно было бы притормозить скорость разрушающего процесса и не допустить порогового уровня. Так, человек и в 100 лет не ощутил бы признаков заболевания. Но вся беда в том, что вряд ли кто пойдет к врачу в отсутствие проблем. Пациенты обращаются, когда появляются симптомы, но вот с резервами то нейронов уже катастрофа, их почти не осталось, что делает невозможным достижение такого перспективного плана.
В неврологической практике встречается еще одна проблема диагностики: неврологи часто допускают ошибки в установлении диагноза, игнорируя принципы дифференциации и комплексности. Отсюда возникают грубейшие просчеты в назначении симптоматического пособия, пациент получает зачастую неадекватную терапию, порой, в неоправданно поздние сроки. Многих попросту лечат не от той болезни, что есть по существу на самом деле. Либо рекомендуют лекарства и дозы, не соответствующие стадии патогенеза, возрасту пациента, сопутствующим патологиям, роду профессии и т. д. В результате клиническое состояние доходит до критической фазы, из-за чего часто требуется нейрохирургическая помощь, то есть, операция на головном мозге.
Врач обязан провести глубокую оценку моторных, рефлективных, психических расстройств, затем досконально дифференцировать признаки болезни. Однако и этого мало, ведь аналогичная клиника нередко присутствует при других патологиях и синдромах. Например, при гидроцефалии, опухолях мозга, депрессиях, истерии, кататоническом ступоре, синдроме Исаакса, эссенциальном треморе, пр. После осмотра окончательно и достоверно определить, имеет ли место паркинсонизм и какие структуры параллельно страдают, сможет уже только патоморфологическое исследование мозга.
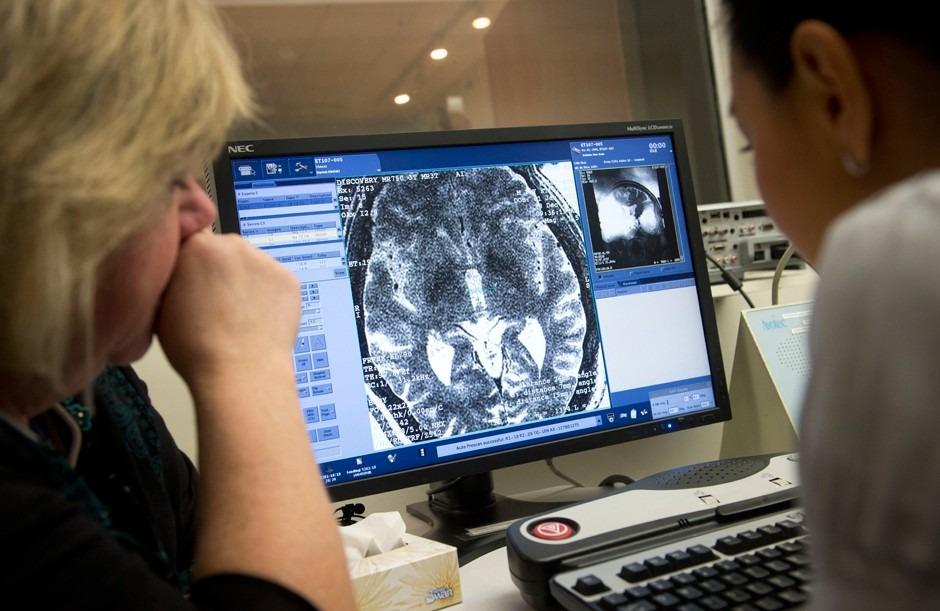
Прием нейрохируга: изучение данных томографии мозга
Болезнь Паркинсона – пожизненная патология, полностью избавить от нее невозможно. Больному для улучшения качества жизни могут быть назначены в отдельном виде или в комбинации лекарства-симптоматики:
Принцип действия лекарственных средств направлен на коррекцию нарушенного биохимического баланса в базальных ядрах, восполнение недостающих веществ. В итоге, пока их пациент принимает, симптомы устраняются или становятся менее выраженными. После их отмены происходит быстрое возвращение симптомов с тенденцией стремительной прогрессии. Лекарства имеют многообразный спектр противопоказаний и ряд тяжелых побочных эффектов, поэтому должны выбираться очень осторожно хорошим специалистом по неврологии.
Хирургическая операция при болезни Паркинсона
В современной мировой практике для лечения болезни Паркинсона активно применяются хирургические методы. Операции позволяют существенно сгладить симптоматику, поспособствовать заметному улучшению уровня качества жизни. Обратиться к перспективной нейрохирургии иногда очень даже целесообразно. Особенную важность они представляют при предполагаемо продолжительном сроке жизни и крайне неудовлетворительном состоянии. Перечислим все показания, когда проблему уместно решать оперативно:
Операции по поводу симптомов болезни Паркинсона имеют противопоказания к назначению. В оперативном вмешательстве может быть отказано, если:
В нейрохирургическом арсенале для лечения больных с диагнозом «паркинсонизм/болезнь Паркинсона» применяются стереотаксические методики с доказанной эффективностью, это:
Во время хирургической операции
Главный принцип хирургического лечения базируется на локальном разрушении подкорковых ядер головного мозга, что ответственны за появление дрожательного синдрома и ригидности мышц. Такие операции в значительной мере позволяют пациентам адаптироваться к условиям повседневной жизни, ведь некоторым не под силу даже выполнить элементарные действия – поднести ко рту ложку, поставить подпись, застегнуть пуговицу.
Пройдя нейрохирургическое вмешательство, пациентам, и это первостепенно значимо, возвращаются способности к самостоятельному обслуживанию. Очередной веский аргумент в пользу хирургической терапии – это возможность перейти на самые низкие, неагрессивные лекарственные дозы. Хирургия во многих случаях делает жизнь полноценной или максимально приближенной к норме здорового человека.
Рассмотрим же, что представляют собой все тактики операций, которые спасают людей от тех злостных мучений, уготованных болезнью Паркинсона.
Процедура таламотомии
Таламотомия – стереотаксический прием нейрохирургии, в момент которого оказывается точечное деструкционное воздействие на отдельные ядра и проводящие пути таламуса. Процедура выполняется под местным наркозом, человек остается в сознании и полном контакте с врачом. После обезболивания голова закрепляется в стереотаксической раме. Далее в черепной коробке делается 1,5-саниметровое отверстие, через которое к таламусу под КТ-контролем подводится зонд-электрод. При подаче электротока кончик зонда нагревается до 75-80 градусов, что вызывает абляцию (прижигание) интересующих нервных структур. После вмешательства на череп накладывается стерильная повязка.
Деструкция таламусной области эффективна только при контрлатеральном (одностороннем) треморе. Процедура сложная, долгая (манипуляции занимают до 2 часов), по степени инвазивности средняя. Она показывает в 90% случаев хорошие и отличные результаты. После таламотомии достигается устойчивый и длительный противотреморный эффект, у большинства он отмечается сразу в операционной. Осложнения случаются не сильно часто, у 2% пациентов. Послеоперационные нарушения в основном представлены расстройствами чувствительности и психики, односторонними парезами.
Видео на английском языке, но весьма наглядное:
Операция паллидотомия
Суть паллидотомии заключается в деструкции медиальной части бледного шара с целью подавления его гиперактивности. Бледный шар головного мозга отвечает за регуляцию мышечного тонуса и двигательных способностей. При его чрезмерной активности, как в случае с паркинсонизмом, возникает неадекватное воспроизведение движений. Процедура позволяет пресечь его патологическую импульсацию, которая провоцирует торможение нервных клеток таламуса и моторных областей коры головного мозга.
Эта операция сходна с таламотомией, отличие – функциональная область для прямого нанесения деструкции. Этот способ может быть рассмотрен в качестве лечения дискинезий от приема леводопы, сочетающихся с болезненным спазмированием мышц. Улучшение при таких дискинезиях наступает в 90% случаев, ригидность и брадикинезию сократить удается в 80%, тремор – только в 50-55%. Безусловно, если операция была проведена безупречно. Однако если у пациента ведущим симптомом выступает тремор, проводить паллидотомию неуместно, предпочтительнее таламотомия.
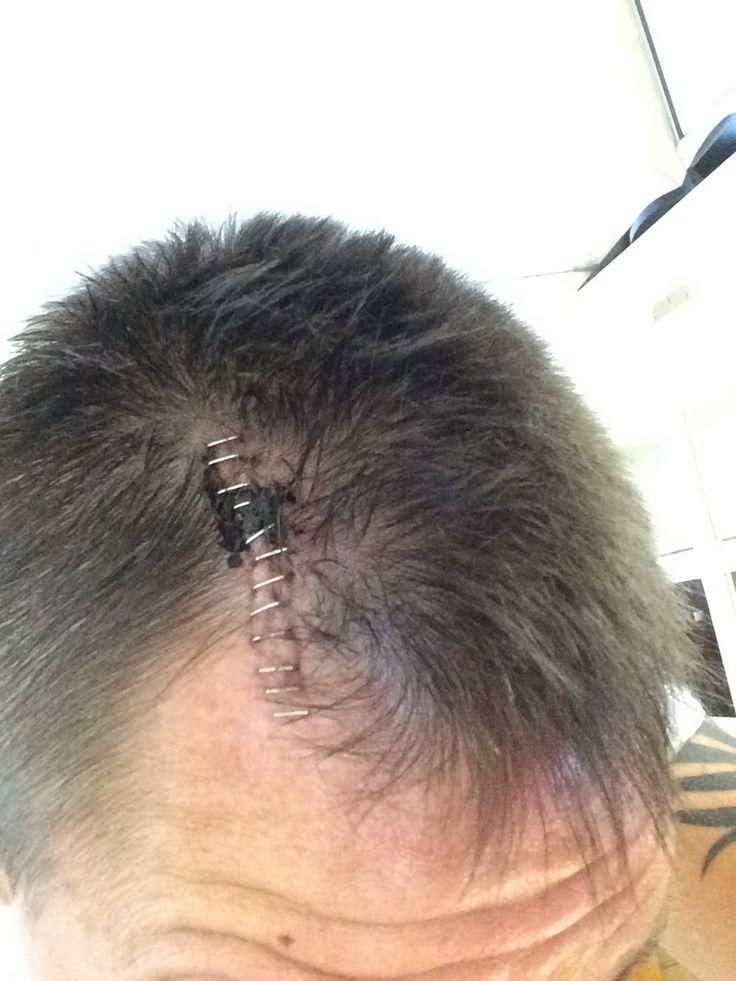
Хирургический шов после процедуры.
В ходе манипуляций на бледном шаре крайне важно использовать самые щадящие интраоперационные системы деструкции (например, криозонды) для столь уязвимого участка.
По причине близкого расположения зрительного тракта и внутренней капсулы, индивидуальной вариабельности размеров БШ от паллиодотомии в ведущих клиниках мира все чаще стали отказываться. Методика сопряжена высокими рисками необратимых последствий: выпадением полей зрения, внутримозговыми кровоизлияниями, дизартриями и др.
Метод глубокой стимуляции мозга
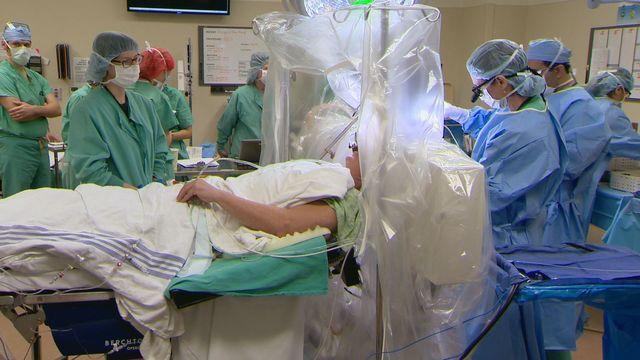
Уникальная методика Deep Brain Stimulation, изобретенная в 80-х годах французскими специалистами, стала хорошей альтернативой таламо- и поллидотомии. Техника ее проведения состоит во вживлении электродов в мозг. Они будут обеспечивать должный контроль над тремором, скованностью и замедленностью движений, распознавая и блокируя аномальные сигналы ЦНС. Эта процедура нейростимуляции не подойдет пациентам с немоторными нарушениями.
Миниинвазивный сеанс осуществляется в 2 этапа. На первом этапе под местной анестезией через крошечное отверстие в черепе в зону субталамического ядра вводятся специальные электроды. Для высокоточного и безопасного внедрения электродов используется трехмерная КТ-навигация. Свободные концы электродов оставляют под кожей головы. В течение примерно 1 недели импланты тестируются и настраиваются посредством магнитных приборов. По достижении необходимого эффекта переходят ко второму этапу.
На втором этапе выполняется имплантация импульсного генератора под кожу, немного ниже ключицы. Концы электродов соединяют с генератором электроимпульсов, затем на область рассечения кожи накладывается косметический шов. После окончания вмешательства выполняется контрольная проверка работы установленной системы. Первое время в месте операции могут беспокоить болезненные явления, которые постепенно сойдут на нет. В целом процедура переносится относительно легко и редко осложняется последствиями. Выраженность тремора сокращается, как показывают наблюдения, во многих случаях на 85% и более.
При выписке больному выдается специальный пульт магнитного действия, которым можно будет выключить или включить основное устройство. В случае усиления симптомов, врач изменит настройки нейростимулятора, используя только внешние источники управления. Стимулятор работает от батарей, срок службы которых составляет 5 лет и более, самые последние модели рассчитаны на срок эксплуатации до 10 лет.
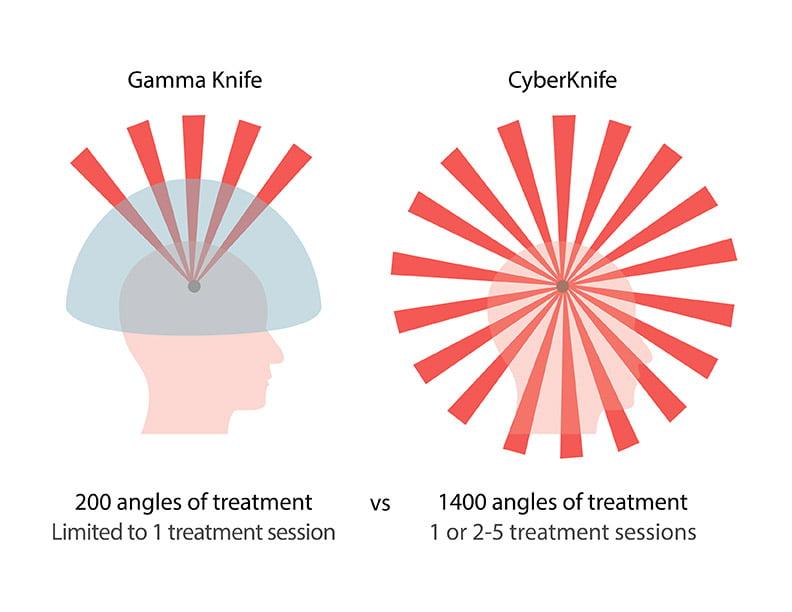
Радиохирургия на Гамма-ноже, Кибер-установках
Радиохирургические операции на Гамма и Кибер ножах приобрели грандиозный успех в нейрохирургическом мире. Такие процедуры безопасны, безболезненны и бескровны, поскольку проводятся без вовлечения методов трепанации и разрезов, не требуют прямого контакта хирургических инструментов с тканями головного мозга. Пациента не нужно госпитализировать, сеанс проходит в амбулаторных условиях. По терапевтической мощи передовые технологии не уступают, а иногда даже превосходят классические операции.
Гамма-нож и Кибер-нож – «золотой стандарт» современной радиохирургии. С их помощью всего за 1 сеанс устраняются очаги, вызывающие клинику болезни Паркинсона. Работают методики по принципу прицеленного воздействия радиоактивным потоком лучей на патологическую область, к примеру, на таламус или бледный шар. В участки, которые виновны в появлении дрожательного синдрома и других нарушений, поступает концентрированная доза радиации. Под действием радиоактивной энергии облучаемый объект разрушается и обезвреживается, а вслед за этим наступает облегчение для пациента.
За процессом посредством компьютерного оборудования будет следить врач из соседнего кабинета. Облучения бояться не стоит, «умные» установки работают только в изолированном поле, четко в избранной точке. Поэтому они не окажут негативного влияния на организм и близлежащие структуры головного мозга. Пациенту нужно просто от 30-60 минут полежать на столе установке. А уже через час после проведенной терапии он сможет покинуть лечебное учреждение, на следующий день вернуться к повседневной деятельности. Эффективность лечения тремора на системе Гамма- или Кибер-нож составляет 95% и более.
Профильные клиники
В Европе одним из лидеров в области нейрохирургического лечения и реабилитации пациентов с диагнозом болезни Паркинсона является Чехия. Чехия имеет огромный опыт в восстановлении опорно-двигательных функций и утраченного потенциала ЦНС не только при паркинсонизме, но и при болезни Альцегеймера, эпилепсиях, мозговых новообразованиях. Медицинская помощь предоставляется по современным стандартам нейрохирургии.
Чешские специалисты практикуют исключительно проверенные, действенные и щадящие технологии, актуальные нынешнему времени. Клиники Чешской Республики – учреждения с мировым именем, которые не уступают медучреждениям Германии и Израиля. И при этом цены на радио- и нейрохирургическую помощь при паркинсонизме в Чехии в разы доступнее (не менее чем в 1,5 раза ниже), чем в этих странах.