Высокая вирусная нагрузка при гепатите с чем опасна
Вирусная нагрузка и тяжесть заболевания гепатитом C: есть ли связь?
Е.И. Лакина, О.В. Масалова, А.А. Абдулмеджидова, А.А. Кущ,
НИИ вирусологии им. Д.И.Ивановского РАМН, Москва
Патогенез гепатита С остается во многом неясным. До сих пор не существует однозначного ответа на вопрос, как присутствие вируса в организме влияет на развитие заболевания. Во многом это обусловлено тем, что исследователи этой проблемы получают противоречивые результаты. В этом обзоре мы постарались коротко изложить существующие в настоящее время опубликованные данные и результаты собственных исследований, касающиеся связи между присутствием РНК и белков ВГС в организме больных и активностью хронического гепатита С.
Для изучения распределения РНК вируса гепатита С в различных органах и тканях инфицированного организма применяют методы полимеразной цепной реакции с этапом обратной транскрипции (ОТ-ПЦР), гибридизации in situ, ПЦР in situ. Вирусные белки выявляют либо с помощью поликлональных сывороток, либо с помощью моноклональных антител.
Для оценки влияния вирусной нагрузки на активность хронического гепатита С, которая может варьировать от минимальных гистологических изменений в печени до случаев цирроза и гепатокарциномы, используют различные варианты количественного и полуколичественного методов ОТПЦР. Активность патологического процесса в печени оценивают по уровню активности фермента аланинаминотрансферазы (АЛТ), индексу гистологической активности (ИГА). Стадию заболевания характеризуют, используя гистологический индекс склероза (ГИС). Гистологический диагноз (ИГА и ГИС) ставится на основании морфологического изучения биопсийного материала печени и выражается в баллах в соответствии с международной классификацией (DesmetV.J. et al., 1994).
По данным ряда исследователей, репликация вируса возрастает по мере прогрессирования болезни (Cho S.W. et al., 1996), и более высокий уровень виремии коррелирует с более серьезным повреждением печени (Gretch D. et al., 1994). При исследовании парафиновых срезов печени Dries V. с соавт. (1999) отмечали более частое выявление РНК В ГС в печени пациентов с высоким уровнем воспалительной активности по сравнению со случаями, при которых повреждения печени были минимальны. По мнению авторов, это связано с тем, что вирусная нагрузка клеток печени может определять воспалительно-некротическую реакцию (Dries V. et al., 1999). По данным Jamal M.M. с соавт. (1999), у пациентов с постоянно нормальным уровнем АЛТ наблюдается значительно более низкий уровень РНК ВГС в печени, чем у больных с повышенным уровнем АЛТ. Adinolfi L.E. с соавт. (1998) указывают, что у пациентов с циррозом печени уровень РНК в печени превышает таковой у пациентов с низким уровнем ИГА (1-4). Наиболее высокий уровень РНК ВГС в печени наблюдается у больных с ИГА>8 (Adinolfi L.E.etal., 1998).
В противоположность этому большинство исследователей сходятся на том, что прямая связь между количеством РНК ВГС в организме (как в печени, так и в периферической крови) и степенью активности патологического процесса отсутствует (BallardiniG.etal., 1997, McGuinnesP.H. et al., 1996, Negro F. et al., 1998, 1999, Rodriguez-Inigo E.et al., 1999, Sugano M. et al., 1995). Поданным этих авторов, присутствие вируса в организме и уровень вирусной РНК не коррелируют со значениями ИГА, ГИС или АЛТ. Есть данные об уменьшении уровня вирусной РНК в печени при прогрессировании хронического гепатита С (Di MartinoetaL, 1997).
Результаты, полученные в нашей лаборатории, согласуются с последней концепцией: при исследовании материалов (ткани печени, сыворотки и лимфоцитов периферической крови) от 75 пациентов с хроническим гепатитом С не было обнаружено достоверных отличий между частотой выявления РНК ВГС у больных с различной активностью заболевания (Лакина Е.И. и др., 2000). При проведении нами количественного анализа уровня РНК ВГС в сыворотке крови больных ХГС (Amplicor Monitor Test, v.2.0., «Roche Diagnostics») также не выявлено значимой корреляции между показателями ИГА, ГИС, АЛТ и уровнем виремии.
Zignego A.L. с соавт. (1995) показали, что РНК вируса чаще встречается в клетках крови пациентов с более серьезными повреждениями печени. Для объяснения существования этой связи авторы предположили, что активная инфекция различных субпопуляций клеток, вовлеченных в иммунный ответ хозяина, может нарушать их функцию, приводя к персистенции ВГС и развитию хронических повреждений печени. Частое обнаружение РНК ВГС в периферических мононуклеарах больных с хроническими повреждениями печени может объясняться тем, что при длительной ВГС-инфекции клеток печени происходит увеличение пула инфицированных лимфоидных клеток путем передачи от клетки к клетке (Zignego et al., 1995). Показано, что инфицированные лимфоидные клетки могут быть причиной заражения здоровой печени, пересаженной в организм ВГС-инфицированного пациента (Feray С. et al., 1992). Внепеченочный резервуар инфекции может также служить источником реактивации болезни после прекращения интерферонотерапии (Gil В. et al., 1993).
Наряду с определением РНК, перспективным методом изучения активности вирусной репродукции является выявление вирусных белков непосредственно в тканях с помощью иммуногистохимических методов (ИГХ). В качестве иммунных реагентов для детекции антигенов ВГС используются как моноклональные антитела (Ballardini G. et al., 1995, Gonzalez-Peralta R.P. et al., 1994, Noun-Aria K.T et al., 1995, Sansonno D. et al., 1995, Nayak N.C., SatharS.A., 1999), так и поликлональные антисыворотки, полученные от экспериментально иммунизированных животных (Gonzalez-Peralta R.P. et al., 1994, Tsutsumi M. et al., 1994) или больных хроническим гепатитом С людей (Ballardini G. et al., 1995, Nouri-Aria K.T. et al., 1995).
Анализ внутриклеточной локализации вирусных белков методом ИГХ показал, что специфическое окрашивание наблюдается только в цитоплазме гепатоцитов, что согласуется с большинством опубликованных работ (Ballardini G. et al., 1997, Blight К. et al., 1994, Brody R.I. et al., 1998, Gonzalez-Peralta et al., 1994, 1995, Nouri-Aria K.T. et al., 1995, Sansonno D. et al., 1995 (a,b), 1997).
Большой интерес представляет использование моноклональных антител для выявления белка нуклеокапсида ВГС в сыворотках крови больных гепатитом С и доноров (Onto E. et al., 1996, Jolivet-Reynaud С. et al., 1998, Masalova O.V. et al., 1998). Подобные исследования наталкиваются на две основные трудности: низкая концентрация вируса и блокирование антигенов ВГС антителами в составе иммунных комплексов (Onto E. et al., 1996, Shiratori Y. et al., 1997). В нашей лаборатории разработан метод для количественного определения соге-белка, входящего в состав циркулирующих в плазме «свободных» вирионов и иммунных комплексов. При исследовании плазм от 80 антиВГС-позитивных доноров оказалось, что вирусная РНК выявляется только в половине образцов. В 94,4% РНК-позитивных плазм выявлен и белок нуклеокапсида ВГС. Концентрация белка core в разных образцах варьировала в широких пределах и составляла 5-850 пг/мл (Масалова О.В. и др., 2000). В сыворотках пациентов с ХГС (n=71) белок нуклеокапсида был обнаружен у 74% больных. Концентрация соге-белка не коррелировала с тяжестью заболевания Показано, что циркуляция ВГС в виде иммунных комплексов ассоциирована с более продвинутой стадией ХГС (согласно значениям ГИС) (Masalova O.V. et al., 2000). Тест-системы для ИФА на основе моноклональных антител, позволяющие определять белок нуклеокапсида не только на качественном, но и на количественном уровне, являются более простым и дешевым, чем ПЦР, методом выявления ВГС. Их внедрение в практику здравоохранения может существенно обогатить возможности современной диагностики и контроля за течением гепатита С.
Таким образом, несмотря на десятилетнее изучение вопроса о связи между присутствием вируса гепатита С в организме и прогрессированием хронического гепатита, многое по-прежнему остается неясным. Данные о роли вирусного генома и вирусных белков в патогенезе инфекции противоречивы. Необходимы дальнейшие исследования по комплексному анализу обоих компонентов иммунного распознавания: вируса (РНК, структурных и неструктурных белков) и иммунной системы хозяина (антител к ВГС, Т-клеток, цитокинов и иммунных комплексов). Эти знания необходимы для разработки эффективных средств профилактики и специфических препаратов для лечения гепатита С, что позволит контролировать это широко распространенное тяжелое заболевание человека.
* Работа поддержана РФФИ, проект № 01-04-48890
«Ласковый убийца»: что гепатит С делает с печенью и как распознать его при первых симптомах?
Чем опасен гепатит С, как им можно заразиться, и правда ли, что современные медпрепараты позволяют полностью излечить инфицированного? Рассказываем в нашем материале.
Что такое гепатит С
Гепатит C или «ласковый убийца» (так иногда называют недуг в народе) — болезнь печени, которую вызывает вирус гепатита C (ВГС). Вначале симптомы могут не проявляться, однако со временем работа жизненно важного органа полностью нарушается, что может привести к летальному исходу. Потому болезнь и получила такое название.
Вирус гепатита С обычно проявляется в двух формах: острой или хронической.
Острая инфекция ВГС чаще всего бессимптомная и лишь иногда приводит к угрозе для жизни. Около 15%–45% инфицированных людей, переживающих острую стадию заболевания, избавляются от вируса в течение полугода после заражения. Причем — без какого-либо лечения. Способность победить болезнь в этом случае зависит от состояния иммунитета и образа жизни инфицированного.
Но 60%–80% больных переходят к хронической стадии заболевания, и в этом случае речь идет о серьезном пожизненном заболевании. У людей с хронической инфекцией вируса гепатита С риск цирроза печени составляет около 15%–30%. Болезнь развивается, как правило, в пределах 20 лет.
Чем опасно заболевание
Когда «болячка» переходит в хроническую стадию, начинают разрушаться клетки печени, и со временем она может полностью утратить функциональность.
В организме это работает так: иммунная система каждого из нас запрограммирована на поиск нездоровых (инфицированных) клеток. Она ведет себя так и в отношении клеток печени, которые поражены вирусом гепатита. При этом клетки печени достаточно хрупкие, а потому быстро гибнут в период этого «сражения». Основные функции органа нарушаются.
Соответственно, чем лучше работает иммунная система, тем больше клеток печени повреждается.
Как можно заразиться гепатитом С
Вирус гепатита С — гемотрансмиссивный, т.е. заразиться можно при контакте даже с небольшим количеством крови. Например:
Как заразиться нельзя:
Симптомы проявления болезни
Острое развитие гепатита С в подавляющем большинстве случаев проходит практически бессимптомно. Характерен лишь астенический синдром — беспричинная слабость, быстрая психическая и физическая утомляемость.
Многие люди списывают подобное состояние на авитаминоз или простуду, переутомление, потому и не задумываются о сдаче анализов. А это крайне важно: при своевременном обращении доля излечившихся доходит до 98%.
Иногда (не более 20%) зараженных гепатитом С могут ощущать:
Иногда к этим симптомам прибавляются такие, как:
Если болезнь из острой стадии перешла в хроническую, то спустя годы, она превращается в стадию декомпенсации ( нарушения нормального функционирования органа, в частности, печени — прим. ред. ). Тогда могут появиться:
Как диагностируется заболевание
На начальной стадии заболевания гепатит С, как правило, проходит бессимптомно. Именно поэтому если человек заразился, условно, месяц назад, диагноза не будет.
Нередко пациент узнает о болезни случайно, сдав кровь на антитела и антигены вируса гепатита С. Например, при подготовке к операции или при расширенных обследованиях организма.
Если результат анализа на антитела и антигены ВГС положительный, то врач назначает еще один скрининг. Это необходимо, чтобы подтвердить или опровергнуть хроническую инфекцию. Проводится новый анализ крови. В частности, специфический тест, который позволяет узнать присутствие в организме РНК вируса (рибонуклеиновой кислоты), т.е. его концентрацию.
Если в результате этих анализов у пациента диагностируется хроническая инфекция гепатита С, следует еще один этап диагностики. В частности, медики определяют степень поражения печени. Это делается с помощью неинвазивных медицинских методов, например, молекулярной диагностики. Метод позволяет узнать о стадии фиброза. Что касается биопсии, то такая процедура проводится сегодня крайне редко.
Острая инфекция вируса гепатита С, как правило, не требует лечения. Около 30% заболевших благодаря хорошей работе иммунитета избавляются от болезни в течение 6 месяцев. Другое дело, что в острой стадии болезнь почти никогда не обнаруживается, ведь она — бессимптомна. Остальные 70% заболевших переходят к хронической стадии заболевания.
По данным ВОЗ за 2018 год, рекомендуется проводить терапию в хронической стадии на основе специальных пангенотипных препаратов прямого противовирусного действия (ПППД).
Курс лечения занимает от 12 до 24 недель и считается коротким. Однако пангенотипные препараты весьма дорогостоящие.
Как сообщает информагентство «Минск-Новости», с 2018 года в нашей стране существуют белорусские дженерические противовирусные препараты прямого действия ( лекарственные средства, содержащее химическое вещество — активный фармацевтический ингредиент, идентичный запатентованному компанией — первоначальному разработчику лекарства ). Их стоимость ниже, а потому они доступны подавляющему большинству заболевших.
Кроме того, Беларусь поддерживает Программу ВОЗ по ликвидации вирусного гепатита С к 2030 году. Борьба с гепатитом С проходит в основном за счет средств государственного бюджета. Порядка 3000 минчан с хроническим гепатитом С приняли помощь и уже избавились от болезни.
Кроме того, с 2009 года на базе Минской городской инфекционной больницы открыт Минский городской центр инфекционной гепатологии. Специалисты готовы ответить на любые вопросы заболевших.
Что будет с печенью, если не лечить гепатит С
Если не лечить хроническую инфекцию гепатита С, то больной в большинстве случаев получит цирроз или рак печени.
По оценкам ВОЗ, в 2016 г. от ВГС умерли приблизительно 399 000 человек, главным образом от цирроза печени и гепатоцеллюлярной карциномы (первичного рака печени).
Полное излечение существует!
Сегодня есть возможность полностью избавиться от болезни. Противовирусные препараты позволяют добиться этого в более чем 95% случаев. Это снижает риск смертности от цирроза или рака печени. К сожалению, доступность к обследованиям и лечению все равно низкая.
Плюс сегодня еще не существует профилактической прививки от гепатита С, ученые лишь работают над ее созданием.
Вирус гепатита С давно перестал быть заболеванием, связанным только с наркоманией. Теоретически, при несоблюдении перечисленных выше правил безопасности заразиться может каждый. Однако стоит помнить, что сегодня заболевание — излечимо. Противовирусные препараты позволяют добиться этого более чем в 95% случаях. Естественно, при условии обнаружения на ранней стадии. Вот почему при малейшем подозрении на заражение лучше сдать кровь и помнить, что инкубационный период болезни в среднем длится 150 суток.
Гепатит C. Симптомы, диагностика, лечение, профилактика
Гепатит C – хроническое инфекционное заболевание, вызываемое вирусом HCV, который поражает в первую очередь печень. Инфекция часто протекает бессимптомно, так что большинство больных даже не подозревают о ее существовании в течение многих лет. Если лечение отсутствует, то инфекция может привести к серьезным осложнениям, таким как цирроз и рак печени. Вирус HCV передается в основном при прямом контакте с кровью.
Строение и функции печени
Печень при весе около 1,2-1,5 кг (около 2% от фактического веса тела) является не только самым большим органом человеческого тела, но и самой большой железой. Находится в правой верхней части живота, чуть ниже диафрагмы. Печень делится на две части: правую и левую доли. Обе доли печени хорошо различимы, потому что они разделены ленточной структурой, исходящей от диафрагмы. Печень состоит из эпителиальных клеток (гепатоцитов), которые выходят наружу из центральной вены. Между этими клетками находятся тончайшие кровеносные сосуды, которые переносят кровь к центральной вене.
Благодаря своему расположению вблизи органов пищеварения печень играет важную роль в утилизации пищевых компонентов. В минуту через печень проходит около 1,5 л крови, что составляет около ¼ части. Она фильтрует кровь, чтобы сохранить другие органы тела от повреждений. Важные вещества, такие как углеводы и белки, могут храниться в клетках печени, а вредные (яды, лекарства), обезвреживаться.
Важной функцией печени является выведение билирубина из кровотока. Гемоглобин, превращается в билирубин в кровотоке в несколько этапов. Конечный продукт направляется через желчный проток в кишечник, где он выводится со стулом. Если эта функция печени нарушена, билирубин не отфильтровывается. В организме образуется его избыток, так называемый затор, что приводит к желтухе.
Формы гепатита C
В зависимости от формы заболевания определяется ход лечения. При своевременном обращении к врачу вероятность полного выздоровления возрастает.
При отсутствии лечения происходит стремительное поражение гепатоцитов, что чревато развитием онкологических заболеваний или цирроза.
Хронический гепатит С: клиника, диагностика, лечение
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Эпидемиология
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Популяция вируса неоднородна. Идентифицированы 6 генотипов (классификация по Simmonds), более 90 субтипов и множество вариантов вируса, обозначаемых как квазивиды. Зарегистрирована территориальная неравномерность циркуляции генотипов вируса гепатита С. В России чаще всего выявляются генотипы 1b и 3а этого вируса.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Патогенез
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Диагностика
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
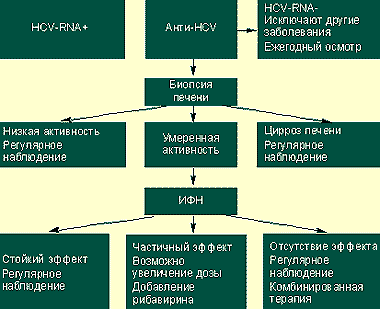 |
| Алгоритм ведения HCV-положительных больных |
Естественное течение и прогноз
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
Клиническая картина
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Внепеченочные проявления HCV-инфекции
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Заболевания, ассоциированные с HCV-инфекцией
Ассоциированные с продукцией или отложением иммуноглобулинов:
Ассоциированные с неизвестным механизмом:
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическое исследование печени
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
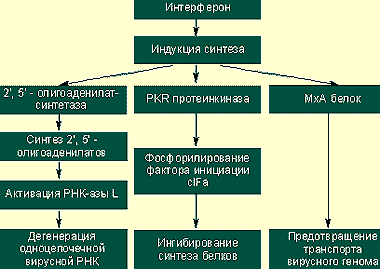 |
| Предотвращение вирусной транскрипции и трансляции |
Лечение
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
Согласно рекомендации согласительной конференции Европейской ассоциации по изучению печени (1999), больным с впервые установленным диагнозом «хронический гепатит С» и показаниями к лечению необходимо назначать ИФa в комбинации с рибавирином следующими курсами:
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Одним из наиболее перспективных пегилированных интерферонов является пегасис — ПЭГ-интерферон альфа-2а, соединенный с разветвленной молекулой полиэтиленгликоля, молекулярная масса которого составляет 40 kDa, общий вес молекулы — около 60 kDa. Особенности химической структуры данного препарата определяют его фармакокинетические свойства и клиническую эффективность. Молекула полиэтиленгликоля присоединена к альфа-интерферону посредством самой стабильной амидной связи, это делает молекулу пегасиса чрезвычайно устойчивой к действию петидаз и позволяет выпускать препарат в виде растворенной и готовой к употреблению лекарственной формы. Особенностью молекулы полиэтиленгликоля является способность активно связывать несколько молекул воды, что создает вокруг химически структурной единицы пегасиса эффект «водного облака», делая ее устойчивой во внутренней среде и сообщая препарату относительно небольшой объем распределения. Это, в свою очередь, способствует тому, что отпадает необходимость в коррекции дозы препарата в зависимости от массы тела пациента: пегасис вводится один раз в неделю в дозе 180 мкг. Существенными преимуществами препарата пегасис являются значительно лучшая переносимость и меньшая частота побочных реакций, ассоциированных с системным действием альфа-интерферона, что значительно улучшает качество жизни пациентов, получающих лечение по поводу хронического гепатита С. Кроме того, в отличие от других пегилированных интерферонов пегасис не требует существенной коррекции дозы в зависимости от функционального состояния почек, что делает препарат незаменимым у пациентов с сопутствующей хронической почечной недостаточностью.
Клиническая эффективность пегасиса оценена солидными широкомасштабными многоцентровыми рандомизированными исследованиями. Было показано, что частота доказанного ответа на лечение значительно превышает таковую по сравнению с «короткими» интерферонами как в схемах монотерапии, так и в сочетании с рибавирином. Особенно впечатляющими в этой связи являются результаты этиопатогенетической терапии с использованием пегасиса в сочетании с рибавирином у так называемой «трудной» категории пациентов, имеющих морфологические проявления цирроза печени, 1b-генотип вируса, высокую виремию: частота доказанного ответа на лечение у данной категории пациентов при использовании пегасиса в сочетании с рибавирином может составлять около 40%, у иных категорий пациентов этот показатель может превышать 75%, что ранее было практически немыслимым результатом.
Другие противовирусные препараты в лечении хронического гепатита С
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию





