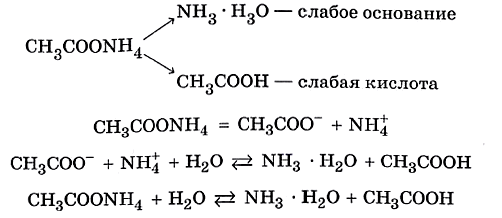Гидролиз что это такое понятными словами
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Гидролиз
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Содержание
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей [1] :
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 

подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:


для соли, образованной сильной кислотой и слабым основанием:


для соли, образованной слабой кислотой и слабым основанием:
Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например,в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также
Примечания
Полезное
Смотреть что такое «Гидролиз» в других словарях:
гидролиз — гидролиз … Орфографический словарь-справочник
ГИДРОЛИЗ — ГИДРОЛИЗ, химическая реакция разделения молекул вещества при взаимодействии с водой. Часто происходит в присутствии КАТАЛИЗАТОРА. Например, при пищеварении ФЕРМЕНТЫ катализируют ГИДРОЛИЗ УГЛЕВОДОВ, БЕЛКОВ и ЖИРОВ, и образуются молекулы, которые… … Научно-технический энциклопедический словарь
гидролиз — фотогидролиз, сольволиз Словарь русских синонимов. гидролиз сущ., кол во синонимов: 3 • реакция (33) • … Словарь синонимов
гидролиз — а, м. hydrolyse f. Реакция ионного обмена между веществами и водой. БАС 2. Лекс. Гранат: гидролиз; Уш. 1935: гидро/лиз; БСЭ 2: гидро/лизный … Исторический словарь галлицизмов русского языка
ГИДРОЛИЗ — (от греч. hydor вода и lysis разделение), процессы расщепления молекул сложных хим. соединений за счет присоединения элементов воды. Следует различать Г. электролитов (гидролитическая диссоциация) и Г. органических соединений. Г и д ролитическая… … Большая медицинская энциклопедия
ГИДРОЛИЗ — (от гидро. и. лиз), химическая реакция разложения вещества водой, например превращение солей в основания и кислоты, крахмала в глюкозу, природных жиров в глицерин и карбоновые кислоты (омыление) … Современная энциклопедия
ГИДРОЛИЗ — ГИДРОЛИЗ, гидролиза, муж. (от греч. hydor вода и lysis развязывание) (хим.). Химическое разложение некоторых веществ действием воды. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГИДРОЛИЗ — ГИДРОЛИЗ, а, муж. (спец.). Реакция обменного разложения соединений с водой. | прил. гидролизный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГИДРОЛИЗ — реакция обменного разложения между водой и разл. хим. соединениями, способными под действием воды расщепляться на более низкомолекулярные соединения с присоединением элементов воды (Н и ОН) по месту разрыва связей. К числу соединений, способных… … Геологическая энциклопедия
гидролиз — Обменная реакция между веществом и водой, приводящая к изменению рН раствора; количеств. характеризуется константой равновесия реакции гидролиза. Кг и а отношением числа частиц ионов или молекул, подвергшихся гидролизу к общему числу частиц,… … Справочник технического переводчика
Гидролиз что это такое понятными словами
Ключевые слова конспекта: Гидролиз необратимый и обратимый. Гидролиз солей в зависимости от силы кислот и оснований, образующих соль. Роль гидролиза в обмене веществ. Роль гидролиза в энергетическом обмене.
Слово «гидролиз» (от др.-греч. hydor — вода и lysis — разложение) буквально означает «разложение вещества водой».
| Гидролиз — реакции обменного взаимодействия веществ с водой, приводящие к их разложению. |
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например:
Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑
Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом:
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз.
Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды.
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.
В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных раствора х.
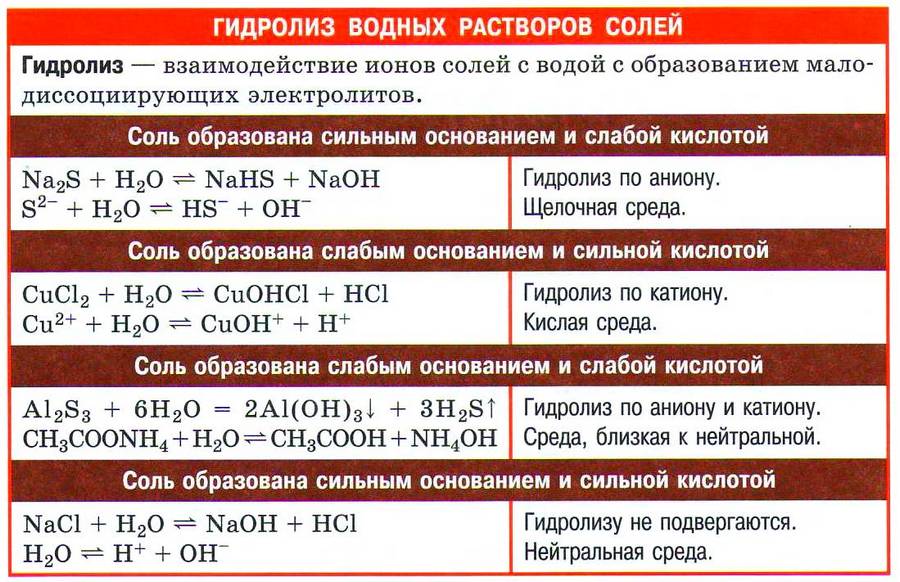
✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:
Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы:
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону.
Молекулярное уравнение гидролиза карбоната натрия имеет вид
✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка:
В водном растворе хлорид цинка полностью диссоциирует:
Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn 2+ способствует накоплению в растворе катионов водорода:
Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:
Реакцию среды в растворе данной соли определяет наличие катионов Н + : среда кислотная.
✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония:
В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов.
Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта.
✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная.
Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой.
Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ.
Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:
Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы.
Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
АТФ + вода —> АДФ + фосфорная кислота + энергия
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.).
В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
АДФ + фосфорная кислота + энергия —> АТФ + вода
Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Конспект урока по химии «Гидролиз». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: