Генерализованная опухоль что это
Программы лечения рака
Виды рака могут классифицироваться в зависимости от местонахождения опухоли, её размеров, причины возникновения и др. На развитие опухолевого процесса в организме могут влиять различные факторы, от неправильного питания до генетической наследственности. Все виды рака требуют определенной схемы лечения, что позволяет сохранить нормальное течение жизни.
Виды рака характеризуются отличием клеточного строения опухоли, динамикой развития, а также уровнем выживания во время лечения.
Онкологические заболевания могут возникать во всех системах и органах организма. Классификация видов онкологических заболеваний происходит в зависимости от места локализации опухоли и множества других факторов. Так процесс развития злокачественной опухоли может происходить в желудочно-кишечном тракте, мочеполовой системе, верхних дыхательных путях и грудной клетке, коже, скелете и мягких тканях, кровеносной и лимфатической системе, головном и спинном мозге. Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Многие виды рака легко диагностируются на ранних стадиях, что позволяет победить онкологическое заболевание результативно и эффективно. В латентный период, когда симптомы и признаки рака еще не проявились у больного, но размножение раковых клеток уже происходит, выявляется форма и вид онкологического заболевания.
Все виды рака проявляются симптоматикой в зависимости от местонахождения опухоли и ее стадии. Болевые синдромы проявляется в месте роста онкологии, а также ухудшается общее состояние организма, незначительно повышается температура, снижается аппетит. Важным условием в эффективном лечении является ее выявление на ранних стадиях, когда раковые клетки еще не попали в кровь и лимфу.
Стадии развития онкологического заболевания
Что же такое метастазы?
Диагностика заболевания методом компьютерной томографии помогает обнаружить вид онкологического заболевания и образование метастазов в организме и подобрать эффективное лечение для улучшения картины заболевания.
Виды раковых заболеваний
Виды рака определяются в зависимости от множества факторов. Онкологическое заболевание классифицируется по нескольким критериям:
Виды рака разделяются по месту нахождения опухоли. То есть органе или системе, где он развивается.
Также виды онкологических заболеваний разделяются по типу ткани. Раковые клетки активно размножаются в мышечной, эпителиальной, костной, сосудистой, нервной и соединительной ткани. Развитие злокачественного образования в нескольких видах тканей называется сложным.
По строению клеток опухоли различают:
По принципу деления раковых клеток разделяют виды клинического, морфологического и гистологического рака.
Факторы риска
Все виды рака возникают в организме под действием определенных факторов. Развитие онкологического заболевания в основном зависит от образа жизни. Неправильное питание некачественными продуктами с большим содержанием канцерогенов вызывают развитие злокачественных опухолей. Чрезмерное употребление алкоголя и курение также является фактором возникновения рака, а также работа на вредных производствах и предприятиях, где происходит накопление организмом ядовитых веществ.
Также на наличие в организме раковых клеток влияет наследственность. Патологические процессы в клетках могут происходить после их мутации во внутриутробном периоде и во время развития организма. Так некоторые виды рака развиваются у новорожденных детей вместе с ростом тканей организма.
Плохая экология и высокий уровень радиации также являются причинами возникновения рака.
Диагностика онкологических заболеваний
Раннее диагностирование заболевания позволяет подобрать эффективное лечение и повысить шансы на выздоровление и сохранение нормального течения жизни больного. Успешный метод лечения возможен только после обнаружения раковой опухоли и определения вида онкологического заболевания.
Диагностика лечения начинается с консультации специалиста и оценки симптомов заболевания, после чего назначается ряд исследований. Виды рака определяются после ультразвукового исследования и взятия биопсии. Полноценный подход к диагностике заболевания с учетом возраста, сопутствующих недугов и факторов риска помогает исключить ложные симптомы.
Методы лечения онкологических заболеваний
В зависимости от вида онкологического заболевания подбираются методы лечения. Наиболее эффективным является комбинированный или комплексный подход к избавлению от недуга.
От вида онкологического заболевания назначается дополнительное лечение, такое как, лучевая терапия и прием химиопрепаратов.
Успешный исход лечения, может быть достигнут, если пациент настроен на лечение и соблюдение врачебных рекомендаций, профилактическим мерам и наблюдению у врача-онколога. Ранняя диагностика онкологического заболевания позволяет избежать усугубления состояния, восстановлению нормального течения жизни, а также избежанию возможности рецидива.
Профилактика онкологических заболеваний
Виды рака должны контролироваться на протяжении всей жизни с использованием скрининговых исследований. Из-за скрытого течения онкологического заболевания симптомы могут проявиться уже в запущенной стадии, когда лечение может быть малоэффективно. Поэтому профилактические обследования и внимательный подход к опасным симптомам помогут сохранить здоровье на долгие годы, а если болезнь все-таки наступила, особенно, если учтены все факторы риска, то это позволит подобрать правильный метод лечения для любого вида онкологического заболевания.
Медицинское общество по лечению
нейроэндокринных опухолей
Современные подходы лекарственного лечения генерализованных форм нейроэндокринных опухолей. Симптоматическая терапия синдромов при нейроэндокринных неоплазиях
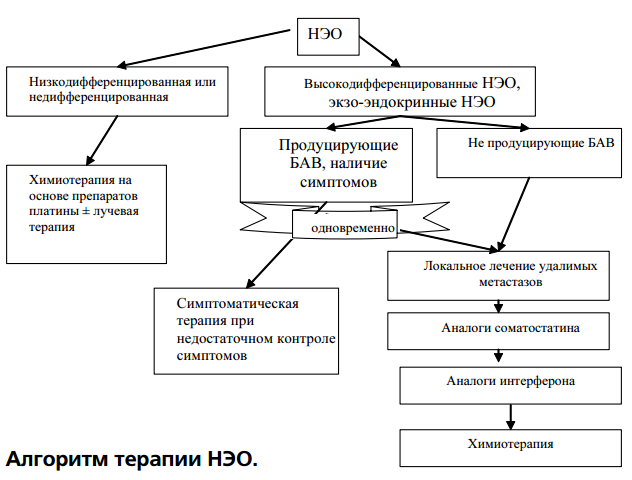
Нейроэндокринные опухоли представляют собой гетерогенную группу заболеваний, что требует дифференцированного подхода к их лечению.
1. Высокодифференцированные НЭО (доброкачественные или низкой. степени злокачественности).
2. Низкодифференцированные (мелкоклеточные) карциномы.
3. Смешанные экзокринно-эндокринные карциномы.
Первая группа характеризуется низким пролиферативным потенциалом, способностью секретировать разнообразные биологически активные вещества и низкой чувствительностью к химиотерапии. К данной группе могут быть отнесены:
— карциноиды (К) различного происхождения (эмбриогенетически развивающиеся в производных передней, средней и задней кишки),
— опухоли из хромаффинных клеток (феохромоцитома),
— медуллярная карцинома щитовидной железы.
Вторая группа представлена высокозлокачественными опухолями с высоким пролиферативным потенциалом, чувствительными к химиотерапии и лучевой терапии. К этой группе может быть отнесен мелкоклеточный рак лёгкого (МЛР).
Для третьей группы характерно наличие клеток как с экзокринной, так и с эндокринной секреторной функцией. К ней относятся различные опухоли поджелудочной железы (ОПЖ); исключение составляют карциноиды. Чувствительность к химиотерапии у данного типа опухолей умеренная [8].
Учитывая системное воздействие опухоли на организм, при лечении НЭО необходимо обращать особое внимание на лечение симптомов заболевания, так как одной из основных целей терапии любой диссеминированной опухоли является увеличение продолжительности качественной жизни.
Ввиду чрезвычайной схожести терапевтических подходов к лечению НЭО в каждой из указанных групп целесообразно рассмотреть терапию наиболее часто встречающихся представителей данного типа неоплазий, а также симптоматической терапии ряда паранеопластических синдромов и дистантных проявлений НЭО.
Учитывая в целом индолентное течение данной опухоли (хотя в некоторых случаях возможно и достаточно агрессивное её поведение), хирургический подход в настоящее время остаётся основным даже при распространенных формах НЭО. Всем пациентам, у которых возможно удаление опухоли, необходимо проводить операцию [7, 8]. В данном случае циторедуктивные вмешательства позволяют, наряду с контролем симптомов и повышением качества жизни, увеличить длительность ремиссии и улучшить прогноз [8].
Отдельно необходимо остановиться на лечении поражений печени при карциноидах. Это связано с высокой частотой метастатического поражения данного органа и резким ухудшением прогноза у этой группы больных.
Эмболизация и химиоэмболизация метастазов, радиочастотная абляция и криодеструкция, как в сочетании с системной терапией, так и без таковой, показали свою целесообразность в некоторых исследованиях. По данным, обобщенным GA Kaltsas [8], локальные методы воздействия на метастазы в печени позволяют достичь регресса карциноида в 35-80 % случаев, при этом контроль симптомов достигается у 50-100 % больных, причем, даже в тех случаях, когда опухоль полностью не удалена.
Дистанционная лучевая терапия, с учетом низкой пролиферативной активности неоплазий данной группы, оказалась неэффективной [8].
Наряду с локальными методами воздействия на опухоль, безусловный приоритет в лечении диссеминированного карциноида остаётся за системной терапией. На протяжении последних 20 лет активно изучалась эффективность цитостатиков и их комбинаций. Результаты этих исследований приведены в табл. 1.
Активность цитостатиков в лечении нейроэндокринных опухолей [1, 6–9, 12]
| Препарат | Частота объективного ответа (%) | ||
| Карциноид | НЭО поджелудочной железы | Мелкоклеточный рак | |
| Монотерапия | |||
| Доксорубицин | 21 | 20 | 25 |
| Фторурацил | 26 | ||
| Дакарбазин | 16-29 | 9 | |
| Препараты платины | 7 | 9 | 63 |
| Алкилирующие агенты (циклофосфамид, ифосфамид) | 9 | 10 | 22-57 |
| Этопозид | 5 | 6 | 82 |
| Стрептозотоцин | 30 | 36-54 | Нет данных |
| Винкаалкалоиды | Нет данных | Нет данных | 26-40 |
| Таксаны | 0-11 | 22-45 | |
| Иринотекан | 0-11 | 50 | |
| Топотекан | 39-75 | ||
| Гемцитабин | 27 | ||
| Полихимиотерапия | |||
| Стз+F | 3-40 | 45-68 | Нет данных |
| Стз+C | 26 | ||
| Стз+A | 40 | 20-69 | |
| Интерферон-альфа + F | 7 | 14 | |
| Д+F | 11 | ||
| CCNU+F | 17 | 40 | |
| Д+эпирубицин+ F | 10 | 26,7 | |
| F+A+P | 10 | 20 | |
| Стз+C+F | 22 | ||
| Стз+C+F+A | 30 | ||
| Стз+A + интерферон-альфа | 10-30 | ||
| ЕР | 0 | 14 | 62–63 |
| Топ+ Е | Нет данных | 14-55 | |
| ЕР + Тр | 50 | ||
| ЕР, чередующийся с Топ+Тр | 77 (62-89) | ||
| Р+Топ | 77 (39-94) | ||
| ЕР + Г | 72,2 (56,5–85,0) | ||
| Рс+Тр+Н | 71 | ||
| ЕР, чередующийся с Топ | 64 (48-79) | ||
| ЕР+К | 77-84 | ||
| Топ+Тр | 28-77 | ||
Сокращения: А – доксорубицин, Е – этопозид, Стз – стрептозотоцин, Р – цисплатин, Рс – карбоплатин, Тр – паклитаксел, Топ – топотекан, Н – ифосфамид, F – фторурацил, Д – дакарбазин, К – иринотекан, С – циклофосфамид, Г – гемцитабин.
Как видно из приведенной таблицы, эффективность монотерапии колеблется в пределах 0-30%. Однако и полихимиотерапия не показала никаких преимуществ перед ней. Необходимо отметить, что недостаточная чувствительность к химиотерапии характерна для большинства НЭО высокой степени дифференцировки. Л ишь при лечении некоторых опухолей этой группы полихимиотерапия позволяет достичь удовлетворительных результатов. Так, стандартом лечения крупноклеточного нейроэндокринного рака лёгкого являются схемы на основе препаратов платины [8].
С введением в клиническую практику аналогов соматостатина и интерферонов началась новая эра в лечении карциноида. Активность данных препаратов представлена в табл. 2. В рандомизированных исследованиях, показано, что биотерапия позволяет увеличить как выживаемось больных, так и качество их жизни, поскольку позволяет контролировать симптомы заболевания практически у всех пациентов [8].
Таким образом, при карциноиде стандартом терапии является применение соматостатина 200-400 мг/сут или его аналогов, например, лартреотида аутогеля 120 мг ежемесячно, соматостатина-ЛАР 30-60 мг 1 раз в 3-4 нед. Для интерферона оптимальной дозой является 3-9 млн. МЕ ежедневно или через день или (в случае пегелиро- ванных форм) 90-100 мкг в неделю [8].
Низкая противоопухолевая активность всех вышеперечисленных препаратов стимулировала поиск путей повышения её эффективности. Но ни комбинированная химиотерапия, ни иммунотерапия, ни химиоиммунотерапия не улучшили результаты лечения [7]. Повышение доз биотерапевтических агентов, хотя и позволяло улучшить контроль симптомов, но не реализовалось в увеличении выживаемости или частоты регрессов опухоли [8].
Многообещающие результаты предоставляет системная лучевая терапия выскодифференцированных НЭО. Использование радиоиодина при опухолях щитовидной железы привело к созданию нескольких препаратов, механизм действия которых основан на захвате опухолью вещества, меченного радиоактивным изотопом. Эффективность данных препаратов представлена в табл. 3.
| Препарат | Объективный ответ (%)/симптоматический эффект | |
| Карциноид | НЭО поджелудочной железы | |
| Интерферон-альфа | 0-22/50-80 | 0-50/70 |
| Октреотид | 0-16/60-90 | 0-17/70 |
| Ланреотид | 0-8/40-90 | Нет данных |
| Интерферон-альфа + октреатид | 0/100 | |
| Интерферон-альфа + гамма | 0/50 | |
| Препарат | Объективный ответ (%)/симптоматический эффект | |
| Карциноид, НЭО поджелудочной железы | РЩЖ | |
| 131 I-MIBG | 15 | 24 |
| 111 In Октреотид | 27 | Не исследовалось |
| 90Y Октреотид | 23 | |
| 90Y лартреотид | 20 | |
| [ 177 Lu-DOTA Tyr 3 ]-октреатид | 29 | |
Относясь к высокодифференцированным опухолям, медуллярный рак щитовидной железы обладает теми же особенностями, что и другие представители этой группы. Хирургический метод является основным не только при первичной опухоли, но и при местном рецидиве заболевания. Как и при карциноиде, эффективность монотерапии колеблется от 0 до 30%. Преимущество при этом отдается терапии с использованием доксорубицина. Химиотерапия не приводит к увеличению выживаемости, однако, позволяет у отдельных больных получить длительные ремиссии. Системная лучевая терапия с использованием метайодбензилгуанидина (табл. 3) обладает гораздо большей эффективностью, позволяя достичь клинически значимых результатов (регресс или стабилизация опухоли, контроль симптомов) у большинства пролеченных больных [8].
Данный тип НЭО имеет некоторое сходство с опухолями нервной ткани, такими как нейробластома, в связи с чем имеются различия в терапии представителей данной группы. Чрезвычайно важным аспектом терапии является симптоматическое лечение сопутствующих симптомов. Вся другая терапия должна проводиться в сочетании с использованием подобных препаратов [8].
Хирургический метод лечения является основным даже при диссеминированном процессе. Циторедуктив- ные операции позволяют не только достичь лучшего контроля за симптомами заболевания, но и в ряде случаев увеличивают эффективность последующего системного лечения.
Значимое место в лечении также занимает системная лучевая терапия (табл. 3) с использованием препарата метайодбензилгуанидина ( 131 1-M1BG) [8].
К данному типу относятся высокоагрессивные, интенсивно пролиферирующие опухоли. Для них проявления самой опухоли выходят на первое место в клинической картине, хотя отдаленные симптомы также встречаются довольно часто. Важной характеристикой этих опухолей является раннее метастазирование, высокая частота поражения головного мозга. Большинство из данных заболеваний высокочувствительны к химиотерапии. Наиболее ярким представителем данной группы опухолей является мелкоклеточный рак лёгкого. Основные принципы его терапии могут быть распространены и на другие локализации низкодифференцированных и недифференцированных НЭО, в том числе с неясной первичной локализацией очага [8, 12].
Многочисленные клинические исследования, проведенные после внедрения в практику препаратов платины, позволили выбрать комбинированную терапию на основе этих препаратов стандартом лечения. Метаанализ, обобщивший 18-летний опыт применения этих комбинаций [3], показал не только высокий уровень объективных ответов, но и явные преимущества в выживаемости больных. Изучение новых цитостатиков и их комбинаций со стандартной химиотерапией в настоящее время не показали значимых преимуществ по сравнению с существующим лечением. В настоящее время активно ведётся поиск новых схем терапии. Большие надежды возлагаются на использование такого препарата, как иринотекан.
Отдельную задачу представляет собой терапия метастатического поражения головного мозга при мелкоклеточной НЭО. Анатомо-физиологические особенности головного мозга, такие как ограниченный объем пространства внутри черепной коробки, наличие гематоэнцефалического барьера и многочисленных функционально и жизненно важных зон, обусловливают резкое ухудшение прогноза пациентов и ставят лечение этих поражений первоочередной задачей. В случае наличия единичных удалимых поражений хирургический подход целесообразен и желателен. При множественном поражении головного мозга возможна неполная циторедукция с последующей лучевой терапией или/и химиотерапией [6]. Несмотря на то, что при метастатическом поражении значительно повышается проницаемость гематоэнцефалического барьера для цитостатиков [13], по нашему мнению, предпочтительнее использовать препараты, проникающие через него ( ломустин, темозоламид, тениопозид). Особо следует подчеркнуть важность профилактического облучения головного мозга при полном регрессе опухоли, поскольку, по результатам метаанализа нескольких рандомизированных исследований, такой подход продлевает жизнь больных [15].
Дистанционная лучевая терапия занимает важное место в лечении низкодифференцированных и недифференцированных НЭО в отличие от высокодифференцированных,. При диссеминированном процессе её можно проводить как на зоны остаточной опухоли, так и на метастазы, особенно в головном мозге. Достаточно широкое распространение получило сочетание химиотерапии с лучевой терапией, когда после нескольких циклов лекарственного лечения проводятся сеансы облучения, после чего химиотерапия возобновляется.
НЭО поджелудочной железы
Как и при других НЭО, локальные методы играют важную роль в лечении данного типа опухолей, так как циторедуктивные операции и химиоэмболизация позволяют достичь удовлетворительных результатов лечения [8]. Химиотерапия позволяет у большинства больных контролировать симптомы заболевания, при этом у половины из них наблюдается регресс опухоли (табл.1). Наиболее приоритетными режимами являются комбинации стрептозотоцина или любого производного нитрозомочевины с доксорубицином или фторпиримидинами. Биотерапия с использованием аналогов соматостатина также эффективна у данной группы больных и в целом используется как стандарт терапии [8] наряду с применением симптоматического лечения, речь о котором пойдет ниже.
— продукции опухолью биологически активных веществ (по этому признаку НЭО делятся на гормональноактивные и неактивные),
— снижения уровня существующих веществ, что приводит к возникновению патологических симптомов,
— ответа организма пациента на наличие опухолевого процесса.
В табл. 4 представлены некоторые из указанных симптомов [2, 8], ассоциированных с НЭО, и их лечение. Основной терапией для всех указанных состояний является лечение первичной опухоли, которое позволяет успешно контролировать симптомы заболевания.
Обобщая вышесказанное, необходимо отметить следующее
1. НЭО являются гетерогенной группой опухолей, характеризующихся как местным воздействием объема опухоли, так и отдаленным воздействием её на организм.
2. В лечении высокодифференцированных опухолей и смешанных экзо-эндокринных опухолей ведущая роль принадлежит локальным методам лечения. Биотерапия с применением аналогов соматостатина и интерферона позволяет контролировать симптомы большинства гормонально-активных НЭО и является стандартом лечения этой группы опухолей.
3. Химиотерапия с препаратами платины является стандартом при лечении низкодифференцированных и недифференцированных НЭО.
Поступила в редакцию 14.11.2005 г.
Рак яичников-современный взгляд на проблему (по данным обзора литературы)
Среди множества патологических процессов наибольший интерес у теоретиков и клиницистов во все времена вызывали те из них, которые чаще всего приводили к гибели или инвалидизации больных. Без преувеличения можно сказать, что самым тяжелым и коварным заболеванием злокачественного генеза у женщин является рак яичников (РЯ). Проблема этой патологии была и остается одной из самых актуальных и трудных разделов онкологии, и поэтому широко обсуждается в различных областях медицины.
Рак яичников (РЯ) наряду со злокачественными опухолями шейки и тела матки является одним из наиболее распространенных заболеваний онкологической природы и в мировой статистике занимает третье место. По данным литературы, карцинома яичников составляет 6-8% из числа всех онкологических заболеваний и 20-25% среди злокачественных опухолей женских половых органов, причем рак яичников составляет около 80% всех опухолей придатков.
Анализ тенденций заболеваемости и смертности и их географических особенностей позволяет приблизиться к пониманию некоторых аспектов этиологии и патогенеза данного заболевания (Макаров О.В., 1996).
В настоящее время накоплено значительное количество экспериментальных, эпидемиологических и клинических фактов, позволяющих обозначить многие стороны этиопатогенеза РЯ, несмотря на это причины возникновения большинства опухолей яичников остаются неизвестными. Обзоры многочисленных исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров, хотя последние исследования не подтверждают связи развития РЯ ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии РЯ, хотя в эксперименте моделей опухоли яичника создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы. В нескольких исследованиях развитие карцином яичников связывают с использованием талька в гигиенических целях.
Л.В. Акуленко с соавт. (1998) предложили критерии идентификации наслед-ственных форм РЯ. Таковыми являются:
Ранняя диагностика РЯ остается главной нерешенной проблемой в онкогинекологии. Клиническое ректо-вагинальное обследование малого таза нередко позволяет идентифицировать новообразование яичников. С 1970-х годов благодаря внедрению ультразвуковых технологий наступила новая эра в диагностике опухолей яичника. Ультразвуковое исследование малого таза стало рутинным методом в обследовании пациентки при подозрение на опухоль яичника. При небольших новообразованиях в малом тазу наибольшей информативностью обладает трансвлагалищная эхография, при образованиях более 6-7 см возрастает роль трансабдоминальной эхографии. Рак яичника на ранних стадиях эхографически представляет собой кистозное образование с единичными сосочковыми образованиями с нечеткими контурами, тогда как при 1С и ІІ стадиях уже визуадизируются обширные папиллярные разрастания с нарушением целостности капсулы кисты и в позадиматочном пространстве определяется небольшое количество жидкости. Для генерализованных стадий РЯ эхографически характерно наличие неправильной формы опухолевого конгломерата кистозно-солидного строения с размытыми границами разрастаниями по наружному контуру. Асцит выявляется в 70-80% набдюдений. При выявлении эхографических признаков злокачественности опухолевого процесса в яичниках и за их пределами необходимо дифференцировать первичность и вторичность поражения яичников.
Эхографические критерии дифференциальной диагностики первичного и метастатического рака яичников
Критерии: первичный рак, метастатический рак
Сторона поражения: чаще двустороннее всегда двустороннее
Структура кистозно-солидная: преимущественно кистозная Солидная,реже-с некрозом в центре
Размеры опухоли: свыше 10 см До 10 см
Контуры опухоли: нечеткие,неровные Четкие, бугристые
Связь с маткой: в конгломерате с маткой связь с маткой отсутствует
Современные стандарты лечения рака яичников были сформированы Интернацио¬нальной группой по изучению рака яичников на 7-ой международной конферен¬ции по онкогинекологии, проходившей в Риме в 1999.
При раке яичников различают пять типов хирургических вмешательств:
При ранних стадиях РЯ, к которым относят la, Ib и Па, в качестве хирургиче¬ского этапа лечения необходимо выполнять пангистерэкгомию с экстирпацией боль¬шого сальника на уровне поперечно-ободочной кишки. Для обоснования ранней ста¬дии, обязательно производится цитологическое исследование перитонеальной жидко¬сти, при её наличии, смывов с брюшины малого таза, боковых карманов брюшной полости, печени и диафрагмы. При низкодифференцированных опухолях необходима биопсия тазовых и парааортальных лимфоузлов. У молодых женщин с высокодиффе-ренцированным раком яичников или опухолями пограничной злокачественности, при желании пациентки сохранить детородную функцию, возможен органосохраняющий объем операции: односторонняя аднексэктомия с обязательной резекцией второго яичника, оментэктомией и цитологическим контролем. В подобных наблюдениях, которые чрезвычайно редки, после родов выполняют экстирпацию матки с оставшимися придатками. Следует помнить, что органосохраняющие операции при раке яичников — это исключение, а не правило.
Лапароскопия при подозрении на РЯ выполняется только в диагностиче-ских целях. Рядом авторов этот метод рекомендован для биопсии тазовых и парааортальных лимфатических узлов, как стандартный. Необходимо избегать неадек¬ватных лапароскопических вмешательств для хирургического лечения рака яич¬ников.
При подтверждении ранней стадии РЯ, адьювантная химиотерапия может не выполняться в случаях пограничной злокачественности и при высокодифференциро-ванном раке. В остальных случаях рекомендована комбинированная химиотерапия в количестве 4-6 циклов препаратами платины с алкилирующими агентами. Примене¬ние таксанов и антрациклинов при индукционной химиотерапии при ранних стадиях РЯ остается дискуссионным. Эффективность таких методов, как лучевая терапия и гормональное лечение при ранних стадиях РЯ не доказана.
При местно-распространенном и диссеминированном процессе, к которому ряд авторов причисляет и 1с стадию, в связи с наличием опухолевых клеток по брюшине, хирургическое вмешательство всегда должно быть этапом комплексно¬го лечения и носить циторедуктивный характер. Оптимальной циторедуктивной операцией считается субтотальная гистераднексэктомия или пангистерэктомия с экстирпацией большого сальника, с уменьшением остаточных опухолевых масс, по мнению разных авторов, от 0,5 до 2 см3. Только оптимальная циторедукция может быть основанием для постановки ШЬ стадии, при которой отдаленные ре¬зультаты заметно лучше, по сравнению с Шс стадией, в которой к сожалению, на¬ходится более половины больных, получивших комплексное лечение. В повседневной клинической практике встречают ситуации, когда полное удаление опухоли невозможно. Массивный канцероматоз, тотально замещенный опухолью “панцирный” большой сальник, прорастание опухоли в диафрагму, ворота печени и ее паренхиму, малый сальник, брыжейку тонкой кишки, забрюшинные пространства часто вынуждают хирурга минимизировать объем хирургического вмешательства. Вместе с тем, всегда следует стремиться к удалению первичной опухоли, большей части сальника и крупных опухолевых узлов на париетальной брюшине.
При Шс стадии объем вмешательства может быть уменьшен только из-за невозможности удаления масс опухоли без повреждения жизненноважных органов. Удаление лимфатических узлов забрюшинного пространства при РЯ, по мнению многих хирургов, носит диагностический характер. Дополнение операции аппендэктомией, спленэктомией, удалением пораженных отделов кишки, может проводиться только с целью достижения условной радикальности операции. Паллиативные вмешательства при нарастании кишечной непроходимости производятся с целью улучшения качества жизни больных. При массивных отдаленных метастазах в пе¬чень и легкие циторедуктивное вмешательство не показано. В свою очередь, около 10% больных раком яичников при первичном обращении оперировать не представляется возможным. Основными причинами подобных клинических ситуаций являются прорастание первичной опухоли в смежные органы и мягкие ткани малого таза, тотальный канцероматоз и множественные метастазы в органы брюшной полости, асцит, плевриты, отягощенное соматическое состояние, пожилой и старческий возраст, резко ослабленное состояние больных. Лечение этой категории больных начинается с системной полихимиотерапии. В результате короткого курса индукционной химиотерапии (2-4 цикла) примерно 30% больных представляется возможным выполнить промежуточную циторедуктивную операцию. Операция предпринимается с целью уменьшения массы первичной опухоли и ее метастазов и, таким образом, повысить эффективность последующей химиотерапии, а также улучшить качество жизни больных. Доказано, что промежуточная циторедуктивная операция повышает выживаемость больных раком яичников.
Прогноз больных раком яичников зависит, прежде всего, стадии заболевания (распространенности процесса), гистологического строения опухоли и плоидности опухолевых клеток. Далее следуют: степень дифференцировки клеток опухоли, экспрессия онкогена HER-2/neu, скорость размножения опухоли, размеры остаточной опухоли после хирургического вмешательства, выраженность асцита и возраст больной. Наиболее неблагоприятным прогнозом отмечаются больные с массивными диссеминированными формами злокачественных эпителиальных опухолей яичников. Полисерозиты и отдаленные метастазы у больных пожилого и старческого возраста, у которых верифицирован светлоклеточный или низкодифференцированный серозный рак с анэуплоидией клеток опухоли сводят шансы на излечение больной практически к нулю. В то время, как высокодифференцированные злокачественные опухоли яичников любого гистологического строения IА и IВ стадий излечиваются в 95-100% наблюдений. Приведенные факторы прогноза у больных запущенными формами рака яичников в связи с массивным распространением и большим суммарным объемом опухоли существенного прогностического значения не имеют, а любые методы лечения носят лишь паллиативный характер.
Статья добавлена 27 марта 2013 г.