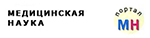зачем снижают иммунитет при коронавирусе
Зачем снижают иммунитет при коронавирусе
Загадки иммунитета. Почему болеть COVID-19 будут не все
Вирус, вызывающий COVID-19, легко передаётся от человека к человеку. Но иногда бывает и так: в семье один болеет, а другой, ухаживающий за ним,— нет. Почему некоторые не заражаются даже при тесном контакте с больным?
Ещё одна загадка: у многих после перенесённого COVID-19 не обнаруживаются защитные антитела. Формируется ли в таком случае у них иммунитет? И есть ли люди, устойчивые к этой инфекции?
Ответы на эти и другие вопросы даёт исследование группы сотрудников Национального медицинского исследовательского центра гематологии Минздрава РФ.
Их статья, только что вышедшая в журнале «Иммунитет» (Immunity), одном из самых авторитетных иммунологических журналов в мире, уже привлекла внимание зарубежных коллег. О своей работе рассказывает один из авторов статьи, к. б. н., завлабораторией трансплантационной иммунологии НМИЦ гематологии Минздрава Григорий Ефимов:
— Мы изучаем, в частности, Т-лимфоциты, которые играют важную роль в противовирусном иммунном ответе. Занявшись их исследованием при COVID-19, мы обнаружили ряд интересных фактов.
Например, выяснили, что Т-лимфоциты, узнающие этот вирус, могут встречаться не только у переболевших, но и у людей, которые никак с вирусом не контактировали. Отдельно мы изучали группу людей, которые были в тесном контакте с больными COVID-19, но не только не имели никаких симптомов заболевания, но и не выработали антител к этому вирусу. Выяснилось, что у многих из них есть Т-лимфоциты, которые узнают коронавирус и, вероятно, обеспечивают им защиту от него.
Здесь нужно объяснить, что система приобретённого иммунитета состоит из двух частей. Первая представлена антителами — это особые белковые молекулы (иммуноглобулины). Они вырабатываются организмом в ответ на атаку вирусов или бактерий и находятся в плазме крови. Такой иммунитет называют гуморальным, от латинского слова «гумор» — жидкость. И сегодня, когда говорят о COVID-19, в основном речь идёт именно о них. Наличие антител в крови используют для подтверждения диагноза. Также эти антитела формируются после вакцинации. Кроме того, сыворотку крови переболевших, содержащую большое количество защитных антител, можно использовать в лечении COVID-19.
Вторая часть приобретённого иммунитета — клеточная. Она представлена особыми клетками — лимфоцитами. Среди которых есть Т-лимфоциты (иногда их называют просто Т-клетки). Одни из Т-лимфоцитов, так называемые Т-киллеры, убивают заражённые вирусом клетки и тем самым препятствуют производству новых вирусных частиц. Другие Т-лимфоциты (их называют Т-хелперами) нужны иммунной системе для выработки противовирусных антител. Т-лимфоциты способны не просто справиться с инфекцией. Они хранят память о столкновении организма с вирусом очень долго, годами. Если вирус снова попадёт в организм человека, то именно благодаря иммунной памяти инфекция не разовьётся или будет протекать значительно легче.
Проводя исследование, мы оценивали количество антител и Т-клеток у 3 групп доноров. В первую вошли те, кто переболел COVID-19, во вторую и третью группы были включены только здоровые доноры, не болевшие коронавирусом. У доноров из второй группы мы брали кровь весной 2020 г., когда пандемия уже была в разгаре. В качестве доноров из третьей группы выступили люди, сдавшие кровь в банк крови нашего Центра гематологии до 2019 г., т. е. тогда, когда мир ещё не столкнулся с COVID-19.
Результаты оказались любопытными. Во-первых, не у всех переболевших COVID-19 обнаруживаются антитела — у части выздоровевших иммунный ответ обеспечивается только за счёт Т-клеток. По всей видимости, их оказывается вполне достаточно для защиты организма.
Во-вторых, и это самое интересное, иногда Т-клеточный ответ на коронавирус наблюдается у людей, которые им не болели. Причём мы наблюдали Т-клеточный ответ у доноров из обеих групп. При этом здоровые доноры, которых мы набирали уже во время пандемии, в среднем имели более высокий уровень Т-клеточного ответа, чем те, кто сдавал кровь до 2019 г. Это, вероятно, связано с тем, что часть здоровых людей так или иначе контактировала с вирусом, не зная об этом.
Но вот как объяснить, что Т-лимфоциты были обнаружены и у тех, кто не мог иметь контакта с возбудителем COVID-19? Скорее всего, это результат так называемого перекрёстного иммунитета. Многие сезонные простудные заболевания, в частности ОРВИ, также вызываются вирусами из семейства коронавирусов. Вероятно, некоторые из них с точки зрения Т-лимфоцитов похожи на вирус, вызывающий COVID-19. Поэтому Т-клетки оказываются заранее готовы к борьбе с ним. Возможно, это делает обладателей перекрёстного иммунитета невосприимчивыми к COVID-19.
В-третьих, мы выяснили, какие именно участки коронавируса распознаются Т-лимфоцитами. Эти данные могут быть использованы для создания теста, оценивающего Т-клеточный иммунитет. Тест позволит понять, перенёс человек COVID-19 или нет, даже при отсутствии у него антител. Это важно, ведь мы знаем, что антитела после инфекции возникают не всегда, особенно у тех, у кого инфекция протекала легко или бессимптомно. Сегодня в таких случаях диагноз подтвердить нельзя.
Мы уже разработали такой тест. Пока пользуемся им в научных целях, но рассчитываем, что уже в начале 2021 г. он будет зарегистрирован и для клинического применения.
Иммунитету в помощь. Почему организму нужен интерферон после прививки
В период вакцинации от COVID-19 у многих возникают разные вопросы: «Как мой организм перенесет прививку? Есть ли риск заболеть ОРВИ? Как защититься от коронавируса между приемами двух компонентов вакцины?» О препаратах, которые помогают не только бороться с вирусом, но и укреплять иммунитет, мы поговорили с Александром Карауловым, доктором медицинских наук, академиком РАН, заведующим кафедрой клинической иммунологии и аллергологии, заведующим лабораторией иммунопатологии ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова».
— Александр Викторович, как организм реагирует на введение вакцины?
— Фактически с помощью вакцины мы тренируем нашу иммунную систему для будущей встречи с возбудителем. Ученые подчеркивают, что примерно 3% населения переносят COVID-19 тяжело, у 0,3% возможно жизненно угрожающее течение заболевания. Причем если раньше мы видели, что тяжелое течение чаще встречалось среди пожилых и пациентов с сопутствующими заболеваниями, то сейчас большинство жизнеугрожающих состояний приходится на пациентов в возрасте от 40 до 60 лет. Только у 50% тех, кто перенес COVID-19, сформировались антитела.
Вакцинация защищает от инфицирования, а если оно все же происходит, то инфекция протекает в легкой форме. Однако поствакцинальный иммунитет у разных групп людей формируется неодинаково. Его формирование может быть замедлено у пожилых людей или пациентов со слабым иммунитетом, то есть у тех, у кого защитные силы организма ослаблены перенесенными или сопутствующими инфекциями, хроническими заболеваниями, стрессом, недостаточностью питания, экологией и т. д.
— Сейчас много говорят об интерферонах, о том, что они укрепляют иммунитет. Уже вышло множество исследований о применении препаратов этой группы при COVID-19, в России они вошли в стандарты оказания медпомощи. А как работают интерфероны при вакцинации?
— Интерфероны в нашем организме выполняют регулирующую функцию. Если говорить иносказательно, то интерферон — это регулировщик на перекрестке: он направляет иммунный ответ в правильное русло, таким образом содействуя выздоровлению. Это свойство интерферона отлично подходит и для подготовки к вакцинации, которая, по сути, также является иммунной реакцией организма, но не с целью выздоровления, а с целью более эффективной выработки антител против возбудителя заболевания.
— Как именно интерферон влияет на уровень выработки антител?
— Интерфероны способствуют активации иммунитета, усиливают продукцию и созревание клеток, которые запускают формирование качественного иммунного ответа. Препараты на основе интерферона можно применять до вакцинации, спустя несколько часов или на следующий день после введения вакцины. Только нужно понимать, что они не действуют мгновенно: это процесс, который потребует определенного времени. С учетом накопленного клинического опыта я бы рекомендовал, например, ректальную форму препарата интерферона в течение пяти дней до вакцинации или пяти дней после. Это может усиливать формирование иммунного ответа и препятствовать возможности заражения пациента другими заболеваниями, пока адекватный уровень антител на введение вакцины еще не выработан.
— А можно ли во время вакцинации заболеть ОРВИ или той же «короной»?
— Заболеть можно, потому что в этот момент вся энергия организма направлена, как я уже сказал ранее, на выработку антител: иммунитет формируется не с первого дня, это уже многократно озвучено. Конечно, есть риск получить другую или ту же инфекцию, от которой вы прививаетесь, если антитела еще не выработались. Чтобы этого не произошло, нужна профилактика. К сожалению, люди так устали от пандемии, что, сделав первую прививку, зачастую перестают даже носить маски. Но важно понимать, что любое заболевание в период вакцинации — это двойная нагрузка на организм. Поэтому нужно очень ответственно вести себя в этот период.
— В каких случаях, помимо вакцинации, можно использовать препараты интерферона во время эпидемии COVID-19?
— Прежде всего — в качестве профилактики гелем, мазью с интерфероном, которые наносятся на слизистую оболочку носа. По сути, это универсальное средство профилактики ОРВИ, эффективность которого доказана еще до пандемии коронавируса, во время ежегодных эпидемий гриппа. Гелевые основы обладают пролонгированным (длительным) профилактическим эффектом, их удобно наносить.
— А можно ли препаратами интерферона лечить COVID-19?
— Что касается лечения, то не могу не обратить внимание на важность применения именно ректальной формы интерферона: свечей. В этом случае организм, ослабленный болезнью, получает недостающий интерферон, необходимый для адекватного ответа инфекции, дополнительно в лекарственном препарате. Свечи оказывают системное действие на организм в целом, то есть интерферон, введенный ректально, может проникать во все органы и ткани, поражаемые вирусом. Сегодня мы столкнулись с огромным количеством нейродегенеративных осложнений COVID-19. Вирус легко проникает в органы центральной нервной системы, вызывая в них порой необратимые изменения. Благодаря ректальному введению интерферон, используя лимфатические пути, способен проникать в спинномозговую жидкость, препятствуя развитию опасных осложнений. Также он быстро доставляется в легкие — недаром он многие годы применяется при лечении пневмоний.
Исследования по применению интерферона при коронавирусе активно идут на Западе и в России. Мы практически ежемесячно получаем новые данные. Например, наши коллеги из Омского медицинского университета провели исследование с участием 140 больных COVID-19. 70 из них получали стандартную терапию, а еще 70 сочетали ее с ректальными суппозиториями «ВИФЕРОН» и гелем, то и другое регулярно применялось в течение 14 дней. По результатам исследования симптомы интоксикации у таких пациентов — головная и мышечная боль, слабость — прекращались на 2-8 дней раньше. Кашель исчезал к 5 дню от начала лечения, насморк регистрировали только в течение 3 дней, нарушение вкуса и обоняния пациенты переставали отмечать к четвертому дню от начала лечения, одышка прекращалась к третьему дню. У пациентов, которые не получали дополнительно интерферон, все симптомы заболевания держались статистически дольше.
Отмечу, что на начальных стадиях заболевания действительно работает правило «чем раньше, тем лучше». Раннее начало терапии интерфероном снижает показатель летальности и демонстрирует лучшие результаты терапии. Это подтвердили исследования наших китайских коллег, показавших, что если исходный уровень интерферона альфа возрастает, допустим, благодаря терапии, то, как правило, нас ждет благоприятный исход заболевания.
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021