зачем после кесарева делают укол в живот
Низкомолекулярные гепарины в лечении и профилактике осложнений послеродового периода при абдоминальном родоразрешении
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Совершенствование профилактики воспалительных и тромботических осложнений с использованием НМГ после операции кесарева сечения у родильниц с факторами умеренного риска развития тромбоза.
Материал и методы. 51 родильница с профилактическим использованием низкомолекулярных гепаринов (НМГ), составившая основную группу, и 60 родильниц (группа сравнения) без использования НМГ. Всем пациенткам проводилось исследование общеклинических и гемостазиологических показателей, определение в сыворотке крови концентраций про- и противовоспалительных цитокинов, эндотоксина, а также допплерометрическое исследование сосудов послеродовой матки.
Результаты. Профилактическое применение НМГ после абдоминального родоразрешения у женщин группы умеренного риска развития тромботических осложнений способствует нормализации гемостатического и воспалительного потенциала крови.
Заключение. Профилактическое применение НМГ после абдоминального родоразрешения у женщин группы умеренного риска развития тромботических осложнений способствует более благополучному течению пуэрперия.
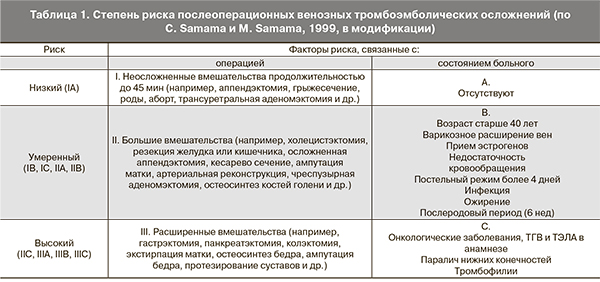
Во многих странах в последние десятилетия отмечается значительный рост тромбоэмболических осложнений при различных заболеваниях, в том числе при патологическом течении беременности, в родах и послеродовом периоде [1, 2]. По данным А.П. Момота, до 50% всех венозных тромбоэмболических осложнений (ВТЭО), возникающих у женщин в возрасте до 40 лет, связаны с гестационным процессом [3]. Доказано, что венозные тромбозы с одинаковой частотой развиваются во время беременности и в послеродовом периоде, тогда как тромбоэмболия легочной артерии (ТЭЛА) наиболее часто наблюдается после родоразрешения [4]. Частоту венозных тромбозов бывает трудно оценить, так как тромбоз глубоких вен (ТГВ) в 38%, а ТЭЛА – в 22% случаев развивается уже после выписки пациентки из акушерского стационара [5]. Развитие венозного тромбоэмболизма потенцируется рядом факторов: кесарево сечение (КС) (особенно экстренное), ожирение, сердечно-сосудистые заболевания, курение, варикозное расширение вен, текущая инфекция, иммобилизация больше 4 дней, носительство отдельных протромботических генов тромбофилии, которые традиционно относят к факторам умеренного риска развития тромботических осложнений [6, 7]. Их взаимодействие приводит к значительному снижению адаптационных способностей организма женщины и может стать своего рода «триггером» в каскаде патологических реакций развития генерализованной микроангиопатии и тромбофилии. Поэтому у женщин, имеющих сочетание этих факторов, имеется риск патологического течения беременности, родов, а также послеродового периода.
Для оценки степени риска развития ВТЭО применяют модифицированную классификацию С. Samama и M. Samama (табл. 1).
В последнее время все больше данных свидетельствует о связи тромботических и воспалительных процессов [8, 9]. Возможно, это является свидетельством того, что, несмотря на широкое внедрение антибиотикопрофилактики и антибиотикотерапии, воспалительные осложнения пуэрперия не стали «болезнью прошлого» и ежегодно фиксируются у тысяч родильниц. Ряд исследователей отмечают, что отличительной особенностью течения послеродовых воспалительных осложнений являются стертые клинические процессы, которые не соответствуют глубине морфологических изменений и не отражают тяжесть состояния родильницы [10–12]. Так, стертая форма метроэндометрита без яркой манифестации встречается в современных условиях чаще (80%), чем классическая (20%) и имеет ряд особенностей, которые необходимо учитывать при диагностике этой патологии [13]. Это определяет подходы к терапии и профилактике осложнений пуэрперия, предусматривающие применение препаратов, изначально нормализующих функции свертывающей системы крови, в частности НМГ. Однако на сегодняшний день нет единого мнения относительно противовоспалительного действия НМГ. Поэтому, несмотря на выяснение некоторых механизмов патогенеза патологических состояний в акушерстве, вопросы разработки эффективных и оптимальных методов терапии и профилактики возникающих осложнений послеродового периода, особенно в ситуациях сочетания факторов умеренного риска тромбоза, продолжают оставаться открытыми.
Цель исследования: совершенствование профилактики воспалительных и тромботических осложнений с использованием НМГ после операции кесарева сечения у родильниц с факторами умеренного риска развития тромбоза.
Материал и методы исследования
Нами проведен анализ клинического течения послеродового периода у 111 родильниц после абдоминального родоразрешения с дополнительными факторами умеренного риска тромботических осложнений, которых выборочно разделили на две группы: I (основная) – 51 родильница, в комплекс терапии которым был включен эноксапарин натрия, II (группа сравнения) – 60 родильниц, которые не получали НМГ. После одобрения этическим комитетом и получения информированного согласия, родильницам основной подгруппы, через 12 ч после абдоминального родоразрешения с целью профилактики воспалительных и тромботических осложнений вводили эноксапарин натрия в дозе 40 мг в сутки в течение 3 дней. В ходе исследования наряду с общеклиническими и гемостазиологическими п.
Осложнения после родов
После родов женщине часто кажется, что все волнения и тревоги позади. Но, увы, иногда первые, самые счастливые дни или недели совместной жизни матери и младенца могут быть омрачены разнообразными осложнениями. В каких же случаях послеродовые изменения являются нормальными, а когда стоит обратиться к врачу?
Какие осложнения могут возникнуть после родов
К врачу-гинекологу нужно обратиться в следующих случаях:
Записаться на прием
Увеличение количества выделений
Если количество выделений резко увеличилось, появились обильные кровяные выделения после того, как их количество уже стало уменьшаться, либо необильные кровянистые выделения долго не прекращаются, появились большие сгустки крови. Обращаться при появлении кровотечения нужно к врачу акушеру-гинекологу, желательно в тот роддом, где принимали роды. Если кровотечение очень обильное (требуется несколько прокладок в течение часа), не нужно идти в стационар самой, необходимо вызвать «скорую помощь».
Задержка части плаценты в полости матки
Самой частой причиной поздних послеродовых кровотечений (то есть тех, которые возникли позже, чем через 2 часа после родов) является задержка части плаценты в полости матки. Диагноз в этом случае подтверждается при ультразвуковом исследовании. Для удаления остатков плаценты проводится выскабливание стенок матки под общей внутривенной анестезией с обязательной последующей антибактериальной терапией для профилактики инфекционных осложнений.
Записаться на прием
Изменения в системе свертывания крови
В редких случаях, причинами кровотечения могут быть изменения в системе свертывания крови наследственного или приобретенного характера, заболевания крови. В этих случаях требуется сложная медикаментозная терапия.
Записаться на прием
Нарушение сокращения мышц матки
Возможно развитие кровотечений, связанных с нарушением сокращения мышц матки. Это так называемое гипотоническое кровотечение. В последовом периоде гипотоническое состояние матки может вызываться ее перерастяжением всвязи с многоводней, многоплодием, крупным плодом, недоразвитием матки. Понижение сократительной способности матки вызывают и изменения в самой ее стенке (миомы, последствия воспалительных процессов, частые аборты). Эти кровотечения чаще всего возникают в первые часы после родов и требуют активного лечения медикаментозными средствами, а в тяжелых случаях и оперативного вмешательства.
Резкое неожиданное прекращение кровянистых выделений также должно насторожить женщину и требует срочного обращения к врачу. В этом случае может нарушаться отток крови из матки, то есть лохии скапливаются в полости и развивается так называемая лохиометра. Кровяные сгустки являются хорошей питательной средой для бактерий, поэтому если лохиометру вовремя не лечить, в полость матки проникают бактерии и развивается эндометрит – воспаление слизистой оболочки матки. После операции кесарева сечения лохиометра возникает чаще, чем после родов через естественные родовые пути. Лечение заключается в назначении средств, сокращающих матку, с одновременным применением спазмолитиков для расслабления шейки матки и восстановления оттока лохий. В некоторых случаях приходится прибегать к вакуумаспирации содержимого матки под общим внутривенным обезболиванием и обязательной последующей антибактериальной терапией.
Записаться на прием
Воспалительный процесс во влагалище или в матке
Записаться на прием
Кандидоз влагалища (молочница)
Появление творожистых выделений, зуда, жжения в области половых органов, покраснения свидетельствует о развитии кандидоза влагалища (молочницы). Риск этого осложнения повышается при приеме антибиотиков. Диагностика основывается на обнаружении в мазке на флору большого количества дрожжеподобных грибов. Для лечения применяют местные препараты в виде вагинальных свечей или таблеток.
Записаться на прием
Послеродовой эндометрит
Гноевидные выделения, боли внизу живота, повышение температуры тела. Эти симптомы могут указывать на развитие серьезного осложнения – послеродового эндометрита (воспаления внутренней слизистой оболочки матки). Чаще всего эндометрит встречается у пациенток после кесарева сечения, ручного обследования послеродовой матки, ручного отделения плаценты и выделения последа (если самостоятельное отделение последа затруднено в связи с нарушением сократительной функции матки), при длительном безводном промежутке (больше 12 часов от моента излития околоплодных вод до рождения малыша), у женщин, поступивших на роды с воспалительными заболеваниями половых путей (например, на фоне инфекций, передаваемых половым путем), у пациенток с большим количеством абортов в прошлом. Классическая форма эндометрита возникает на 1-5 сутки. Температура тела повышается до 38-39 градусов, сердцебиение учащается до 80-100 ударов в минуту. Отмечают угнетение общего состояния, озноб, сухость и гиперемию кожных покровов, болезненность тела матки, гнойные с запахом выделения. Стертая форма возникает на 5-7 сутки, развивается вяло. Температура не превышает 38 градусов, нет озноба. Эндометрит после кесаревасечения всегда протекает в тяжелой форме.
В постановке диагноза врачу помогает ультразвуковое исследование матки и общий анализ крови, в котором выявляются признаки воспаления. Лечение эндометрита необходимо начинать как можно раньше. Проводят его в стационаре. Назначают постельный режим, при остром эндометрите холод на низ живота. Послеродовый эндомерит обязательно лечится антибиотиками, вместе с ними применяют средства, сокращающие матку. В настоящее время во многих клиниках и роддомах проводится промывание полости матки охлажденными растворами антисептиков. В тяжелых случаях обязательно проводится внутривенное вливание солевых растворов для улучшения кровообращения, снятия симптомов интоксикации.
При несвоевременном лечении очень велика опасность распространения воспалительного процесса на всю матку, малый таз, развитием сепсиса (появление в крови инфекционных агентов), вплоть до гибели пациентки.
Записаться на прием
Лактостаз и мастит
В послеродовом периоде возможно появление болей в молочных железах, чувство распирания, повышение температуры тела. При появлении этих симптомов обязательно нужно обратиться к врачу – акушеру-гинекологу в женской консультации или к хирургу.
Возможные причины появления болей в молочных железах и сопутствующего им повышения температуры это лактостаз и мастит.
Лактостаз (застой молока в железе), обусловлен закупоркой выводящих протоков. Чаще всего подобное состояние развивается при неправильном прикладывании малыша к груди, нарушении режима кормлений. Лактостазом чаще страдают первородящие женщины. При застое молока молочная железа увеличивается в объеме, определяются ее плотные увеличенные дольки. Температура тела может повышаться до 38–40 градусов. Отсутствуют покраснение кожи и отечность ткани железы, которые обычно появляются при воспалении. После сцеживания молочной железы при лактостазе боли исчезают, определяются небольшого размера безболезненные дольки с четкими контурами, температура тела снижается. Если лактостаз не устранен в течение 3–4 дней, возникает мастит (воспаление молочной железы), так как при застое молока количество микробных клеток в молочных протоках резко увеличивается, молоко является хорошей питательной средой для различных бактерий, что способствует быстрому прогрессированию воспаления. При развитии мастита температура тела постоянно остается высокой, сопровождается ознобом. Появляются симптомы интоксикации (общая слабость, разбитость, головная боль). Пациентку беспокоит сначала чувство тяжести, а затем боль в молочной железе, что сопровождается застоем молока. Молочная железа увеличивается в объеме, на коже отмечаются участки покраснения. Сцеживание молока болезненное и не приносит облегчения, после сцеживания остаются плотный болезненный участки, сохраняется высокая температура тела. В тяжелых случаях в молоке могут определяться примеси гноя.
Для устранения лактостаза применяют сцеживание, местные противовоспалительные мази, физиотерапевтическое лечение. Мастит лечится при помощи антибиотиков. В некоторых случаях требуется подавление лактации и хирургическое лечение.
Записаться на прием
Послеродовой пиелонефрит
Повышение температуры тела, боли в спине или боку, болезненное мочеиспускание. Эти симптомы могут свидетельствовать о развитии послеродового пиелонефрита, то есть воспаления почек. Критическими периодами для развития послеродового пиелонефрита врачи считают 4-6 и 12-14 сутки послеродового периода. Развитие заболевания связано с попаданием инфекции в мочевыводящие пути из половых путей. Чаще всего заболевание развивается у родильниц, в моче которых во время беременности обнаруживали небольшое количество бактерий. В постановке диагноза врачу помогают ультразвуковое исследование почек и мочевого пузыря и анализ мочи.
Лечение пиелонефрита обязательно проводится антибиотиками.
Записаться на прием
Венозный тромбоз
Боли в ногах, отечность, появление покраснения на ногах по ходу вены, усиление болей при ходьбе – являются симптомами серьезной патологии – венозного тромбоза (образования сгустков крови в венах) и требуют срочного обращения к врачу хирургу или флебологу. Самыми опасными периодами для возникновения тромбозов считают 5-6 сутки после родов или операции кесарева сечения, реже тромбозы возникают через 2-3 недели после родов. Причинами тромбозов являются изменения в свертывающей системе крови, возникающие во время беременности и после родов. Физиологически, в послеродовом периоде происходит активация свертывающей системы. Поскольку организм старается прекратить кровотечение. В то же время тонус сосудов малого таза и нижних конечностей снижен, вены еще не успели приспособиться к работе в новых условиях. Эти условия и запускают механизмы образования тромбов. Немаловажную роль в развитии послеродовых венозных тромбозов играет и гормональный фон, резко меняющийся после окончания беременности.
Особенно велик риск развития венозных тромбозов у женщин с различными патологиями системы свертывания крови, которые выявляются еще до беременности или во время вынашивания малыша. Высока вероятность тромбоэмболических осложнений и при наличии заболеваний сердечно-сосудистой системы, избыточной массы тела. Повышается риск тромбоза и у женщин в возрастной группе после 40 лет, при наличии варикозной болезни нижних конечностей. Увеличивается риск тромбообразования у женщин, перенесших операцию кесарева сечения. В постановке диагноза врачу помогает ультразвуковое исследование вен, с допплерографией, то есть оценкой кровотока в сосудах. Для лечения венозных тромбозов применяют медикаментозные средства, ношение компрессионного трикотажа.
Записаться на прием
Неприятные ощущения в области послеоперационных швов
Могут беспокоить неприятные ощущения в области послеоперационных швов после кесарева сечения или в области швов на промежности. В норме после ушивания разрывов влагалища могут быть небольшие болевые ощущения 1-2 дня, но они быстро проходят. Боли в области послеоперационной раны после кесарева сечения могут беспокоить в течение 2 недель, постепенно уменьшаясь. Ощущение тяжести, распирания, боли в области послеоперационной раны может говорить о накоплении гематомы (крови) в области швов. Обычно это бывает в первые трое суток после родов и требует хирургического лечения – удаления скопившейся крови. Боль, жжение, кровоточивость швов, появление выделений с неприятным запахом, отечности в области наложенных швов, повышение температуры тела свидетельствует о присоединении инфекции и нагноении швов. В этих случаях также следует обратиться к врачу для обработки раны и решения вопроса о дальнейшем методе лечения.
Записаться на прием
Недержание мочи, кала, выпадение матки
Записаться на прием
Геморрой
В любом случае, при возникновении каких-либо симптомов, причиняющих беспокойство, желательно обратиться к врачу, ведь любое осложнение лучше предупредить или лечить в самой начальной стадии.
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
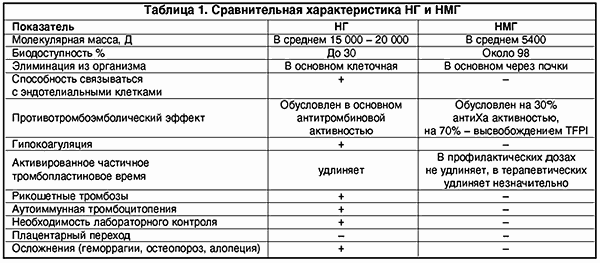
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.