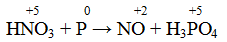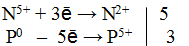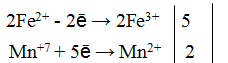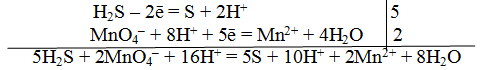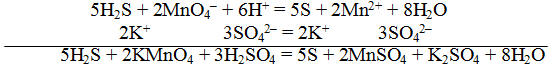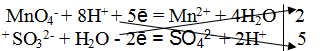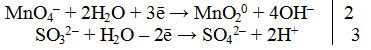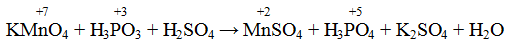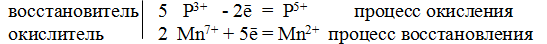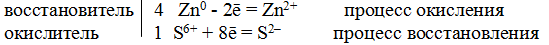зачем нужен метод электронного баланса
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод электронного баланса
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР.Для правильного уравнивания следует придерживаться определённой последовательности действий:
Теперь рассмотрим конкретный пример
N присоединяет электроны, он-окислитель
Li отдаёт электроны, он-восстановитель
6Li + N2 = 6Li +1 + 2N −3
Рассмотрим более сложный пример
В результате реакции происходит окисление атомов железа, окисление атомов серы и восстановление атомов кислорода.
Суммарно для обоих процессов можно записать так:
Fe +2 + S −2 — 7e = Fe +3 + S +4
Записываем полуреакцию для кислорода:
4*| Fe +2 + s −2 — 7e = Fe +3 + S +4
4Fe +2 + 4S −2 + 7O2 = 4Fe +3 + 4S +4 + 14O −2
Полезное
Смотреть что такое «Метод электронного баланса» в других словарях:
Химическое уравнение — Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную… … Википедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
ПОЛИГРАФИЯ — техника многократного получения одинаковых изображений (оттисков) путем переноса красочного слоя с печатной формы на бумагу или другой материал. Собственно процесс переноса изображения с печатной формы на бумагу называется печатанием. Но это… … Энциклопедия Кольера
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Электронные деньги — (Electronic money) Электронные деньги это денежные обязательства эмитента в электронном виде Все, что нужно знать об электронных деньгах история и развитие электронных денег, перевод, обмен и вывод электронных денег в различных платежных системах … Энциклопедия инвестора
система — 4.48 система (system): Комбинация взаимодействующих элементов, организованных для достижения одной или нескольких поставленных целей. Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документации
Денежно-кредитная политика — (Monetary policy) Понятие денежно кредитной политики, цели денежно кредитной политики Информация о понятии денежно кредитной политики, цели денежно кредитной политики Содержание >>>>>>>>>> … Энциклопедия инвестора
Оптовые запасы — (Wholesale Inventories) Определение оптовых запасов, торговые и складские запасы Информация об определении оптовых запасов, торговые и складские запасы Содержание Содержание Виды запасов и их характеристики Торговые и складские запасы Принципы… … Энциклопедия инвестора
Рецессия — (Recession) Содержание >>>>>>>>> Рецессия это, определение это производительности, которое характеризует нулевой или отрицательный основной показатель внутренний валовый продукт, протекающий на протяжении полугода и более … Энциклопедия инвестора
Химия. ОВР. Метод полуреакций VS метод электронного баланса
Возьмем вот такую реакцию
Первым делом разбиваем все растворимые молекулы на ионы и расставляем степени окисления каждой из них. Получается так
Смотрим на данную запись и определяем, какие ионы меняют степень окисления в ходе реакции. Видно, что это ионы, содержащие Mn и S. Они и будут входить в наши полуреакции. Начнем с марганца.
для кислорода 4+x*1=2+y*1
для водорода x*2 = y*1
Из этой системы легко найти y=2x=4
Поскольку ион в данной полуреакции забирает электроны (+2е в левой части), значит, это полуреакция восстановления, а сам ион является окислителем.
Полуреакция с участие атомов серы.
Алгоритм тот же. Уравниваем атомы серы (выполнено), уравниваем кислород и водород с помощью воды и гидроксо-группы (не требуется, так как в ион нет ни кислорода, ни водорода), уравниваем заряды с помощью электронов.
Поскольку ион в данной полуреакции теряет электроны (-2е в левой части), значит, это полуреакция окисления, а сам ион является восстановителем.
Записываем рядом обе полуреакции. Выравниваем количество электронов в них, умножая полуреакцию окисления на количество электронов в полуреакции восстановления и наоборот. Так как у нас количества электронов оказались равны, после сокращения получаем, что обе полуреакции нужно умножить на 1.
Записываем ионно-молекулярное уравнение с учетом полученной информации. Мы пропишем все единицы, но вообще, можно их не писать, это же единицы.
Теперь возвращаемся к молекулярной записи уравнения.
Уравниваем атомы калия = слева 4, справа 1, значит, справа должно быть 4 атома.
Проверку обычно делают по атомам кислорода. Слева 4+2=6. Справа 2+4=6. Все верно.
Метод электронного баланса
Расставляем степени окисления всех атомов в реакции
Выбираем те атомы, которые в ходе реакции поменяют степень окисления. Это атом марганца
Теперь, не трогая те молекулы, где коэффициент уже стоит, уравниваем остальное. Слева 4 атома калия, справа 1, значит, калий в правой части умножаем на 4
Слева 2 атома водорода, справа 4, значит, водород в левой части умножаем на 2.
Все коэффициенты расставлены, проверяем по кислороду. Слева 4+2=6. Справа 2+4=6. Все верно.
Результаты расстановки коэффициентов двумя методами совпали.
Каким методом лучше пользоваться? Все зависит от ваших предпочтений и навыков. На наш взгляд метод электронного баланса проще и короче, поэтому, когда нужно быстро, «на коленке» расставить коэффициенты, мы используем его.
Ну, а для максимальной скорости и для самоконтроля можно использовать онлайн-ресурсы. Там результат будет получен мгновенно, правда, без объяснений
Надеемся, что материал данной статьи был полезен для вас.
ЭЛЕКТРОННО-ИОННЫЙ БАЛАНС
В КУРСЕ НЕОРГАНИЧЕСКОЙ ХИМИИ
СРЕДНЕЙ ШКОЛЫ
Тема «Окислительно-восстановительные реакции» является одной из самых важных и сложных тем курса химии, без заданий по этой теме невозможно представить себе ни один вариант экзамена по химии – будь то выпускной в школе или вступительные испытания в вуз. Наши выпускники сдают ЕГЭ пока еще только в рамках эксперимента, но уже сейчас понятно, что все три части ЕГЭ по химии обязательно включают в себя вопросы по теме «Окислительно-восстановительные реакции».
Теоретически программы учебных предметов школьного и абитуриентского уровня должны совпадать, недаром же в любой программе для поступающих в вузы в разделе «литература» в качестве основных учебных пособий указываются школьные учебники. И действительно, названия тем в школьной и абитуриентской программе всегда одинаковы. Разница же – в уровне сложности, в перечне вопросов, скрывающихся за названием большой темы курса, в объеме знаний и умений, которыми должен обладать выпускник общеобразовательной школы и абитуриент, поступающий в вуз химического или медицинского профиля. Характерным примером вышесказанного является тема «Окислительно-восстановительные реакции» (ОВР).
На уроках химии в школе мы вводим основные понятия теории ОВР (степень окисления, окислитель, восстановитель, процессы окисления и восстановления) и учим школьников уравнивать окислительно-восстановительные реакции методом электронного баланса. Этот метод позволяет расставить коэффициенты в реакции, реагенты и продукты которой известны.
Методом электронно-ионного баланса
можно составить уравнение ОВР, а не только
расставить коэффициенты
Сдавая вступительный экзамен по химии в институт, абитуриент сталкивается с заданиями, в которых нужно не только уравнять, но и составить уравнение окислительно-восстановительной реакции, а это, не владея методом электронно-ионного баланса, сделать очень трудно. В качестве примера приведем одно из заданий части С ЕГЭ по химии 2007 года.
«Составьте уравнение окисления йодида калия перманганатом калия в сернокислом растворе. Приведите схему электронного (или электронно-ионного) баланса».
Ученику дается право выбора, и это задание действительно можно выполнить, владея только электронным балансом и хорошо понимая основные положения теории ОВР. Но с помощью электронно-ионного баланса данное задание выполняется гораздо проще и, что немаловажно, быстрее.
Таким образом, становится совершенно очевидным, что для обеспечения своим ученикам непрерывного образования мы должны познакомить их (на занятиях элективных курсов, в рамках факультатива или предметного кружка) с методом электронно-ионного баланса.
При использовании метода электронно-ионного баланса следует иметь в виду, что в водных растворах связывание избыточного кислорода у окислителя и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Кроме того, при записи полуреакций, в отличие от метода электронного баланса, записывают только те частицы, которые существуют в растворах на самом деле, – для сильных электролитов учитывают диссоциацию и записывают реально существующий ион, а слабые электролиты записывают в полуреакциях в виде молекул. Например, используя метод электронного баланса, мы в случае восстановления перманганата калия в кислой среде запишем:
При использовании метода электронно-ионного баланса данная полуреакция будет иметь вид:
В процессе выполнения упражнений у учащихся накапливается «база данных» наиболее часто встречающихся полуреакций, что позволяет в дальнейшем достаточно легко прогнозировать продукты окислительно-восстановительных реакций.

Рассмотрим алгоритм составления ОВР с использованием метода электронно-ионного баланса на примере вышеупомянутой реакции из заданий ЕГЭ.
1. Записываем реагенты ОВР, определяем окислитель, восстановитель и среду раствора:
2. Записываем полуреакцию с участием окислителя, рассуждая следующим образом: перманганат калия является сильным электролитом (растворимая соль), поэтому в растворе восстановлению будет подвергаться перманганат-ион. В кислой среде перманганат-ион восстанавливается до катиона Mn 2+ . Уравниваем полуреакцию с помощью протонов и молекул воды (см. схемы полуреакций в кислой среде). Суммируем заряды ионов в полуреакции (до и после) и по разнице сумм находим число принятых или отданных в полуреакции электронов:
(процесс восстановления, участвует окислитель)
3. Записываем полуреакцию с участием восстановителя, рассуждая следующим образом: йодид калия является сильным электролитом (растворимая соль), поэтому в растворе окислению будут подвергаться йодид-ионы. В процессе окисления их степень окисления будет повышаться (возможны варианты до степени окисления 0, +1, +3, +5, +7). Наиболее устойчивой является степень окисления 0, т.е. логично ожидать образования в продуктах реакции молекулярного йода. (На самом деле в растворе будет присутствовать смесь продуктов окисления, но в уравнении записывают наиболее устойчивый из них.) Уравниваем полуреакцию (т.к. необходимо уравнять только иод, протоны и молекулы воды для уравнивания не используем):
(процесс окисления, участвует восстановитель)
4. Составляем электронно-ионный баланс: находим наименьшее общее кратное между числом принятых и отданных в полуреакциях электронов (10); разделив наименьшее общее кратное на число электронов в каждой полуреакции, получаем коэффициенты к полуреакциям:
5. Суммируем полуреакции с учетом коэффициентов, при этом получаем ионное уравнение окислительно-восстановительной реакции:
6. Если есть необходимость, взаимно уничтожаем одинаковые частицы в левой и в правой части ионного уравнения (в данном случае такой необходимости нет).
7. Переносим полученные коэффициенты в уравнение, одновременно «достраивая» ионы до молекулярной формы. Для образования 2 молекул перманганата калия добавляем в левую часть уравнения 2 катиона калия; 16 протонов дадут нам 8 молекул серной кислоты, но для этого к ним необходимо добавить 8 сульфатных остатков, 10 йодид-ионов потребуют при «достройке» до молекулярной формы 10 катионов калия. Таким образом, для перевода исходных реагентов из ионной формы в молекулярную в данном случае мы используем 12 ионов калия и 8 сульфат-ионов, тогда как для перевода продуктов реакции подобным образом из ионной формы в молекулярную необходимо только 2 сульфат-иона (для перевода катионов марганца в сульфат марганца). Оставшиеся 12 катионов калия и 6 сульфат-ионов связываются между собой с образованием 6 молекул сульфата калия. Полученное молекулярное уравнение окислительно-восстановительной реакции имеет вид:
Таким образом, метод электронно-ионного баланса позволяет не только уравнивать, но и одновременно составлять окислительно-восстановительную реакцию. Надо отметить, что в курсе органической химии метод электронно-ионного баланса находит столь же широкое применение.
Упражнения на составление ОВР методом электронно-ионного баланса в курсе неорганической химии опубликованы в газете «Химия» ИД «Первое сентября» (2006, № 13, с. 12–17).
Составление уравнений окислительно-восстановительных реакций
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Составление уравнений окислительно-восстановительных реакций.
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
3) Составить электронный баланс
4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
1. Составить схему реакции
2. Составить электронно-ионные уравнения
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
2. Составить электронно-ионное уравнение
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn +7 ). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Составляем уравнение реакции: