Высокодозная химиотерапия что это
Химиотерапия: что это и как ее делают при онкологии
Лекарственная противоопухолевая терапия, в том числе и химиотерапия, – один из основных методов лечения рака. При химиотерапии в человеческий организм вводятся различные токсические вещества, которые губительно воздействуют на клетки злокачественных опухолей. Важно при этом, чтобы яды и токсины оказывали наименьшее отрицательное воздействие на весь организм больного.
Схемы химиотерапевтического лечения регламентируются международными методиками и правилами, и рассчитываются индивидуально. Врач-химиотерапевт подбирает пациенту лечение, руководствуясь различными критериями, среди которых:
Виды химиотерапии
Сложные комбинации из нескольких химиопрепаратов на сегодняшний день используются чаще, так как они более эффективные.
Химиотерапия нередко применяется как часть комбинированного лечения рака:
Дозы и режимы применения противоопухолевых препаратов
Противоопухолевые лекарственные препараты и их дозировка подбираются строго индивидуально.
У каждого препарата имеются свои характеристики и особенности. При проведении химиотерапии важными являются следующие параметры:
Дозу препарата рассчитывают исходя из схемы химиотерапии, роста, веса, возраста, состояния больного, а в некоторых случаях, на основании лабораторных показателей пациента.
Режимы
Если необходимо повысить интенсивность химиотерапии, то увеличивают дозу препарата, это так называемая высокодозная терапия, либо сокращают интервал между курсами ХТ, то есть вводят уплотненные режимы.
Также существуют метрономные режимы применения цитостатических препаратов, когда вводятся малые дозы препаратов, но постоянно в течение длительного времени.
После каждого курса химитерапевтического лечения обязательно делается определенный перерыв для восстановления организма. Как правило, повторные курсы ХТ проводят через каждые три-четыре недели, это период, в течение которого восстанавливаются показатели лейкоцитов, тромбоцитов и пр.
При использовании некоторых химиопрепаратов, к примеру, нитрозопроизводных, этот интервал увеличивается до 6 недель.
Продолжительность лечения и количество курсов химиотерапии зависит от вида опухоли, от особенностей течения болезни от того, как организм реагирует на лечение. Иногда возникает необходимость прекратить или изменить лечение, и это решение принимает лечащий врач.
Способы применения химиопрепаратов
Правила введения противоопухолевых препаратов
Наиболее широко используется внутривенное введение противоопухолевых средств. При этом врач обязательно учитывает индивидуальные особенности вен пациентов.
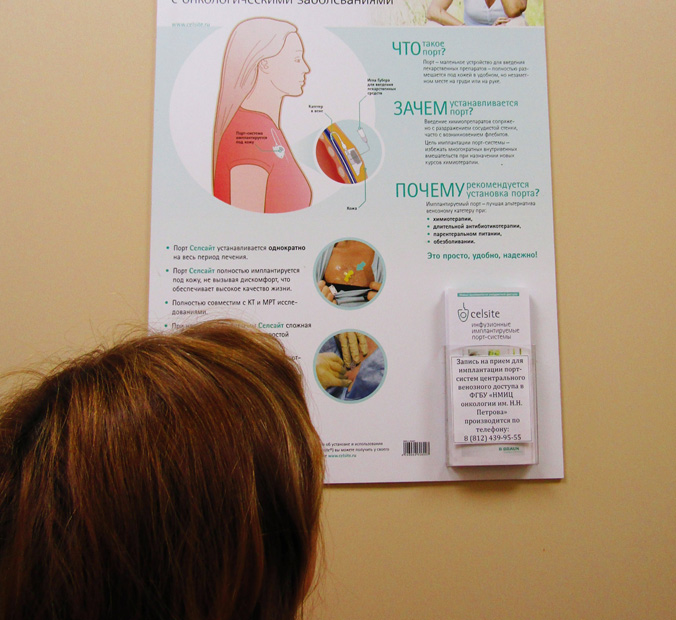
Имплантируемые порт-системы
Имплантируемая порт-система — это катетер, установленный в сосуд или полость и соединенный с ним резервуар-камера. Система «порт — катетер» широко используется в медицине уже более чем 30 лет.
Порт-системы помогают проходить лечение более эффективно, безопасно и качественно. Особенно актуальна их установка в качестве устройства сосудистого доступа пациентам, которым назначено длительное лечение, при осложнениях на фоне химиотерапии, которые привели к затруднению венозного доступа.
При этом терапию пациент может получать как в условиях стационара, так и амбулаторно.
Инфузия лекарственных препаратов производится с помощью специальных игл типа Губера, которые, пунктируя силиконовую мембрану порта, позволяют вводить инфузионный раствор в резервуар, не повреждая силиконовую мембрану. Далее препарат попадает через катетер в кровоток или полость, в зависимости от вида порт-системы и места расположения катетера.
Порт- система полностью скрыта под кожей. Поэтому она подходит для длительного использования, не обременяет пациента и не мешает проведению гигиенических процедур. Необходимо помнить, что при отсутствии использования порт-систему необходимо промывать как минимум 1 раз в 2 месяца.
Подготовка к химиотерапии
Чтобы не было проблем с поиском вен и установкой катетера за день до химиотерапии желательно выпить 1,5-2 литра жидкости.
Для тренировки вен рекомендуется периодически сжимать кистевой эспандер по 10 мин 3 раза в день или до усталости. При этом рука должна быть свешена ниже уровня сердца.
В день проведения ХТ нужно держать руки в тепле, возможно применение теплых обертываний на места инъекций. Можно периодически обрабатывать руки теплыми полотенцами.
Во время прохождения химиотерапии
В день химиотерапии, с утра необходимо позавтракать.
Далее необходимо соблюдать несколько несложных правил:
Об осложнениях после химиотерапии читайте здесь.
Возможно ли повысить эффективность химиотерапии?
Поиск основных направлений повышения эффективности терапии опухолей осуществляется в разных направлениях:
Высокодозная химиотерапия и трансплантация костного мозга в детской онкологии
Трансплантация (пересадка) гемопоэтических стволовых клеток (ТГСК) костного мозга и периферических стволовых клеток является одним из ведущих методов лечения детей, страдающих злокачественными опухолями.
Необходимо отметить следующие принципиально важные моменты, от которых зависит успех выполнения ТГСК:
ВИДЫ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Трансплантацией гемопоэтических стволовых клеток называется введение реципиенту (больному) взвеси гемопоэтических стволовых клеток (ГСК) после назначение ему миелоаблативных доз облучения и (или) максимально переносимых доз цитостатических (противоопухолевых) препаратов.
В зависимости от источника получения трансплантируемых клеток ТГСК подразделяется на следующие виды:
Показания к выполнению алло-ТГСК у детей со злокачественными опухолями:
Показания для проведения ауто-ТГСК у детей со злокачественными опухолями:
Злокачественные заболевания системы крови.
Абсолютными показаниями для выполнения алло-ТКМ при наличии HLA-совместимого донора костного мозга являются:
Безрецидивная выживаемость в течение 5 лет у больных ХМЛ, перенесших алло-ТКМ в хронической стадии, составляет 50-60%, ОЛЛ (высокий риск, 1-2 ремиссия) – 50-60%, ОнеЛЛ – 45-65%.
После ауто-ТКМ у детей 5-летняя безрецидивная выживаемость при экстрамедуллярном рецидиве ОЛЛ достигает 65%, а при ОнеЛЛ – 50%.
Тем не менее до настоящего времени нет однозначного времени о сроках выполнения алло-ТГСК и ауто-ТГСК у детей при ОЛЛ и ОнеЛЛ, болезни Ходжкина и неходжкинских лимфомах, поскольку результаты стандартной химиотерапии в некоторых случаях не уступают эффективности ТГСК.
РЕЖИМЫ КОНДИЦИОНИРОВАНИЯ
Эффект цитостатической химиотерапии и лучевой терапии при злокачественных опухолях зависит от дозы назначаемых препаратов и дозы облучения. Режимом кондиционирования называется назначение миелоаблативных доз и (или) максимально переносимых доз цитостатических препаратов с целью достижения высокого уровня иммуносупрессии и по возможности полной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением ему ГСК костного мозга или периферической крови.
Степень иммуносупрессии определяет не только приживление аллогенного костного мозга, но вероятность реакции отторжения трансплантата после алло-ТГСК. Выбор комбинации различных цитостатиков и лучевой терапии перед ТГСК зависит от источника трансплантируемых клеток (аллогенный, аутологичный), типа и стадии заболевания )заболевания системы крови, солидные опухоли, рецидив, ремиссия).
Наиболее распространенные режимы кондиционирования
Использование сверхвысоких доз цитостатиков и лучевой терапии часто приводит к развитию осложнений со стороны внутренних органов (сердца, печени, легких, почек и др.) как в ближайшие сроки после назначения высокодозной химиолучевой терапии, так и в отдаленном периоде.
ПОДБОР ДОНОРА КОСТНОГО МОЗГА (ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК)
Одним из основных факторов, определяющих успешность выполнения алло-ТКМ, является подбор совместимого по HLA- системе донора костного мозга (периферических стволовых клеток) Донором костного мозга может являться полностью совместимый по HLA-системе здоровый человек в возрасте до 50 лет.
В случае отсутствия полностью совместимого донора возможно использование частично совместимого донора. При выборе донора костного мозга не имеют различия по группе крови и половой хромосоме.
Подбор донора периферических стволовых клеток (ПСКК) осуществляется на основании принципов выбора донора костного мозга.
ВЗЯТИЕ КОСТНОГО МОЗГА
Забор костного мозга выполняется под общей анестезией (наркозом), хотя возможно использование перидуральной (спинномозговой) анестезией. Костный мозг получают с помощью игл с большим диаметром отверстия путем множественных пункций гребня крыла подвздошной кости с обеих сторон. Объем костного мозга, получаемы в результате этой процедуры, не должен превышать 10-15 мл/кг массы тела донора.
С целью профилактики развития острой реакции “трансплантат против хозяина” (РТПХ) возможно удаление Т-лимфоцитов с помощью моноклональных антител из аллогенного костного мозга перед его введением. Аутлогичный костный мозг может быть очищен от примеси злокачественных клеток с использованием цитостатиков.
Процедура взятия (эксфузии) костного мозга не вызывает серьезных осложнений у 99% доноров, однако развитие осложнений может быть обусловлено влиянием наркоза или состоянием после быстрой кровопотери.
Инфузия (введение) костного мозга реципиенту при алло-ТКМ или сингенной ТКМ производится внутривенно, капельно, через 24-48 часов после окончания химио- или лучевой терапии. Введение аутологичного костного мозга проводится тем же способом, максимально быстро после его размораживания при температуре +42…+45 гр.С.
ВЗЯТИЕ ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
До последнего времени основным источником ГСК при трансплантации был костный мозг (аллогенный, аутологичный).
Вместе с тем ТКМ имеет ряд недостатков:
В вязи с этим была предложена ТПСКК, физиологической основой которой явились данные о выходе стволовых клеток из костного мозга в кровь.
ТПСКК имеет ряд преимуществ по сравнению с ТКМ:
Мобилизация ПСКК может выполняться с помощью цитостатиков (циклофосфан, ифосфамид и др.). Однако у детей основным средством для мобилизации ПСКК являются рекомбинантные ростовые факторы (нейпоген, граноцит, лейкомакс).
Забор ПСКК проводят обычно на 4, 5, 6-й дни с начала введения колониестимулирующего фактора (КСФ). В это время наблюдается значительное повышение количества лейкоцитов периферической крови (в 4-10 раз) и ГСК.
Криоконсервация ПСКК осуществляется методом, аналогичным замораживанию костного мозга.
ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С ТРАНСПЛАНТАЦИЕЙ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У ДЕТЕЙ.
Осложнения раннего период после трансплантации (возникают в течение 100 дней после ТГСК).
1. Осложнения, связанные с назначением режима кондиционирования:
2. Осложнения, связанные с инфекциями.
Развитие тяжелых иммунодефицитных состояний после ТГСК приводит к возникновению различных инфекций (бактериальных, вирусных, грибковых), возникающих почти у всех больных на том или ином этапе после ТКМ.
Для профилактики и лечения таких инфекций назначаются соответствующие препараты.
3. Острая реакция “трансплантат против хозяина”.
При алло-ТКМ наиболее грозным осложнением и одной из основных причин смерти остается реакция “трансплантат против хозяина” (о.РТПХ), которая возникает в 30-60% случаев и обычно сопровождается появлением признаков приживления донорского (пересаженного) костного мозга.
При выполнении алло-ТКМ от неродственного совместимого донора костного мозга вероятность развития о.РТПХ возрастает до 80%. Острая РТПХ подразделяется на I, II, III и IV степени в зависимости от интенсивности клинических проявлений.
Существуют данные о взаимосвязи проявлений о.РТПХ с развитием в последующем рецидива злокачественного заболевания, поскольку параллельно о.РТПХ проходит так называемая реакция “трансплантат против лейкоза”.
Таким образом, о.РТПХ I и II степени является желательной, т.к. ее течение либо не требует специального лечения, либо находится под контролем. Это же касается о.РТПХ III и IV степени, но ее появление крайне опасно, так как терапия этого состояния нередко бывает безуспешной (при о.РТПХ III и IV степени смертность достигает 80-100%).
Клиническими проявлениями о.РТПХ являются:
Лечение о.РТПХ проводится большими дозами гормонов, возможно применение моноклональных антител.
4. Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток
Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток сопровождается развитием панцитопении и аплазии (снижение количества всех клеток крови и костного мозга) и возникает у 1-3% больных после алло-ТГСК.
Вероятность ее значительно возрастет (до 20%) у больных с анемией, после множественных переливаний крови, а также у получивших донорский костный мозг от частично совместимого донора или после удаления Т-лимфоцитов.
Мерами профилактики развития реакции отторжения являются проведение режима кондиционирования в полных дозах, а также назначение иимунодепрессантов в течение длительного периода времени после алло-ТГСК. При подозрении на отторжение трансплантата необходимо применение ростовых факторов (Г-КСФ, ГМ-КСФ, эритропоэтин).
5.Веноокклюзивная болезнь печени (ВОБ).
Тяжелое осложнение, возникающее у 10-60% больных после ТГСК. Заболевание обусловлено повреждением клеток печени высокими дозами цитостатических препаратов. Клинически ВОБ характеризуется желтухой, быстрым увеличением размеров печени, прибавкой веса, асцитом (скоплением жидкости в животе) и болями в брюшной полости.
При тяжелом течении ВОБ развиваются почечная недостаточность, снижение количества тромбоцитов, энцефалопатия (повреждение головного мозга). Первые признаки ВОБ могут появиться на 10-14 день после ТГСК.
Лечение ВОБ сложное и включает комплекс мероприятий, направленных на подержание вводно-электролитного баланса, мочегонных средств. При развитии почечной недостаточности показан гемодиализ (очищение крови с помощью аппарата искусственной почки).
В качестве мер профилактики развития ВОБ используют гепарин и простагландин Е.
Осложнения позднего периода после трансплантации (возникают позднее 100 дней после ТГСК).
1.Хроническая реакция” трансплантат против хозяина” (хр.РТПХ) наблюдается в 30% и более случаев после алло-ТКМ от HLA-совместимого донора костного мозга и может возникнуть как самостоятельно, так и быть продолжением в течении о.РТПХ.
Клиническими проявлениями хр.РТПХ являются склеротические изменения кожи, депигментация или гиперпигментация кожи, выпадение волос, поражение желудочно-кишечного тракта, легких, печени, суставов, мышц, глаз, атрофия лимфоидных органов.
Хроническая РТПХ подразделяется на ограниченную и распространенную в зависимости от степени вовлечения в процесс кожи и печени. Лечение хр.РТПХ проводится циклоспорином и гормонами. Возможно также сочетание с другими иммунодепрессантами (иммуран).
2.Задержка роста является особенностью течения посттрансплантационного периода у детей. Наиболее часто это осложнение встречается при включении в режим кондиционирования тотального облучения тела (ТОТ) и связано с влиянием больших доз облучения на выработку гормона роста (ГР).
Дефицит (нехватка) ГР наблюдается у 90% детей, подвегшихся облучению головы в момент режима кондиционирования и получавших эту терапию на этапе до ТГСК, а также у 40% детей. получавших облучение только в момент ТГСК.
3.Нарушение функции репродуктивных (воспроизводительных) органов и щитовидной железы. Изменение функции репродуктивных органов связано с непосредственным влиянием высокодозной химиотерапии и лучевой терапии. Менее чем у 10% женщин восстанавливается функция яичников в течение 3-7 лет после ТГСК. Сперматогенез (образование спермы) полностью отсутствует после проведения лучевой терапии, однако в течение длительного периода времени возможно его восстановление.
Нарушение функции щитовидной железы возможно у 40% больных после ТГСК и чаще всего развивается у детей с болезнью Ходжкина (лимфогранулематозом), получавших облучение шеи.
4.Поражение глаз наиболее часто сопутствует развитию хр. РТПХ. Возникновение катаракты является осложнением высокодозной лучевой терапии и выявляется у 20% больных, имевших в режиме кондиционирования ТОТ.
5. Возникновение второй злокачественной опухоли. У больных после ТГСК увеличен риск возникновения второй опухоли (лимфома, лейкоз, опухоль головного мозга, меланома, рак печени, остеогенная саркома, рак щитовидной железы), что связано с применением химиотерапии, облучения и иммунодепрессантов.
Вероятность развития второй опухоли больше у пациентов, возраст которых был менее 30 лет на момент ТГСК и увеличивается параллельно длительности жизни после ТГСК.
Рецидивы (возврат) основного заболевания являются нередкой причиной смерти после ТГСК.
В связи с этим все большее внимание уделяется использованию иммунотерапии (интерлейкин-2, интерфероны и пр.) после трансплантации, особенно после проведения ауто-ТГСК.
Что такое химиотерапия и как она проходит?
Оглавление
Химиотерапия является одной из основных методик лечения онкологических заболеваний. Проведение процедуры позволяет уничтожить раковые клетки и подавить их рост. Этот способ может повлечь за собой ряд побочных эффектов, поэтому каждая процедура должна проводиться исключительно под контролем опытных врачей и с соблюдением точных дозировок и схем. Обеспечить максимально возможную безопасность всех манипуляций могут только квалифицированные специалисты-онкологи.
Для чего проводится химиотерапия?
Лечение применяется для решения следующих основных задач:
Как основной метод химиотерапия назначается при системных злокачественных образованиях, поражающих весь организм (злокачественной лимфоме, лейкемии и др.). В остальных случаях такое лечение становится частью комплексного. Оно проводится вместе с операцией и облучением. Выполнять процедуры могут как после вмешательства, так и до него. Назначаются специальные препараты по разным схемам. Это позволяет увеличить их эффективность и сократить побочные эффекты отдельных средств.
Преимущества применения методики при онкологии
Суть химиотерапии заключается в том, что специальные препараты попадают в кровь и разносятся по всему организму, что позволяет системно воздействовать на него, уничтожая раковые клетки и метастазы вне зависимости от того, где они располагаются.
К основным достоинствам методики относят:
Виды химиотерапии
Назначается перед вмешательством с целью сокращения размеров новообразований. Такое лечение позволяет уменьшить риски возникновения метастазов.
Проводится после операции и предотвращает дальнейшее развитие опухоли, а также устраняет ее скрытые очаги. Данная терапия актуальна при любых видах рака и служит профилактической мерой.
Назначается при неоперабельных формах рака и доказала эффективность при повышенной восприимчивости клеток опухоли к противораковым препаратам.
Такую химиотерапию называют «горячей». Она предполагает воздействие на раковые клетки средств с высокими температурами. Методика особенно актуальна при опухолях больших размеров (в том числе в брюшине и костных тканях).
В рамках лечения применяются препараты с платиной. Используется методика при неэффективности иных средств терапии.
Проводится с использованием специальных составов, которые действуют на молекулярном уровне. Химиотерапия позволяет не просто остановить рост клеток и разрушить их, а запустить в них процессы самоуничтожения.
Выполняется с применением наименее агрессивных препаратов, отличающихся относительно небольшим количеством побочных воздействий. Лечение актуально при малых опухолях без метастазов.
Такая химиотерапия отличается высокими дозами используемых средств. Назначают ее преимущественно при устранении лимфом. К недостаткам методики относят высокую токсичность для организма пациента, большое количество негативных последствий и побочных эффектов.
Проводится на терминальной стадии болезни, когда обеспечивается поддержание жизнедеятельности организма, уменьшается дальнейший рост опухоли и облегчаются болевые ощущения.
Способы применения препаратов
Сегодня для выполнения химиотерапии применяется большое количество различных средств. Они выпускаются в виде таблеток и растворов для инъекций. Эффективность лечения во многом зависит именно от формы препаратов. Наилучших результатов можно достичь при внутривенном их введении. Такие средства быстро разносятся по всему организму с током крови, но при этом сокращают вред для органов желудочно-кишечного тракта. Препараты в таблетках могут использоваться даже в домашних условиях. Сегодня разработаны и средства местного действия. Они выпускаются в виде мазей и аппликаций. Используют их при лечении рака ротовой полости, кожи и др.
Важно! Внутривенно препараты могут вводиться посредством постановки уколов и капельниц.
Также по способу применения средства можно разделить на самостоятельные и применяемые в комплексе с другими методиками лечения: оперативными вмешательствами и лучевой терапией.
Важно! Так как многие из назначаемых составов являются токсичными и имеют большое количество побочных эффектов, на время терапии может потребоваться пребывание пациента в стационаре под контролем медицинского персонала. Если самочувствие больного является удовлетворительным, допустимо амбулаторное проведение процедур по введению препаратов.
Подготовка к химиотерапии
Перед началом лечения необходимо:
При необходимости обеспечивается и комплексная психологическая поддержка. Она позволяет настроиться на терапию, которая нередко является не просто достаточно сложной, но и длительной. Работу с пациентом осуществляют психологи и психотерапевты. Также важной является поддержка близких.
Как проводится терапия?
Лечение всегда выполняется по индивидуально подобранной схеме. Она зависит от целого ряда факторов, в числе которых:
Комплекс препаратов подбирается с учетом достижения максимального эффекта от каждого приема. При этом онкологи предлагают больным средства с минимально возможным количеством побочных реакций. Это позволяет сохранить здоровье и обеспечить нормальную жизнедеятельность организма.
Сколько длится терапия?
Продолжительность лечения всегда определяется индивидуально и во многом зависит от типа выявленной опухоли и ее чувствительности к тем или иным препаратам. Проводится оно циклами, которые длятся по 14 дней.
При этом введение средств может осуществляться:
Продолжительность одной процедуры обычно составляет 2-3 часа. Промежуток между сеансами определяется выбранной схемой химиотерапии. Общее количество циклов также варьируется и обычно составляет 4-8. Общая продолжительность лечения – от одного месяца до года. В некоторых случаях требуется повторная терапия с целью предотвращения рецидивов.
Противопоказания к химиотерапии
Лечение не проводится при:
Каждый курс начинается только после проведения необходимой диагностики и назначается исключительно онкологом. Только опытный врач может принять решение о том, возможно ли выполнение терапии в определенных условиях.
Побочные эффекты
После курса лечения зачастую отмечается выраженное ухудшение работы всего организма. Это связано со снижением количественных и качественных показателей крови и изменением ее состава. Также обостряются инфекционные заболевания, ухудшается общий иммунитет.
К последствиям химиотерапии относят:
Пациенты жалуются на быструю утомляемость, сонливость и слабость, депрессивный настрой. У некоторых людей отекают лицо, руки и ноги, немеют конечности, повышается кровоточивость слизистых оболочек. Нередко возникают и аллергические реакции, которые могут проявляться как небольшой сыпью, так и опасным отеком Квинке. Противоопухолевое лечение может спровоцировать болезненные ощущения во всем организме, чувство жжения, повышение температуры тела, ухудшение качества ногтей и др.
Анализы крови в процессе химиотерапии
Так как вводимые лекарственные препараты воздействуют не только на раковые, но и на здоровые клетки (в том числе крови), пациенты страдают от анемии и иных патологических состояний. Для контроля уровня показателей здоровья регулярно проводится лабораторная диагностика.
Больные сдают анализы крови. Как правило, отмечаются сниженные параметры лейкоцитов, тромбоцитов и эритроцитов. Врачи дают рекомендации по улучшению состояния здоровья. Назначаются специальные диеты, сокращаются нагрузки, в рацион обязательно вводятся витамины и микроэлементы.
Кроме того, пациентам советуют избегать переохлаждений, реже бывать в общественных местах, тщательно следить за личной гигиеной.
Сколько стоит химиотерапия?
Стоимость лечения зависит от целого ряда факторов и не может быть озвучена без их предварительной оценки.
Самой дорогой обычно является терапия опухолей мозга, крови и поджелудочной железы. Точную стоимость может рассчитать только специалист после оценки всех важных параметров предстоящих процедур.
Питание после лечения
Диета как во время, так и после химиотерапии должна быть калорийной и достаточно питательной. Рекомендовано употреблять большое количество белка, качественных жиров и углеводов.
Корректируется питание в зависимости от:
К основным разрешенным продуктам относят мясо птицы и кролика, свинину и говядину, сыр, свежие овощи, морскую рыбу, бобовые, цельнозерновой хлеб, сухофрукты и орехи, масла, пастилу и зефир. Отказаться следует от консервов и копченостей, алкоголя, жирных и жареных блюд, газированных напитков, чипсов и других снеков, сала, фаст-фуда.
Назначаемая диета всегда направлена на снижение побочных эффектов от проведенной химиотерапии и восстановление общих сил организма.
Важно! Следует понимать, что неполноценное питание может существенно ухудшить состояние больного. Тем не менее заставлять пациента есть нельзя, так как это может спровоцировать приступы тошноты и рвоты.
Преимущества проведения химиотерапии в МЕДСИ
Если вы планируете химиотерапию в МЕДСИ, обратитесь к нашим специалистам любым удобным способом и задайте им все возникшие вопросы.