Высокая митотическая активность опухоли что
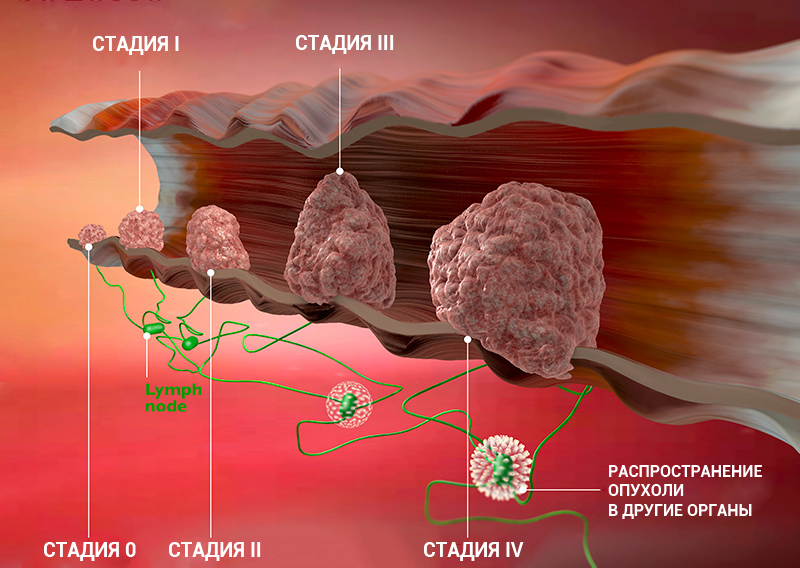
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Митозы и митотический индекс
Дата создания: Октябрь 27, 2017
Дата изменения: Ноябрь 28, 2017
Митозы и митотический индекс
Новый показатель в гистологическом исследовании
Американский Объединенный комитет по онкологии добавил показатель частоты митозов в протокол клинической диагностики. Показатель митозов заменил другой индекс — уровень проникновения по Кларку для меланом, стадия T1.
Американские ученые (Dermatol Surg. 2011 Aug;37(8):1080-8) поставили задачу оценить необходимость биопсии сторожевых лимфоузлов на основании показателя митотической активности тонких (до 1 мм) меланом.
Что означает митотическая активность при меланоме?
Митоз — процесс деления (размножения клеток). Если в гистологическом препарате удаленной родинки (опухоли) определяются делящиеся клетки, находящиеся в процессе деления (митоза). Митотическая активность (митотический индекс) определяется под микроскопом, как процент делящихся клеток от 1000 клеток препарата (опухоли).
Наличие митозов демонстрирует рост и активность опухоли, а также дает определенный прогноз развития заболевания. Важно применить агрессивное лечение, в случаях, когда в гистологическом препарате определяются митозы. Вовремя проведенное правильное лечение спасает жизнь.
Одним из эффективных способов лечения и предотвращения метастазирования является биопсия сторожевого лимфоузла
Биопсия сторожевого лимфоузла
эффективное лечение и точный прогноз
В исследовании установлена необходимость выполнения биопсии сторожевого лимфоузла при митотическом индексе более 1, при толщине опухоли менее 1 мм. Также необходима биопсия сторожевого лимфоузла в случае изъязвления опухоли, при толщине опухоли менее 1 мм.
Митотический индекс оказался более четким прогностическим критерием, чем глубина проникновения по Кларку, в случае тонких меланом (до 1 мм). Самым точным методом, в этом случае, является биопсия сигнального лимфоузла.
При обнаружении микрометастазов в лимфоузле выполняется удалении регионарных лимфоузлов, что примерно на 20% повышает шанс на полное излечение.
Диагноз — меланома. Что делать?
Немедленно обращайтесь в клинику онкодерматологии Меланома Юнит
Вам будет составлен четкий план действий, в зависимости от предоставленных меддокументов и данных о заболевании
В данном случае промедление может привести к крайне неблагоприятным последствиям, даже в случае если Вам сказали только наблюдаться. На данный момент, в России биопсия сигнальных лимфоузлов при меланоме еще не выполняется
В большинстве случаев меланома поддается правильному лечению, на ранних стадиях практически гарантированно полное выздоровление.
Высокая митотическая активность опухоли что
Лечение распространенных рецидивных и метастатических злокачественных опухолей остается одной из нерешенных проблем современной онкологии [4,5]. Причиной смерти таких больных, как правило, является прогрессирование опухолевого процесса в виде распространения и роста рецидивных и метастатических очагов. Основным методом лечения ЗНО был и остается хирургический компонент. Однако в тех случаях, когда вторичный опухолевый очаг невозможно или нецелесообразно удалить хирургическим путем, в онкологической практике применяют химиотерапевтическое лечение. Различные виды опухолей имеют различную степень чувствительности к цитостатическим препаратам [8]. Согласно современной классификации в зависимости от их чувствительности к противоопухолевой терапии различают три основных типа опухолей. Больных с такими опухолями, как лимфогранулематоз, семиномы, можно излечить при помощи химиотерапии. Другие опухоли не чувствительны к лечению цитостатиками (рак почки, рак щитовидной железы). Самая большая и самая распространенная группа опухолей обладает относительной чувствительностью к химиотерапевтическому лечению (рак молочной железы (РМЖ), меланомы кожи, колоректальный рак (КРР), саркомы мягкой ткани (СМТ), плоскоклеточный рак головы и шеи (ПРГШ)) [6]. Рецидивирование и метастазирование опухолей этого вида предопределяет неблагоприятный прогноз течения заболевания, и задачи вылечить больного, как правило, не ставится. Основная цель назначения лечения этих больных – продление жизни пациента. Срок дожития пациента является основным прогностическим фактором для пациентов с распространенным процессом. В свою очередь, срок дожития зависит от количества опухолевых очагов, их совокупной массы и их локализации. А также, по нашему мнению, в первую очередь, от скорости роста этих очагов.
Известно, что точка приложения любого из цитостатиков – пролиферативно-активная опухолевая клетка, находящаяся в процессе деления. Клетки опухоли, находящиеся в состоянии пролиферативного покоя, не чувствительны к цитостатикам. В свою очередь, опухолевый рост обусловлен увеличением числа клеток паренхимы вследствие их митотического деления. Одновременно с увеличением числа клеток в опухоли идут естественные процессы их убыли вследствие процессов некроза, апоптоза, миграции клеток в кроветворное и лимфатическое русло [1, 2, 3]. Совокупность всех этих процессов именуется фактором клеточных потерь (ФКП) [5]. Скорость роста опухолевых очагов определяется соотношением увеличения числа клеток (митотической активности опухоли (МАО)) и ФКП [7]. Чем быстрее скорость роста опухоли, тем быстрее опухолевый очаг достигнет величины, не совместимой с жизнедеятельностью организма. Медленно растущие опухоли будут определять более продолжительные сроки дожития пациентов с распространенным опухолевым процессом.
Мы определили две основные цели настоящей работы:
● определение влияния кинетических параметров роста рецидивных и метастатических опухолей на динамику прогрессирования онкологического заболевания.
● Оценка влияния, которое оказывает лечение цитостатиками на скорость роста рецидивных и метастатических опухолей.
К кинетическим параметрам в нашей работе были отнесены: митотическая активность опухоли (МАО), фактор клеточных потерь ФКП, а также скорость роста опухоли. Учитывая экспоненциальный характер роста опухолей за счет удвоения опухолевых клеток, скорость роста опухолей определялась как ВУО (время удвоения опухоли).
Для достижения указанных целей были поставлены следующие задачи:
1. Разработать математическую модель опухолевого роста, в которой бы учитывалось влияние структурных параметров на кинетику роста опухоли.
2. На основе указанной модели разработать компьютерную программу, позволяющую рассчитывать ФКП и скорость опухолевого роста для конкретных клинических случаев.
3. Исследовать кинетические свойства рецидивных и метастатических опухолей.
4. Оценить влияние кинетических параметров роста исследуемых опухолей на прогноз выживаемости.
5. Сопоставить кинетические параметры опухолей пациентов, получавших и не получавших химиотерапевтическое лечение.
Всего на базе Нижегородского областного онкологического диспансера было обследовано 130 пациентов с рецидивными и метастатическими опухолями различных локализаций, обладающих умеренной чувствительностью к химиотерапии. Было выбрано пять видов вторичных опухолей: саркомы мягких тканей (СМТ), колоректальный рак (КРР), меланомы кожи, рак молочной железы (РМЖ) и плоскоклеточный рак головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в табл. 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)). Проводилось морфометрическое исследование полученных гистологических препаратов. Определялись следующие структурные параметры опухолей: доля клеток паренхимы в состоянии митоза, доля клеток в интерфазе, доля клеток в состоянии пролиферативного покоя. Также определялись те доли объема, которые занимают в опухоли строма и некрозы. Прослежены результаты трехлетней выживаемости для вторичных опухолей пяти исследованных нами локализаций.
Распределение клинических наблюдений по локализациям первичных очагов и типу проведенного ранее лечения
Не получавшие химиотерапевтического лечения
Высокая митотическая активность опухоли что
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Морфологическая диагностика опухолей: сдвиг в сторону молекулярно-генетического анализа
Александр Иванцов, кандидат медицинских наук,
Максим Клещёв, кандидат медицинских наук,
Екатерина Кулигина, кандидат биологических наук,
НМИЦ онкологии им. Н. Н. Петрова МЗ РФ (Санкт-Петербург)
«Природа» №6, 2018
Диагностика онкологических заболеваний начинается с морфологического анализа фрагмента пораженного органа, который зафиксирован в формалине, обезвожен в спиртах восходящей плотности и заключен в парафин. Данная процедура позволяет выполнить срез толщиной 3 мкм и поместить его на стекло, затем окрасить ядра клеток и другие базофильные структуры ярко-синим щелочным красителем гематоксилином, а цитоплазму — розовым кислым красителем эозином. Окрашивание позволяет четко визуализировать основные элементы клетки. Затем сопоставляют микроскопический «пейзаж» исследуемого образца с эталонным, на котором зафиксирована характерная для конкретной анатомической области гистологическая структура. О присутствии инвазивного неопластического процесса свидетельствуют утрата типичной гистоархитектоники и клеточных молекулярных структур, наличие полиморфных неорганизованных клеток (рис. 1).
Рис. 1. Рак толстой кишки: утрата типичной гистологической структуры в ходе неопластического процесса
Помимо установления самого факта злокачественной трансформации для назначения индивидуализированной терапевтической схемы важно как можно раньше определить гистологический тип опухоли и оценить стандартные маркеры агрессивности (степень дифференцировки, митотическая активность и т. д.). В пределах одного органа патологический процесс может развиваться по совершенно разным сценариям, вовлекать разнообразные клетки и структуры. Например, среди злокачественных новообразований легкого насчитывают, по современным представлениям, более шести гистологических типов, для каждого из которых необходимы свои терапевтические подходы (рис. 2) [1]. Мелкоклеточный рак легкого отличается стремительным течением, ранним метастазированием и очень плохим прогнозом. Карциноидные опухоли, происходящие из клеток диффузной нейроэндокринной системы, имеют наилучший прогноз; это единственный тип карцином легкого, который, как ныне считается, никак не связан с курением. Саркома легких — агрессивная опухоль, развившаяся из клеток соединительнотканных структур легкого. Аденокарциномы состоят преимущественно из железистых клеток и имеют периферическую локализацию. Опухоли этого типа зачастую развиваются у некурящих людей. Они могут нести активирующие мутации в генах EGFR, ALK и ROS1, которые являются терапевтической мишенью для действия таргетных препаратов — ингибиторов тирозинкиназ.

Рис. 2. Гистологические типы рака легкого: мелкоклеточный рак (14%); плоскоклеточный (эпидермоидный) рак (20%); аденокарцинома (38%); крупноклеточный рак (3%); карциноид (5%); мезенхимальные, в том числе саркомы и лимфомы (5%); опухоли смешанных типов — плоскоклеточный и аденокарцинома, аденокарцинома и мелкоклеточный и т.д. (15%)
Чтобы безошибочно установить гистологический тип опухоли в затруднительных ситуациях, вызванных, к примеру, маленьким размером образца или утратой опухолевыми клетками способности к образованию специфических структур (низкая степень дифференцировки), или выявить некоторые специфические характеристики новообразования, морфологи используют иммуногистохимическое окрашивание (ИГХ). Этот метод сформировался еще в середине 1980-х годов [2] и сразу стал одним из наиболее востребованных в клинической онкологии (рис. 3). Появление такого диагностического теста, например, существенно изменило роль патоморфологического исследования в лечении рака молочной железы: именно от результатов ИГХ-анализа на рецепторы к эстрогенам (ER) и прогестерону (PgR), которые синтезируется опухолевыми клетками при этом заболевании, зависит назначение эндокринной терапии. В настоящее время антагонисты эстрогенов, замедляющих деление клеток рака молочной железы, принимают примерно 70% пациенток [3]. С помощью ИГХ можно также обнаружить увеличение синтеза онкобелка HER2/neu (от англ. human epidermal growth factor receptor — рецептор эпидермального фактора роста, или трансмембранная рецепторная тирозинкиназа). Опухоли, вырабатывающие HER2/neu, оказались чувствительными к терапевтическим ингибиторам этой тирозинкиназы, и назначение соответствующих лекарственных препаратов (например, трастузумаба) основано на результатах тестов, в числе которых и ИГХ-анализ [4].

Рис. 4. Низкодифференцированная аденокарцинома легкого (а, среди фиброзной ткани отдельно расположенные опухолевые клетки) и положительная ИГХ-реакция с антителом к TTF-1 в ядрах опухолевых клеток (б)
В клиническом исследовании изучали эффективность EGFR-ингибитора (гефитиниба) на самом первом этапе лечения пациентов с мутацией EGFR [6]. Чтобы включить в исследование 25 больных, нам потребовалось проанализировать образцы тканей более 500 пациентов с раком легкого, что связано с низкой частотой этой мутации, которая в общей выборке больных не превышает 6–7%. Результаты исследования поражают воображение: эффект от препарата наблюдался у всех без исключения пациентов, в то время как аналогичный показатель при назначении стандартной терапии обычно не составляет 20–30% (рис. 5).
Рис. 5. Снижение размеров опухолевых очагов (%) в ответ на применение EGFR-ингибитора (гефитиниба) у пациентов с активирующими мутациями в гене EGFR: делецией 19-го экзона (19del) и заменой в 21-м экзоне (L858R) [6]
В настоящее время патоморфология переживает фундаментальные изменения. В стройную систему знаний, накопленных десятилетиями в рамках классической цитологии, гистологии и патологической анатомии, интегрируются новейшие представления о молекулярной патологии раковых клеток. Все это дает основания говорить о появлении новой дисциплины — молекулярной патологии [7]. Многие современные алгоритмы принятия врачебных решений уже ориентируются не столько на гистологические разновидности рака, сколько на молекулярные характеристики клеток. Однако роль патолога по-прежнему остается ведущей, поскольку именно он интегрирует все полученные сведения (микроскопические и молекулярные) в общий «портрет» опухоли.
Важность молекулярной морфологии в онкологии будет возрастать в ближайшем будущем, поскольку молекулярная диагностика больше не представляет собой однократное исследование, выполняемое только на этапе постановки диагноза. Многие современные технологии лечения рака предусматривают мониторинг характеристик опухолевых клонов на протяжении всех этапов онкологической медицинской помощи. В этом десятилетии большую популярность приобрели методы «жидкой биопсии», основанные на идентификации фрагментов опухолевых клеток в периферической крови. Другой важный аспект развития морфологии — ее интеграция с различными методами компьютерного анализа, искусственного интеллекта. На наших глазах морфология опухолей превращается из относительно консервативного раздела онкологии в одну из самых динамично развивающихся дисциплин современной медицины.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 16-04-00921).
Литература
1. Wistuba I., Brambilla E., Noguchi M. Chapter 17: Classic Anatomic Pathology and Lung Cancer // IASLC Thoracic Oncology. Pass H. I., Ball D., Scagliotti G. V. (eds) Aurora, Colorado, 2014; 217–240.
2. Taylor C. R., Burns J. The demonstration of plasma cells and other immunoglobulin-containing cells in formalin-fixed, paraffin-embedded tissues using peroxidase-labelled antibody // J. Clin. Pathol. 1974; 27(1): 14–20.
3. Pertschuk L. P., Tobin E. H., Gaetjens E. et al. Histochemical assay of estrogen and progesterone receptors in breast cancer: correlation with biochemical assays and patients’ response to endocrine therapies // Cancer. 1980; 46(12 Suppl): 2896–2901.
4. Pegram M. D., Lipton A., Hayes D. F. et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment // J. Clin. Oncol. 1998; 16: 2659–2671.
5. Stenhouse G., Fyfe N., King G. et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma // J. Clin. Pathol. 2004; 57(4): 383–387. DOI: 10.1136/jcp.2003.007138.
6. Moiseyenko V. M., Procenko S. A., Levchenko E. V. et al. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma // Onkologie. 2010; 33(5): 231–238. DOI: 10.1159/000302729.
7. Birner P., Prager G., Streubel B. Molecular pathology of cancer: how to communicate with disease // ESMO Open. 2016; 1(5): e000085. DOI: 10.1136/esmoopen-2016-000085.