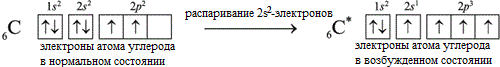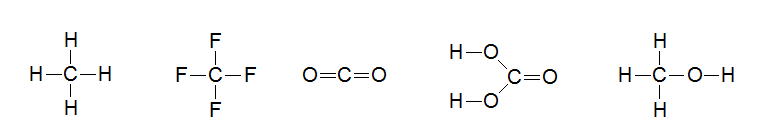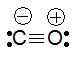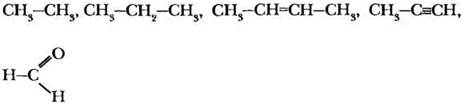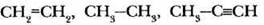Возбужденное состояние углерода что такое
Возбужденное состояние углерода что такое
Гибридизация – это смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией; в результате образуются гибридные орбитали (облака) одинаковые по форме и энергии. Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Объяснение этого факта впервые дал американский химик Лайнус Полинг.
Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
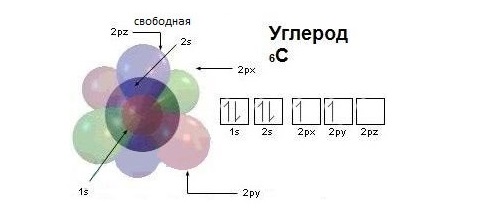
Модель атома углерода
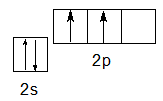
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
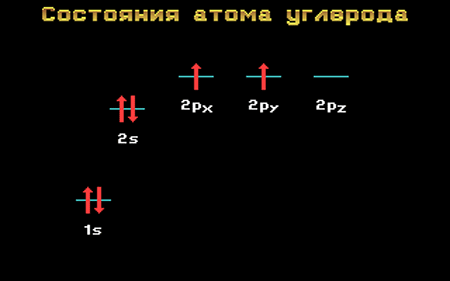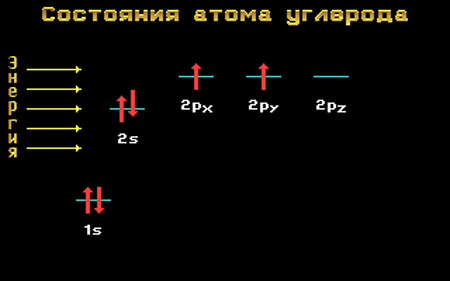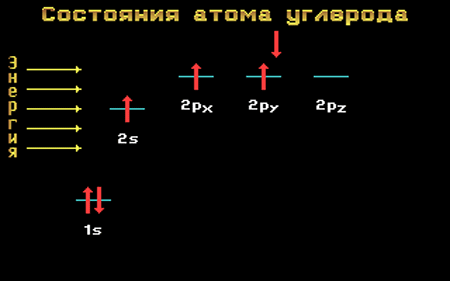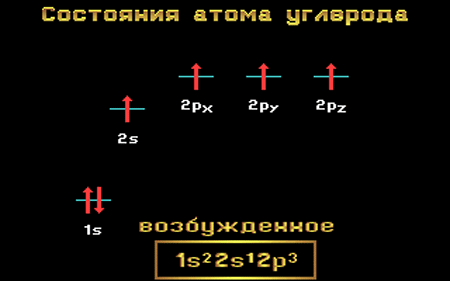
Электронная формула атома углерода в основном (стационарном) состоянии 1s 2 2s 2 2p 2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 90 0 друг к другу.
Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.
Переход атома углерода из основного состояния в возбужденное.
Электронная конфигурация атома углерода в основном и возбужденном состоянии
Основное и возбужденное состояния атома углерода
Образовавшиеся электронные облака четырех неспаренных электронов гибридизируются — смешиваются.
Возбужденное состояние атома углерода



Тема 3-4. Валентные состояния атома углерода
Инструкция для студентов:
1. Изучить предоставленный по теме материал
Строение атома углерода
Атом углерода как элемент главной подгруппы IV группы имеет четыре валентных электрона, что отражает электронная формула 2s22р2 или графическая формула:
Очевидно, что атом углерода может быть двухвалентным, образуя две ковалентные связи за счет двух неспаренных электронов по механизму обобществления (спаривания) электронов.
возбужденное состояние атома углерода
Известно, что атом углерода может проявлять валентность II (например, в CO или CH2 (карбен)) и IV (CH4, CO2). И в подавляющем большинстве соединений атом углерода четырех валентный. Это объясняется тем, что в таких соединениях, в том числе во всех органических, атом углерода находится в возбужденном состоянии (СС∗)::
С 2s22р2 → С 2s12р3
Переход в возбужденное состояние связан с некоторыми энергетическими затратами (примерно 360 кДж/моль), однако эти затраты полностью окупаются при образовании четырех ковалентных связей. Так, при образовании четырех связей С–Н выделяется 1640 кДж/моль.
Валентность IV атом углерода имеет в соединениях CH4, CF4, CO2, H2CO3, CH3OH и многих других:
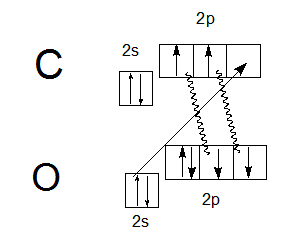
Кроме валентности II и IV углерод может проявлять и валентность III. Так, атом углерода образует три ковалентные связи в молекуле СО — в оксиде углерода (II). Это возможно за счет одной вакантной атомной 2р-орбитали. Рассмотрим еще раз электронную конфигурацию валентных электронов атома углерода в основном состоянии:
3.
Атом углерода может образовать две ковалентных связи по механизму спаривания электронов (за счет двух неспаренных электронов на р-подуровне) и еще одну связь — по донорно-акцепторному механизму (является акцептором за счет вакантной р-орбитали):
На этой схеме две ковалентные связи, обозначенные волнистыми линиями, образованы по механизму спаривания (за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода), в то время как третья ковалентная связь, изображенная прямой стрелкой, образована по донорно-акцепторному механизму (атом кислорода — донор электронной пары, атом углерода — акцептор). Следовательно, валентность углерода в молекуле СО равна III. Отсюда становится понятной современная структурная формула молекулы СО, отражающая ковалентность углерода, равную III:
4.
В этой формуле знаки «−» и «+» называются формальными зарядами, они показывают, что одна из связей образована по донорно-акцепторному механизму, причем электронная пара переходит с орбитали атома кислорода (поэтому на кислороде «+») на орбиталь углерода (поэтому на углероде «−»).
Следовательно, атом углерода может проявлять валентности (ковалентности), равные II, III и IV (последняя предпочтительней).
2.Просмотреть видеоурок https://youtu.be/UVNVQCooDC4
3.Ответить на вопросы :
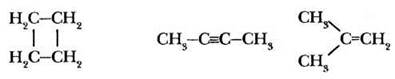
Задание 1. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы которых записаны.
Задание 2. За счет перекрывания орбиталей какого типа образованы все ковалентные связи в молекулах следующих веществ.
Задания отправить вк личным сообщением до 21.00 11.09.20
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Что такое органическая химия?
Современное определение органической химии:
– это раздел химической науки, который изучает способы получения углеводородов и их производных, а также свойства, полученных веществ.
Не стоит думать, что предмет органической химии очень узкий, раз объект его исследований можно описать только 2 словами, поскольку количество углеводородов и их производных достаточно превышает все неорганические вещества вместе взятые.
История изучения органической химии
Развитие органической химии, как отдельной науки, началось недавно, но с предметом ее исследования люди были знакомы очень давно.
Первые вещества органической химии получались из живых организмов – растений и животных. Например, духи изготавливались из растительных масел, спирт синтезировали благодаря брожению винограда, а красные красители и вовсе из специальных червей. Поскольку получить искусственно такие вещества из неорганических материалов люди не могли, то предположили, что для их создания нужна «живая сила».
В 1827 году понятие органической химии было введено шведским ученым Й.Я. Берцелиусом.
В 1845 году немецким ученым Г. Кольбе было доказано, что органическое вещество можно добыть из неорганических соединений, и в качестве примера он показал получение уксусной кислоты из углерода, воды, серы и хлора.
В мире стал развиваться новый предмет, получивший название «химия органического синтеза».
С помощью химического анализа было показано, что при сжигании любого органического вещества, продуктами будут вода и углекислый газ, а в отдельных случаях чистая сажа или копоть, основу которых составляет уголь.
Современная задача органической химии – изучить вещества, молекулы которых образованы связями атомов углерода.
Характеристика основного элемента органической химии
Чтобы определить свойства и потенциальные возможности вступления в химические превращения какого-либо элемента, необходимо знать особенности его строения. Какие будут образовываться химические связи и каким образом их можно разорвать зависит от элемента.
Общее строение атома углерода
Зная эти основные цифры, можно подробно разобрать схему строения углеродного атома. У него 2 составляющие: ядро,заряженное положительно и электроны, которые заряжены отрицательно и находятся в пространстве вокруг него.
Порядковый номер элемента численно равен заряду ядра и числу в нем электронов. Число нейтронов вычисляется по формуле:
где А – массовое число, Nп – число протонов, Nн – число нейтронов.
Получаем, что количество нейтронов равно: Nн = А – Nп = 12-6 = 6
На рисунке 1 видно наглядно, какое строение у атома углерода.
Рисунок 1. – Строение атома углерода
Подробное электронное строение атома углерода
Ядро элемента не несет интереса в описаниях химических реакций, так как связи образуются при объединении электронных оболочек. При их связывании и перераспределении электронной плотности образуются новые молекулы.
Электронная структура
По расположению в ПСХЭ наглядно видно, что углерод имеет:
На первом энергетическом уровне в s-орбитали у всех элементов находятся 2 электрона. (см.рис.1). Второй уровень, он же и внешний для углерода, состоит из одной s и трех p орбиталей, и расположение электронов в них зависит от того, в каком состоянии находится атом.
Основное и возбужденное состояние
В основном состоянии на s и p орбиталях расположено по 2 электрона.
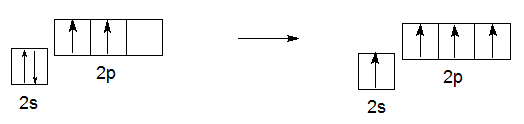
Если электрону, находящемуся на s-орбитали, добавить некоторое количество энергии из вне, то он может «перескочить» в пустую p-орбиталь с большей энергией.
Возбужденное состояние атома углерода представляет собой такую конфигурацию, при которой на внешнем уроне каждая его орбиталь имеет по 1 электрону.
Переход из основного состояния в возбужденное называется активацией.
На рисунке 2 схематически изображен процесс активации.
Рисунок 2. – Переход электрона с 2s-орбитали на 2p-орбиталь под действием дополнительной энергии
Атом углерода образует связи с другими элементами и между собой благодаря объединению неспаренных электронов. Если сравним конфигурацию атома углерода в возбужденном состоянии с конфигурацией в основном, можно сделать вывод о том, что в возбужденном состоянии он способен образовать больше ковалентных связей. В этом состоянии ему нужно быстро находить в окружении себя другие элементы и химически с ними связываться, так как при отсутствии дополнительной энергетической подпитки электрон снова перейдет с p-орбитали на s.
Знание о возбужденном состоянии атома углерода позволило в дальнейшем описывать механизмы реакций, рисовать структурные формулы веществ и описывать расположение молекул в пространстве.Полученные знания в 1861 году обобщил А.М. Бутлеров.
Степень окисления
В любых соединениях степень окисления определяет, какой условный заряд имеет тот или иной элемент в молекуле, если бы все связи были ионные.
Таблица 1. – Постоянные степени окисления элементов
Молекула спирта имеет формулу СH3-CН2-ОН, найдите значения степеней окисления атомов углерода в ней.
Разбиваем молекулу по связям С-С на участки. Получаем частицы СН3— и –СН2OH.
Для тренировки постарайтесь найти степень окисления углерода в соединениях, формулы которых: СH3CH2CH3, CH2CHCOH; CH3C(NH2)CH2CH2OH.
Валентность атома углерода
Под валентностью понимают, что это то количество связей, которые образовывает химический элемент. Один из основополагающих законов органической химии гласит, что в органических соединениях у атома углерода валентность постоянна и равняется 4 (т. к. в возбужденном состоянии у него 4 неспаренных электрона)
Углеродные связи в органических веществах
В ходе протекания химической реакции органические вещества претерпевают изменения, поскольку происходит разрушение старых и образование новых связей. Глядя на молекулу, опытный химик-органик скажет, какая именно связь разрушится, под действием каких факторов и предскажет, какие продукты и какого строения получатся в конце превращения.
Одинарные химические связи углерода
При объединении 2 неспаренных электронов 2 разных элементов, образуется одинарная связь.
Рассмотрим на конкретном примере, каким образом можно изобразить на бумаге структурные формулы веществ,имеющих состав С4H9Cl.
Помня о том, сколько связей может образовывать атом углерода, рисуем углеродный скелет органической молекулы (см. рис.3 а). Связи между атомами углерода ковалентные неполярные, т.к. образованы элементами с одинаковой электроотрицательностью.
Затем добавим к этому углеродному скелету атомы водорода и хлора (см. рис 3 б). Образовавшиеся связи хлор-углерод и углерод-водород – ковалентные полярные, т.к. образованы элементами с разной электроотрицательностью.Кроме изображенной на рисунке структурной формулы, для вещества состава С4H9Cl можно записать и некоторые другие (см. рис. 3 в). Ковалентные связи, образуемые атомом углерода, позволяют создать огромное количество соединений, у которых физические и химические свойства будут уникальны.
Рисунок 3. – Этапы построения органической молекулы
Формулу органического соединения, представленного на рисунке 3 б, можно записать проще, не изображая столько разветвлений.
Кратные связи углерода
В некоторых молекулах атомы углерода могут образовывать двойные и даже тройные связи. Это такой тип связей, на которые стоит обращать внимание, изучая строение веществ, потому что их наличие в молекуле придает соединению определенные свойства. Например, соединения с чередующимися кратными и одинарными связями могут проводить электрический ток.
Помимо кратных связей между собой, атом углерода образует двойные связи и с другими элементами (N, P, O, S). На схеме ниже представлен пример органической молекулы, которая содержит связи разных типов.
Разнообразие органических молекул
Молекулы органических соединений являются «кирпичиками» в построении живой материи и различных веществ. На свойства таких веществ влияет количество атомов в молекуле и их расположение друг относительно друга в пространстве. По строению органических молекул определяют их реакционные способности, цвет и токсичность.
Знание строения материалов позволило выбирать самые качественные для использования в постройке домов, автомобилей, ракет и многих других конструкций.
Одна из задач химиков-органиков получить материалы с определенным порядком расположения молекул.
Форма, объем, а также расположение молекулы в пространстве, зависят от того, в каких направлениях в ней связаны атомы. Это может быть объемная структура, расположение в одной плоскости или линяя.
Если бы мы рассмотрели расположение орбиталей в возбужденном состоянии атома углерода, и присоединили другие элементы к его s и p орбиталям, то все получившиеся молекулы имели бы строго объемное строение, однако на практике это не так. Чтобы объяснить расположение атомов в молекуле и пространстве, было предложено понятие гибридизации.
Гибридизация
Гибридизация – объединение орбиталей атома, которые имеют разные формы (s и p). Объединенные орбитали получаются с одинаковой формой, размером и энергией (рисунок 4).
Объединяться могут не только s и p орбитали, но и d и f, однако в атоме углерода таких нет, поэтому на уроках органической химии их объединения рассматриваться не будут.
Рисунок 4. – Образование гибридных орбиталей из s и p
Основные типы гибридизации атома углерода в молекулах
Наглядно разберемся, как можно представить объединение орбиталей.
Предположим, что у нас есть синяя краска и белая краска, и мы в палитре их объединяем, т.е. смешиваем. При «смешении» мы получили краску нового голубого цвета. Тоже самое происходит и с орбиталями в атоме, только смешиваются не цвета, а формы и энергии.
Объединение орбиталей в углероде может проходить по 3 путям:
Зная, как гибридизация влияет на взаимное расположение атомов друг относительно друга, можно изобразить схематически строение молекулы любого органического вещества.
Рассмотрим молекулу, в которой есть участки с одинарными, двойными и тройными связями, и изобразим ее в пространстве (см.рис. 5).
Рисунок 5. – Пространственное расположение молекулы, в которой есть одинарные и кратные связи.
Стоит отметить, что представленные типы гибридизаций атомов в молекулах, характерны не только органическим соединением, но многим неорганическим веществам.
Важнейшие представители органических соединений
Соединения, у которых небольшое количество атомов в молекуле, простые структурные формулы и из которых путем последовательных химических реакций можно получить все остальные химические вещества, называют фундаментальными.
Самые простые органические соединения
Вещества, состоящие только из 2 видов атомов, называются простейшими. В органической химии соединения, образованные только атомами углерода и водорода, называют простыми. На их основе можно создавать другие классы органических веществ, путем замены водорода на другие группы, называемые функциональными.
Общая классификация органических молекул
Классификация органических соединений начинается с анализа углеродного скелета молекулы. Он может быть замкнутый в «кольцо» или в виде цепочки (по-научному: циклический и ациклический).
Циклические соединения делятся на те, в которых цикл состоит только из атомов углерода (тогда такие называются карбоциклические) и на те, у которых помимо него есть еще другой элемент (тогда такие соединения называют гетероциклические).
Карбоциклические подразделяются по наличию кратных связей в цикле на ароматические (когда цикл содержит кратные связи) и алициклические (в которых кратных связей не содержится).
Ациклические делятся на соединения, которые состоят только из одинарных связей (такие соединения называются предельными) и те, которые содержат в структуре углеродного скелета кратные связи (такие соединения называют непредельными).
Классификация углеводородов
Углеводороды можно разделить на разные группы по аналогичным признакам классификации органических соединений.По видам связей углеводороды делятся на те, в которых:
Каждый класс соединений вступает в химические реакции по определенным механизмам и будет рассмотрен более подробно на последующих уроках.
Агрегатные состояния простых органических веществ
Органические вещества выпускаются в мире в промышленных масштабах. Поступающие на завод вещества, называются сырьем, а выпускаемые из него – целевым продуктом.
В зависимости от того, какое сырье использует предприятие, его доставка может осуществляться разными способами: трубопроводами или с помощью транспортировочных машин.
Основная сырьевая база для производства сложных веществ и материалов – углеводороды, которые впоследствии претерпевают химические изменения и превращаются в другие вещества, которые используют для создания более сложных продуктов, например лекарств, пластмасс, клеев, пленок и др.
Самыми востребованными веществами из углеводородов являются этен и этин (вещества, в которых содержится только 2 атома углерода, которые соединены двойной и тройной связью).
Газообразные углеводороды
Этен и этин представляют собой газообразные органические вещества и для их транспортировки используют специальные газовые трубопроводы и баллоны, где они хранятся в сжиженном виде.
Изготавливают из них полимеры, например, полиэтиленовые пакеты или реактивы для более узкого органического синтеза.
Обычно, вещества в газообразном состоянии имеют в составе молекул от 1 до 4 углеродных атомов.
Жидкие органические вещества класса углеводородов
Состав таких веществ обычно подразумевает наличие атомов в своем составе больше, чем в молекулах газообразных веществ. Из-за утяжеления молекул их подвижность падает и в них могут образовываться межмолекулярные связи.
Для их транспортировки используют бочки, трубопроводы и цистерны. В составе молекул в жидком состоянии содержится от 5 до 18 атомов углерода.
Твердые углеводороды
Если увеличивать количество углеродных атомов в структуре органической молекулы, то углеводороды будут представлять из себя твердые, но пластичные материалы. Примером такого органического вещества является воск или парафин, в состав которых входят тяжелые углеводороды.
Для их транспортировки используют грузовые машины, а складывают их в коробки или ящики.
Кратко примеры агрегатных состояний органических веществ представлены в таблице 2.
Таблица 2. – Агрегатные состояния органических веществ
Углерод. Химия углерода и его соединений
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии :
+6С 1s 2 2s 2 2p 2 1s 

Электронная конфигурация углерода в возбужденном состоянии :
+6С * 1s 2 2s 1 2p 3 1s 

Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Соединения углерода
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода: