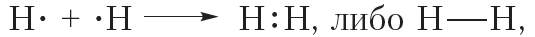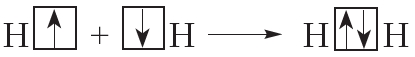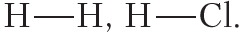Составьте структурные формулы молекул учитывая что валентность хлора равна единице
Валентность хлора
Общие сведения о валентности хлора
Хлор – активный окислитель.
Молекула хлора двухатомна Cl2.
Валентность хлора в соединениях
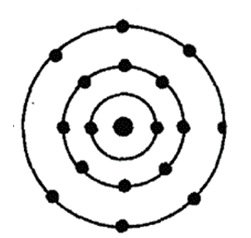
Хлор — семнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VIIA группе. В ядре атома хлора содержится 17 протонов и 18 нейтронов (массовое число равно 35). В атоме хлора есть три энергетических уровня, на которых находятся 17 электронов (рис. 1).
Рис. 1. Строения атома хлора.
Электронная формула атома хлора в основном состоянии имеет следующий вид:
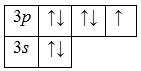
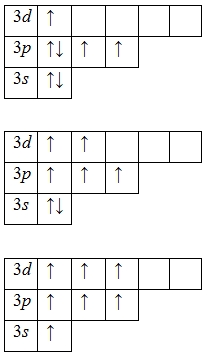
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что хлор проявляет в своих соединениях валентности III (NaCl III O2), V (KCl V O3) и VI (KCl VII O4, Cl VII 2O7) (высшая валентность).
Формально хлор может проявлять валентности IV (ClO2) и VI (Cl2O6).
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: |
Рассчитаем количество вещества водорода, вступившего в реакцию:
n (H2)= 10 / 22,4 = 0,45 моль.
Согласно уравнению, n (H2)= n (Cl2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен:
§ 1.6. Валентность элементов. Структурные формулы химических соединений
В предыдущей главе, вы уже могли заметить, что атомы, группируясь друг с другом, не обязательно образуют двухатомные молекулы, т.е. соединяются в соотношении один к одному. В молекуле воды, например, к одному атома кислорода прикрепляется два атома водорода. Количество связей, которые атом химического элемента образует с другими атомами, называется его валентностью.

Если схематично изобразить строение этих молекул, обозначая атомы химических элементов соответствующими им символами, а связь между ними отрезком,
получаются формулы следующего вида, называемые структурными:

Валентность химических элементов в соединениях принято указывать надстрочным индексом справа от символа химического элемента, либо над ним, как, например, это сделано ниже:
Для некоторых элементов характерна постоянная валентность, то есть в соединениях их валентность равна всегда одному и тому же числу.
Так, например, постоянная валентность, равная единице, наблюдается для ряда металлов, называемых щелочными — лития, натрия, калия, рубидия и цезия, Постоянная валентность, равная двум, наблюдается у кислорода, магния, кальция, стронция, бария, цинка. Постоянная валентность равная трем наблюдается у алюминия Al.
Элементы с переменной валентностью — это элементы, которые в разных соединениях могут иметь различные значения валентности. Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (таблица 2).
Таблица 2. Наиболее характерные значения валентности некоторых элементов
Валентность хлора
Валентность хлора.
Валентность хлора:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
| Валентность хлора в соединениях | |
| I | NaCl, NaClO, Cl2O |
| III | NaClO2 |
| IV | ClO2 |
| V | KClO3 |
| VI | Cl2O6 |
| VII | KClO4, Cl2O7 |
Валентность хлора
Таблица валентностей химических элементов.Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..













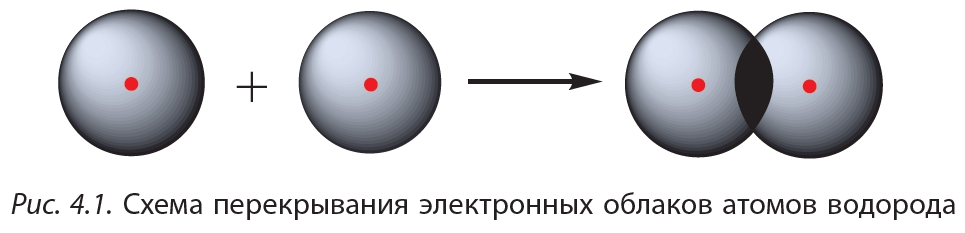
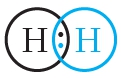
 , или Н2. Такая связь называется ковалентной. Чем больше перекрываются электронные облака атомов, тем прочнее будет ковалентная связь.
, или Н2. Такая связь называется ковалентной. Чем больше перекрываются электронные облака атомов, тем прочнее будет ковалентная связь.