радиооблучение при онкологии головного мозга
Радиооблучение при онкологии головного мозга
Лучевая терапия — лечение заболеваний с использованием ионизирующего излучения. Как правило, применяется при злокачественных заболеваниях, а также при некоторых доброкачественных (например, при макроаденомах гипофиза). В большинстве случаев лучевая терапия опухолей головного мозга проводится в послеоперационном периоде, методом внешнего облучения рентгеновскими лучами. Также используется ряд других методов, таких как интаоперационная лучевая терапия, корпускулярная и брахитерапия. Значение лучевой терапии во многом зависит от радиочувствительности опухоли.
Возможно лечение (например, при медуллобластомах, герминоклеточных опухолях) или продление жизни (например, при глиомах). Цель заключается в обеспечении максимальной или лечебной дозы для опухоли и минимизации повреждения нормальной ткани.
а) Механизм действия. Лучевая терапия проводится избирательно путем концентрации высокой дозы излучения в области опухоли, при этом учитываются различия в резистентности нормальных и раковых тканей. Облучение повреждает ДНК, которая в свою очередь может восстановиться или привести к гибели клеток с помощью различных механизмов. Осознанное управление молекулярными последствиями облучения приводят к ощутимому улучшению результатов.
Чтобы воспользоваться разницей в восстановлении и кинетическом росте в ответ на облучение, суммарная доза делится на малые дозы или «фракции». В принципе при большем количестве фракций можно достигнуть большего эффекта. Таким образом, радикальное лечение сводится к 30 или более фракциям, в то время как паллиативное лечение включает значительно меньше.
б) Стандартное базовое оснащение. Облучение центральной нервной системы (ЦНС) должно выполняться на линейном ускорителе с энергией 4-6 MV. Он должен иметь возможность для структурирования луча и модуляции интенсивности лучевой терапии (МИЛТ). Должны быть доступны современные средства планирования лучевой терапии, основанные на КТ с модулем имитации и проверки луча.
В основном лучевая терапия проводится в размере одной фракции в 1,8-2,0 Гр в день, пять дней в неделю. Для быстро растущих опухолей большее теоретическое преимущество дает ускоренная терапия (больше, чем одна фракция в день). Кроме того, лучевая нагрузка в низких дозах позволяет дать более высокую суммарную дозу с меньшим воздействием на неизмененные ткани (гиперфракционированая лучевая терапия) с лучшим воздействием на опухоль. Это может быть эффективно при некоторых опухолях у детей. У взрослых не было выявлено преимуществ ни ускоренного, ни гиперфракционированого облучения.
в) Новейшие разработки:
1. Конформная лучевая терапия. Конформная лучевая терапия подразумевает формирование пучка по размеру и контуру опухоли. Это достигается с помощью (микро) многолепесткового коллиматора или блоков литого свинца.
2. Модуляции интенсивности лучевой терапии. Обычно интенсивность дозы облучения по ходу пучка одинакова. При использовании нескольких пучков с неоднородными (с модуляцией интенсивности) профилями можно сформировать единую дозу в очень сложной (даже вогнутой) области. Это имеет свои преимущества при работе рядом с чувствительными или жизненно важными структурами или когда желательно неоднородное распределение дозы.
3. Стереотаксическая радиохирургия/лучевая терапия. Стереотаксис в лучевой терапии означает лечение поражений, локализованных по отношению к внешней системе координат. При адекватной фиксации пациента стереотаксическое излучение может быть доставлено с точностью менее чем 1 мм. Используя эту методику, можно вывести жизненно важные структуры из пучка. Стереотаксическая радиохирургия (СРХ) подразумевает однократное применение абляционной дозы радиации.
4. Чувствительность к облучению. Было опробовано множество веществ, которые теоретически должны повышать чувствительность опухолевой ткани к излучению. К ним относятся сенсибилизаторы, действующие на субклеточном уровне, такие как IUdR и мизонидазол. Ни один из них не оказался эффективным.
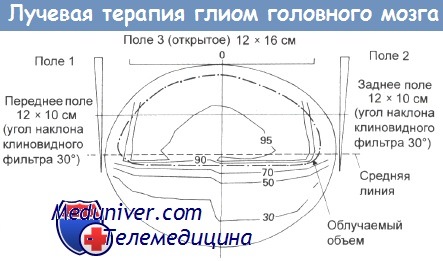
Трехпольное облучение всего полушария мозга. Облучаемый объем показан пунктирной линией.
г) Стандартные подходы к лучевой терапии:
1. Глиомы высокой степени злокачественности. Лучевая терапия увеличивает выживаемость пациентов с недавно диагностированной глиомой высокой степени злокачественности (ГВСЗ). Для оптимизации лечения таких больных учитываются такие прогностические факторы, как возраст, общее состояние, точное гистологическое заключение и, в меньшей степени, размер опухоли и резектабельность. Пациенты с большими шансами на эффективность терапии должны проходить максимальное облучение, в то время как при плохом прогнозе можно дать короткий курс лучевой терапии или вообще его не проводить.
Лечение должно быть проведено сразу же после операции. Высокие дозы излучения локализуют в области резекции с добавлением около 2 см от ее края. Облучение большого объема мозга без необходимости больше не считается необходимой. Резекция опухоли может улучшить устойчивость к радиации и снизить потребность в стероидах, которые часто приходится назначать при лучевой терапии.
Максимальное стандартное лечение составляет 56-66 Гр в течение 5-7 недель. Нет подтверждения, что увеличение интенсивности лечения с помощью интерстициальной лучевой терапии, стереотаксической радиохирургии или с помощью альтернативных схем фракционирования улучшает результаты.
Пациентам с неблагоприятным прогнозом может быть предложен короткий курс облучения (например, 30 Гр за шесть фракций).
Было установлено, что прием темозоломида во время и после лучевой терапии улучшает выживаемость у пациентов с глиобластомой. В этом исследовании двухлетняя выживаемость увеличилась с 10 до 26% с улучшением «времени до прогрессирования» без ущерба для качества жизни. У пациентов с хорошим статусом, перенесших удаление опухоли, лучевая терапия наиболее эффективна. Этот сопутствующий/адъювантный режим сейчас принят в качестве стандарта лечения пациентов с глиобластомой во многих странах.
2. Астроцитомы низкой степени злокачественности. По общему опыту, лечение может вызвать регресс глиом низкой степени злокачественности и улучшить клиническое состояние. Тем не менее, ее роль менее ясна, чем при ГВСЗ. По данным крупномасштабного исследования EORTC и RTOG было установлено, что лучевая терапия не улучшает выживание, но увеличивает время до прогрессирования опухоли. Средняя доза (45 Гр) является столь же эффективной, как и более высокие дозы (60 Гр). Кроме того, выяснилось, что факторы риска являются прогностическими для пациентов, способных выиграть от такого лечения.
Пациенты с хорошим прогностическим показателем (удовлетворительное состояние, возраст 125 I) и применялась при глиомах высокой степени злокачественности при рецидиве или первичном лечении. Однако результаты не подтвердили эффективность брахитерапии. Импланты также применялись для лечения глиом низкой степени злокачественности, а иридиевая проволока в качестве паллиативного средства при глиобластоме.
Успех методики заключается в селективном накоплении 10 В в опухоли при использовании меченых соединений бора, таких как 10 B-BSA. Пучок низкоэнергетических нейтронов с высокой линейной энергетической передачей (LET) обладает малым рассеиванием около опухоли. Это метод изучается в нескольких центрах мира.
ж) Будущее лучевой терапии ЦНС. Лучевая терапия — один из основных методов лечения у больных с различными опухолями ЦНС, особенно злокачественными. Это положение будет сохраняться и в обозримом будущем. Тем не менее, мы приближаемся к пределу, за которым технические улучшения доставки излучения дают небольшие дополнительные преимущества. Перспектива совершенствования методов возникнет на основе нашего лучшего понимания механизмов контролирования клеточного цикла и реагирования на радиационное облучение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Радиология и радиохирургия
Радиология и радиохирургия ¦ Радиологическое лечение опухолей головного мозга
Лечение опухолей головного мозга
Общие представления об опухолях головного мозга
Опухоль головного мозга представляет собой группу патологически измененных клеток, образующихся в самом мозге или вокруг него. Новообразование способно к непосредственному разрушению здоровых тканей головного мозга, а также вызывает воспаление и отек нервной ткани и содействует увеличению внутричерепного давления.
Опухоль головного мозга может быть злокачественной и доброкачественной. Злокачественное новообразование растет быстро и нередко повреждает здоровые ткани мозга, проникая в них. Доброкачественные опухоли отличаются медленным ростом и менее агрессивным поведением.
Опухоли головного мозга принято делить на две группы: первичные и метастатические. Первичные опухоли берут свое начало из тканей головного мозга. Образование метастатического очага связано с отрывом злокачественных клеток от опухолей другой локализации и проникновением их в головной мозг. По этой причине метастатические опухоли всегда являются злокачественными, тогда как первичные новообразования головного мозга могут носить как доброкачественный, так и злокачественный характер.
Классификация опухолей головного мозга учитывает локализацию очага, тип входящей в его состав ткани, характер новообразования (злокачественное или доброкачественное) и др. Если опухоль считается злокачественной, то проводится обязательное изучение ее клеток под микроскопом, что позволяет определить выраженность патологических изменений. На основании проведенного анализа можно судить о степени злокачественности и стадии опухоли. Степень злокачественности и стадия опухоли зависят от быстроты роста раковых клеток, объема кровоснабжения новообразования, наличия зон некроза (гибели клеток), степени сходства злокачественных клеток с нормальными, а также от объема распространения патологически измененных клеток на здоровые ткани.
Точная причина возникновения первичных опухолей головного мозга остается неизвестной. При развитии некоторых опухолей определенную роль играют генетические факторы и факторы внешней среды. У крайне небольшого числа пациентов развитие опухолей головного мозга связано с воздействием излучения, в том числе с терапевтическими целями, в детском возрасте.
К симптомам опухолей головного мозга относятся головные боли, тошнота и рвота, судороги, изменения в поведении, снижение памяти, а также нарушение слуха или зрения.
Варианты лечения опухолей головного мозга
Существует множество вариантов лечения опухолей головного мозга. При этом выбор подходящего метода зависит от типа и размера опухоли, скорости ее роста и общего состояния здоровья пациента.
При лечении опухолей головного мозга применяются хирургические вмешательства, лучевая терапия, химиотерапия, средства прицельной биологической терапии и комбинированные методики. Для быстрого снижения внутричерепного давления лечением первого выбора обычно является хирургическая резекция опухоли.
Лучевая терапия
За два последних десятилетия ученым удалось разработать новые методики облучения опухолей головного мозга с одновременной защитой окружающих здоровых тканей. К ним относится брахитерапия, радиотерапия с модулированной интенсивностью и радиохирургические вмешательства.
Радиотерапия применяется только при тех опухолях, которые к ней чувствительны. При этом используется рентгеновское излучение, гамма-лучи или пучки протонов, которые направляются к опухоли извне, вызывают гибель раковых клеток и сокращение объемов новообразования.
Лучевая терапия занимает, как правило, несколько недель. При множественных опухолевых очагах возможно облучение всего головного мозга.
К новым методам проведения радиотерапии относится:
При первичных опухолях головного мозга часто назначается хирургическое лечение (резекция очага). При этом удаляется вся опухоль или ее часть без существенного вреда для окружающих тканей. При невозможности удаления новообразования операция применяется для уменьшения внутричерепного давления или облегчения симптомов (так называемое паллиативное лечение).
При опухолях головного мозга также возможна химиотерапия, которая считается стандартом лечения первичных злокачественных новообразований (нередко в сочетании с лучевой терапией).
Химиотерапевтические препараты, которые замедляют рост раковых клеток или полностью их уничтожают, назначаются перед, во время или после проведения операции и/или радиотерапии, что предотвращает рецидив опухоли.
Химиотерапевтические препараты назначаются в таблетках или инъекциях, нередко в сочетании с лучевой терапией. Кроме этого, возможно использование радиосенсибилизирующих препаратов, которые увеличивают эффективность радиотерапии.
Что происходит во время лучевой терапии?
Перед началом лучевой терапии пациента консультирует онколог-радиолог. В ходе консультации врач оценивает историю заболевания и проводит осмотр. Кроме этого, проводятся консультации и других специалистов, которые входят в состав группы лечащего персонала.
После выбора наиболее подходящего метода лечения начинается этап планирования радиотерапии. На данном этапе онколог-радиолог, который специализируются на проведении лучевой терапии при злокачественных опухолях, проводит моделирование лечения. При этом используется стандартная рентгенография или КТ, а также, в некоторых случаях, МРТ. Результаты обследования важны для выбора типа и направления пучка лучей.
Во время моделирования радиотерапии важно сохранять неподвижность, хотя никакое лучевое лечение в этот период не проводится. Для удержания головы пациента в определенном положении используется фиксирующая маска. Как правило, лучевая терапия начинается через 1-2 дня после составления плана лечения.
В течение каждого сеанса радиотерапии пациент неподвижно лежит на процедурном столе, в то время как радиолог или техник проводит лечение согласно назначенным онкологом параметрам. Сеанс радиотерапии занимает всего несколько минут и проходит совершенно безболезненно.
Во время стереотаксических радиохирургических вмешательств для фиксации пациента используется жесткая головная рамка. Кроме этого, в ходе процедуры проводится регулярное сканирование (КТ или МРТ), что позволяет точно отслеживать положение опухоли и регулировать дозу излучения при необходимости.
Планирование лечения и первые сеансы радиотерапии занимают 1 или 2 часа. После этого каждый сеанс длится всего несколько минут, а общее пребывание пациента в радиологическом отделении не превышает 30-45 минут. Как правило, радиотерапия проводится 1-2 раза в день, 5 дней в неделю, в течение 5-7 недель.
Возможные побочные эффекты лучевой терапии
Побочные эффекты лучевой терапии при опухолях головного мозга появляются обычно через 2 недели от начала лечения. У большинства пациентов отмечается облысение, степень которого в каждом конкретном случае различна. Как правило, после завершения радиотерапии волосы отрастают вновь.
Вторым по распространенности побочным эффектом является раздражение кожи волосистой части головы и вокруг ушей, которое проявляется зудом, сухостью, покраснением и отеком. При появлении данных симптомов важно как можно скорее связаться с врачом, но не пытаться лечить их самостоятельно.
Другим возможным побочным эффектом лучевого лечения является утомляемость. Наилучшим методом борьбы с ней является достаточный отдых, здоровое питание и помощь родственников и друзей. Энергетическая активность восстанавливается обычно через 6 недель после завершения лечения.
Радиотерапия опухолей головного мозга часто сопровождается отеком нервной ткани, а поэтому о появлении головных болей или чувства давления важно сразу же сообщить врачу. Для купирования отека, профилактики судорог и уменьшения болей используются лекарственные препараты.
Более тяжелые побочные эффекты возникают при одновременном проведении радио- и химиотерапии. Для преодоления неприятных симптомов врач должен назначить соответствующее лечение.
К другим возможным побочным эффектам радиотерапии относится:
Возможные риски и осложнения лучевой терапии
К другим осложнениям лучевой терапии при опухолях головного мозга относится:
У детей излучение может повреждать гипофиз и другие отделы мозга, что проявляется замедлением роста и нарушениями психомоторного и физического развития. Помимо этого, радиотерапия в детском возрасте увеличивает риск развития злокачественных опухолей позже, в течение взрослой жизни. Цель современных исследований в области онкологии сводится к замене радиотерапии при детских опухолях головного мозга на химиотерапевтическое лечение.
Требуется ли какое-то обследование и лечение после окончания лучевой терапии?
При опухолях головного мозга крайне важным является периодическое обследование у онколога. Помимо стандартного физикального и неврологического осмотра, врач может назначить МРТ, МР-спектроскопию, перфузионную или диффузионную МРТ, КТ, ПЭТ-сканирование, анализы крови или эндоскопические процедуры.
Подобное наблюдение помогает врачу:
Кроме этого, онкологи рекомендуют домашний уход, физиотерапию и реабилитационные мероприятия, направленные на восстановление трудоспособности, адекватное обезболивание, участие в группах поддержки для больных онкологическими заболеваниями.
Новейшие достижения в области лечения опухолей головного мозга
Достижения в области фракционированной и стереотаксической радиотерапии за последнее десятилетие несут надежду пациентам с опухолями головного мозга, поскольку позволяют увеличить выживаемость и качество жизни. Клинические исследования показывают эффективность целого ряда процедур и лекарственных препаратов. К ним относится:
(495) 506-61-01 — справочная по радиотерапии и радиохирургии
Израильские специалисты по радиотерапии и радиохирургии
Израиль занимает ведущие позиции в мире в области радиологии. В клиниках Израиля доступны все современные технологии радиотерапии и радиохирургии. Подробнее
Радиооблучение при онкологии головного мозга
Должен ли я всегда проходить лечение в больнице?
Большинство лучевых терапий сегодня не требуют пребывания в стационарном отделении клиники. Пациент может ночевать дома и приходить в клинику амбулаторно, исключительно для проведения самого лечения. Исключением являются те виды лучевой терапии, которые требуют настолько масштабной подготовки, что идти домой просто не имеет смысла. То же касается и лечения, при котором необходимо хирургическое вмешательство, например, брахитерапия, при которой проводится облучение изнутри.
При некоторых сложных комбинированных химиолучевых терапиях также целесообразно оставаться в клинике.
Кроме того, возможны исключения при решении о возможном амбулаторном лечении, если общее состояние пациента не позволяет проводить лечение в амбулаторном режиме или если врачи считают, что регулярное наблюдение будет более безопасным для пациента.
Какую нагрузку я могу переносить во время лучевой терапии?
В конечном итоге и психическая ситуация оказывает свое влияние. Лечение на протяжении нескольких недель резко прерывает привычный ритм жизни, повторяется снова и снова, и уже само по себе утомительно и обременительно.
В целом, даже у пациентов с одним и тем же заболеванием медики наблюдают большие различия – некоторые не испытывают практически никаких проблем, другие отчетливо ощущают себя больными, их состояние ограничивают такие побочные эффекты, как усталость, головные боли или отсутствие аппетита, им необходимо больше покоя. Многие пациенты в целом чувствуют себя как минимум настолько хорошо, что в ходе амбулаторного лечения они ограничены при выполнении несложных дел только в умеренной степени, или же вовсе не ощущают никаких ограничений.
Разрешены ли более высокие физические нагрузки, например, занятия спортом или небольшие путешествия в перерывах между курсами лечения, должен решать лечащий врач. Тот, кто в период облучения хочет вернуться на свое рабочее место, также должен в обязательном порядке обсудить этот вопрос с врачами и кассой медицинского страхования.
На что мне следует обратить внимание в вопросе питания?
Влияние облучения или радионуклидной терапии на питание сложно описать в целом. Пациенты, которые получают высокие дозы облучения в области рта, гортани или горла, находятся абсолютно в другой ситуации, чем, например, пациенты с раком молочной железы, у которых пищеварительный тракт совершенно не попадает в лучевое поле и в случае с которыми лечение, в основном, проводится с целью для закрепления успеха операции.
Пациенты, у которых пищеварительный тракт не затрагивается в ходе лечения, обычно могут не опасаться возникновения каких – либо последствий со стороны питания и пищеварения.
Они могут питаться в обычном режиме, при этом, им необходимо обращать внимание на потребление достаточного количества калорий и на сбалансированное сочетание продуктов питания.
Как необходимо питаться при облучении головы или пищеварительного тракта?
В наблюдении и поддержке нуждаются особенно те пациенты, которые еще до начала облучения не могли нормально питаться, потеряли в весе и/или обнаруживали определенные дефициты. Вопрос о том, необходимо ли пациенту поддерживающее питание («Питание для космонавтов») или введение питательного зонда, решается в зависимости от индивидуальной ситуации, лучше всего до начала лечения.
Пациенты, у которых развивается тошнота или рвота, ассоциирующаяся по времени с облучением, должны обязательно поговорить со своими врачами на тему медикаментов, которые подавляют тошноту.
Помогают ли комплементарные или альтернативные лекарственные препараты, витамины и минеральные вещества справиться с последствиями облучения?
Из страха перед побочными действиями многие пациенты обращаются к средствам, о которых говорят, что они якобы могут защитить от лучевого поражения и возникновения побочных эффектов. Что касается продуктов, о которых спрашивают пациенты в информационной службе по раковым заболеваниям, то здесь мы приведем так называемый «список самых популярных препаратов», включающий комплементарные и альтернативные методы, витамины, минеральные вещества и другие биологически активные добавки.
Однако, подавляющее большинство из этих предложений вовсе не являются лекарственными препаратами и они не играют никакой роли в лечении рака. В частности, в отношении некоторых витаминов ведутся дискуссии о том, не могут ли они даже оказать отрицательное влияние на действие облучения:
Предполагаемая защита от побочных эффектов, которую предлагают так называемые поглотители радикалов или антиоксиданты, такие как витамин А, С или Е, как минимум теоретически, могла бы нейтрализовать необходимый эффект ионизирующего излучения в опухолях. То есть, защищенной была бы не только здоровая ткань, но и раковые клетки.
Первые клинические испытания на пациентах с опухолями головы и шеи, по всей видимости, подтверждают это опасение.
Могу ли я предотвратить повреждение кожи и слизистой оболочки при помощи правильного ухода?
Первые симптомы реакции часто похожи на легкий солнечный ожог. Если же образуются более интенсивные покраснения или даже волдыри, то пациентам следует обратиться к врачу, даже если врачебный прием не был назначен. В долгосрочной перспективе облученная кожа может изменить пигментацию, то есть, стать либо немного темнее, либо светлее. Могут разрушаться потовые железы. Однако, на сегодняшний день тяжелые повреждения стали очень редкими.
Как должен выглядеть уход за зубами?
Для пациентов, которым должно проводиться облучение головы и/или шеи, уход за зубами представляет собой особую проблему. Слизистая оболочка относится к тканям, клетки которых очень быстро делятся, и она страдает от лечения больше, чем, например, кожа. Маленькие болезненные ранки являются достаточно частыми. Риск развития инфекций возрастает.
Если это вообще возможно, перед началом облучения необходимо проконсультироваться со стоматологом, возможно даже в стоматологической клинике, которая имеет опыт в подготовке пациентов к проведению лучевой терапии. Дефекты зубов, если они есть, следует устранить до начала лечения, однако, часто это невозможно осуществить вовремя по практическим причинам.
Во время облучения специалисты рекомендуют чистить зубы тщательно, но очень осторожно, чтобы уменьшить количество бактерий в полости рта, несмотря на возможно поврежденную слизистую оболочку. Чтобы защитить зубы многие радиологи совместно с лечащими стоматологами проводят профилактику фтором с применением гелей, которые используются как зубная паста или же в течение некоторого времени воздействуют непосредственно на зубы через каппу.
Будут ли у меня выпадать волосы?
Выпадение волос при облучении может возникнуть только в том случае, если покрытая волосами часть головы находится в лучевом поле, а доза излучения является относительно высокой. Это касается и волосяного покрова на теле, который попадает в лучевое поле. Таким образом, адъювантное облучение груди при раке молочной железы, например, не влияет на волосы головы, ресницы или брови. Только рост волос в подмышечной области с пораженной стороны, которая попадает в поле излучения, может стать более скудным. Тем не менее, если волосяные фолликулы действительно повреждены, то до того момента, пока снова не появится видимый рост волос, может пройти полгода и больше. Каким образом должен выглядеть уход за волосами в это время, необходимо обсудить с врачом. Важной является хорошая защита от солнечных лучей для кожи головы.
Некоторые пациенты после облучения головы вынуждены считаться с тем, что на протяжении некоторого времени рост волос непосредственно в месте попадания лучей будет скудным. При дозах выше 50 Грей специалисты в области лучевой терапии исходят из того, что не все волосяные луковицы смогут снова восстановиться. До настоящего времени не существует эффективных средств для борьбы или профилактики этой проблемы.
Буду ли я «радиоактивным»? Должен ли я держаться подальше от других людей?
Это необходимо уточнить
Спросите об этом Ваших врачей! Они объяснят Вам, будете ли Вы вообще контактировать с радиоактивными веществами. При обычном облучении этого не происходит. Если Вы все-таки будете контактировать с такими веществами, Вы и Ваша семья получите от врачей несколько рекомендаций по защите от излучения.
Этот вопрос беспокоит многих пациентов, а также их близких, прежде всего, если в семье есть маленькие дети или беременные.
При «нормальной» чрескожной лучевой терапии сам пациент все же не является радиоактивным! Лучи пронизывают его тело и там отдают свою энергию, которую поглощает опухоль. Радиоактивный материал не используется. Даже тесный физический контакт полностью безопасен для родственников и друзей.
При брахитерапии радиоактивный материал может оставаться в теле пациента в течение непродолжительного времени. Пока пациент «испускает лучи» он, как правило, остается в больнице. Когда врачи дают «зеленый свет» для выписки, опасности для семьи и посетителей больше нет.
Имеются ли отдаленные последствия, которые я должен принимать в расчет даже через несколько лет?
Лучевая терапия: у многих пациентов после облучения не остается никаких видимых изменений на коже или внутренних органах. Тем не менее, им необходимо знать, что облученная однажды ткань на длительное время остается более восприимчивой, даже если это не очень заметно в повседневной жизни. Однако, если учитывать повышенную чувствительность кожи при уходе за телом, при лечении возможных раздражений, возникших вследствие воздействия солнечных лучей, а также при механических нагрузках на ткань, то обычно мало что может случиться.
При проведении медицинских мероприятий в области бывшего поля облучения, при заборах крови, физиотерапии и т.д., ответственному специалисту необходимо указать на то, что ему следует соблюдать осторожность. В противном случае даже при незначительных повреждениях существует опасность, что при отсутствии профессиональной обработки процесс заживления будет протекать неправильно и образуется хроническая рана.
Поражение органов
Не только кожа, но и каждый орган, который получил слишком высокую дозу излучения, может реагировать на облучение изменением тканей.
Сюда относятся рубцовые изменения, при которых здоровая ткань замещается менее эластичной соединительной тканью (атрофия, склерозирование), а функция самой ткани или органа утрачивается.
Поражается также и кровоснабжение. Оно или является недостаточным, так как соединительная ткань хуже снабжается кровью через вены, или же образуются множественные маленькие и расширенные венки (телеангиэктазии). Железы и ткани слизистых оболочек после облучения становятся очень чувствительными и по причине рубцовой перестройки реагируют на мельчайшие изменения залипанием.
Какие органы поражаются?
Как правило, поражаются только те области, которые действительно находились в лучевом поле. Если орган поражается, то рубцовая перестройка, например, в слюнных железах, ротовой полости и других отделах пищеварительного тракта, во влагалище или в мочеполовом тракте, при определенных обстоятельствах фактически приводит к утрате функций или к образованию создающих препятствия сужений.
Головной мозг и нервы также могут поражаться высокими дозами излучения. Если матка, яичники, яички или предстательная железа находились в траектории лучей, то способность к зачатию детей может быть утрачена.
Возможно также повреждение сердца, например, у пациентов с раковыми заболеваниями, в случае с которыми при облучении грудной клетки не было возможности обойти сердце.
Из клинических и доклинических исследований радиологам известны специфические для конкретных тканей дозы облучения, при использовании которых можно ожидать появления подобных или других тяжелых повреждений. Поэтому они пытаются, насколько это возможно, избегать таких нагрузок. Новые техники прицельного облучения облегчили эту задачу.
Если нельзя добраться до опухоли, не облучая попутно чувствительный орган, то пациенты вместе со своими врачами, должны совместно обдумать соотношение пользы и риска.
Вторичные раковые заболевания
В самом неблагоприятном случае отсроченные последствия в здоровых клетках приводят также к возникновению спровоцированных облучением вторичных опухолей (вторичных карцином). Они объясняются стойкими изменениями генетического вещества. Здоровая клетка может устранить такие повреждения, но только до определенной степени. При определенных условиях они все-таки передаются дочерним клеткам. Возрастает риск, что при дальнейшем делении клеток появится еще больше повреждений и в итоге возникнет опухоль. В целом, риск после облучений является небольшим. Зачастую может пройти несколько десятков лет, прежде чем такая «ошибка» действительно возникнет. Однако, большинство всех облученных пациентов с раковыми заболеваниями заболевают уже во второй половине своей жизни. Это необходимо учитывать при сравнении возможных рисков и пользы от лечения.
Кроме того, нагрузка при новых методах облучения намного меньше, чем при тех методах, которые применялись еще пару десятилетий назад. Например, у молодых женщин, которые по причине лимфомы получили обширное облучение грудной клетки, то есть, так называемое облучение через магнитное поле вокруг оболочки, как правило, несколько повышен риск развития рака молочной железы. По этой причине в рамках лечения лимфом врачи пытаются применять обширные облучения как можно реже. Среди пациентов с раком предстательной железы, которые проходили лучевую терапию до конца 80-х годов с использованием обычных для того времени методов, риск развития рака кишечника выше в сравнении со здоровыми мужчинами. Актуальное исследование американских ученых показывает, что примерно с 1990 года риск значительно снизился – применение более новых и намного более целенаправленных техник облучения сегодня ведет к тому, что у большинства мужчин кишечник больше совсем не попадает в лучевое поле.