процессы в коре головного мозга при стрессе
«Убегать или бороться»: как наш мозг реагирует на стресс и что поможет справиться со стрессом во время самоизоляции
Что происходит с мозгом человека во время стресса? Какое значение имеют центры потребности? Как сохранить самообладание во время самоизоляции? И почему прокрастинация иногда может быть полезной? Об этом и не только рассказал доктор биологических наук, профессор биологического факультета МГУ, специалист в области физиологии мозга Вячеслав Дубынин. Открытая лекция состоялась в рамках научного фестиваля «КСТАТИ», организованного сетью Информационных центров по атомной энергии (ИЦАЭ). Записали главное в одном материале.
Что такое стресс
Стресс — это общая реакция организма на избыточно сильное воздействие внешней среды, чрезмерные стимулы. Если кратковременный стресс большого вреда для организма не несет, часто он бывает даже приятен, то вот длительный, хронический стресс может причинить весьма серьезный ущерб здоровью.
Наш мозг представляет собой «компьютер», состоящий из 90 млрд нервных клеток. Главная его задача — реагировать на потенциально опасные факторы, высчитывать вероятность успешных и неудачных исходов и строить стратегию поведения исходя из этого. В ситуации стресса мозг должен активировать всю работу организма, чтобы противостоять угрозе. Если это удается, мозг награждает сам же себя за успех, выплескивая дозу дофамина, эндорфинов и прочих приятных нейромедиаторов. Если же возбужденное состояние длится слишком долго, проблема не устраняется, а исход ситуации непонятен, начинается фаза хронического стресса, истощающая организм.
Центры потребностей

Существует шесть основных блоков центральной нервной системы (ЦНС): лобная и теменная кора отвечают за мышление, волю и принятие решений; лимбическая система — за потребности и эмоции; органы чувств — источник сенсорных ощущений; есть также зоны обучения и памяти, двигательные и вегетативные центры, центры сна и бодрствования. События в любом из этих блоков могут стать источником стресса. Чаще всего в сердцевине стрессового состояния лежит работа центров наших потребностей — в мозгу их около двух десятков.
Центры потребностей — весьма древние стволовые структуры ЦНС. Два самых главных центра — задний гипоталамус (нижняя часть промежуточного мозга) и миндалина в глубине височных долей. Миндалина выбирает первичную реакцию на стресс — «убегать или драться». Она посылает сигнал в лобную кору и гипоталамус. Последний командует гипофизом и вегетативной системой, активируя выработку гормонов адреналина и норадреналина.
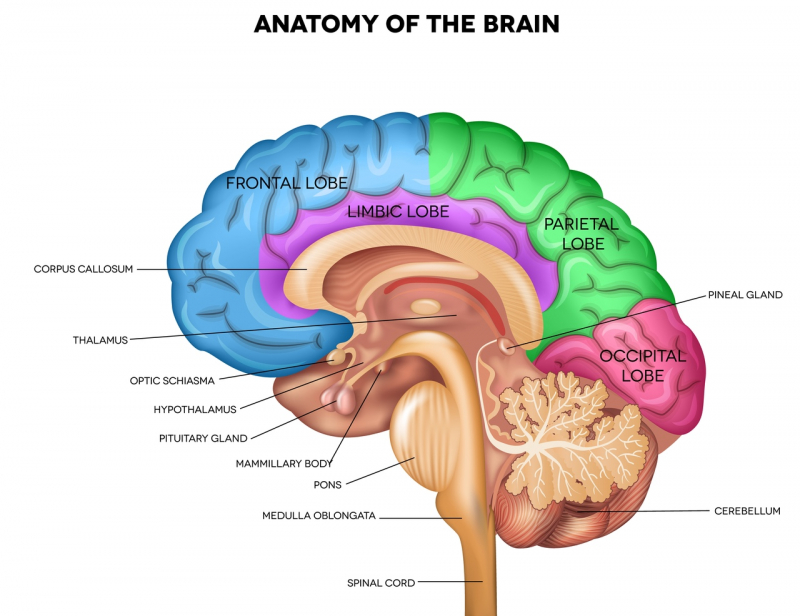
К базовым, витальным потребностям относятся нужда в пище и воде, в дыхании и сне. Сюда же относится потребность в безопасности, уходе за собой (груминге) и лени (расслаблении и экономии сил). Выше уровнем находятся социальные потребности: половое влечение, отношения родителей и детей, чувство собственности, соблюдение иерархии лидеров и подчиненных, потребность в эмпатических переживаниях — сострадании и совместной радости. На самом высоком уровне располагаются потребности саморазвития: исследовательская и творческая деятельность, а также программа свободы, которая характерна для всех живых существ, не только человека.
Все эти программы установлены в каждого из нас, но их проявленность зависит от родительских генов, воспитания и самообучения. Потребности постоянно конкурируют друг с другом: например, сидя в изоляции, мы удовлетворяем свою потребность в безопасности, но лишаем себя свободы, возможности взаимодействовать с людьми и так далее.

Нынешняя ситуация генерирует стресс сразу на нескольких уровнях. Во-первых, это угроза базовому чувству безопасности — а такая угроза всегда вызывает реакции страха и агрессии. Во-вторых, состояние неизвестности — мозг просто не знает, как реагировать и к чему готовиться. Сорвавшиеся планы трактуются мозгом как неудачная деятельность, не приведшая к удовлетворению его потребностей.
Больше всего в ситуации самоизоляции страдают центр свободы и программа лидерства, которая заставляет чувствовать постоянный внутренний протест. Могут страдать и программы сопереживания. Эмпатия — это синхронизация эмоционального состояния в стае, которая работает благодаря зеркальным нейронам, особым структурам, которые заставляют нас чувствовать эмоции других. Сейчас, когда в мире стало очень много негативных эмоций, для эмпатичных людей это может стать проблемой. И если свои переживания за других не трансформировать в какие-то альтруистические действия, можно войти в состояние паники. Помощь же другим приносит положительные эмоции, потому что дает иллюзию, что ты сам избежал опасности.
Нейрохимическое сопровождение стресса
Один из главных медиаторов стресса — норадреналин, который вырабатывается в задней части гипоталамуса, а воздействует в основном на так называемое «голубое пятно». Основные эффекты норадреналина можно определить как «психическое сопровождение стресса»: общее возбуждение мозга и рост двигательной активности, торможение центров сна, улучшение памяти, способности к обучению и запоминанию. При кратковременном стрессе норадреналин дарит много положительных эмоций — азарт, чувство победы. От активности «голубого пятна» и его чувствительности к норадреналину зависит склонность человека к авантюризму, риску и экстремальным видам спорта. При хроническом же стрессе норадреналин вызывает нервное и физическое истощение, постоянное чувство тревоги и бессонницу.
Еще одно важное вещество — это, конечно, всем известный адреналин, который выделяется из мозгового вещества надпочечников. Он вызывает длительную тоническую реакцию, активизирует сердечно-сосудистую систему — именно поэтому в ситуации затяжного стресса избыток адреналина приводит к гипертонии, повышению риска инфаркта и инсульта.
Из тех же надпочечников, но только из их коркового вещества, выделяется известный «гормон стресса» — кортизол. Он ускоряет обмен веществ и заставляет печень выбрасывать запасы глюкозы. А еще кортизол снижает иммунитет: таким образом он сдерживает активность иммунной системы, борется с избыточностью ее реакции, что защищает от развития аутоиммунных заболеваний. При хроническом стрессе подавление иммунитета может быть очень чревато.
Признаки хронического стресса и способы борьбы с ним

Есть несколько симптомов того, что хронический стресс из фазы резистентности переходит в фазу истощения:
В сохранении хорошего настроения и самочувствия огромную роль играет баланс положительных и отрицательных эмоций. Эмоции — это, условно говоря, положительные подкрепляющие стимулы, которыми мозг реагирует на удовлетворение или неудовлетворение своих потребностей.
Распространяясь по мозгу в форме нервных импульсов, сигналы центров потребностей используют в качестве медиаторов эндорфин, ацетилхолин, дофамин, норадреналин и опиоидные пептиды — все они вызывают положительные эмоции. В случае неудачи активируются нейроны, выделяющие эндозепины, трипептид PPI, холецистокинин и другие медиаторы негативных эмоций — они изучены гораздо хуже, чем предыдущие.

Один из самых простых способов получить дозу положительных эмоций — это еда. Процесс питания активизирует сразу множество зон головного мозга: вкусовые центры продолговатого мозга и моста, вкусовые центры гипоталамуса (эмоциональное восприятие пищи, пищевые предпочтения, центр голода) и таламуса (вкусовое внимание); корковые центры вкуса (островковая кора, объединение вкусовых, тактильных и обонятельных сигналов). Но проблема в том, что чрезмерное пристрастие к еде в сочетании с гиподинамией быстро приводит к набору веса. Поэтому в условиях самоизоляции рекомендуется есть меньше, но разнообразнее и вкуснее.
Еще одна эффективная программа по добыче быстрых положительных эмоций — это лень. Дело в том, что программа экономии сил относится к базовым потребностям человека. Во время отдыха выделяется особый медиатор — ацетилхолин, который и вызывает приятное чувство расслабленности. Однако избыточная лень, конечно, чревата негативными последствиями, еще, к тому же, она сильно осуждается обществом.
Связанное с ленью понятие прокрастинации описывает все же немного другую ситуацию. Это не лень в прямом смысле, это замещение актуальной деятельности другой, не столь актуальной. Выполняя мелкие задачи вместо одной важной, но сложной, можно получить маленькое удовольствие и подкрепление. Однако в последнее время все чаще говорят об «активной прокрастинации» и ее полезности: в условиях «горящих» дедлайнов начинает выделяться норадреналин, который помогает справиться с задачей гораздо быстрее и эффективнее.

Гормон дофамин ответственен за чувство удовлетворения и выделяется, например, во время сбора новой информации, обучения, освоения навыков и знаний. Все эти занятия удовлетворяют наши потребности в новизне, они активируют сразу множество отделов мозга: стволовые структуры, теменную кору — центры мышления. Новые полезные знания обогащают и уточняют нашу модель окружающего мира, однако современная манера потребления информации в виде коротких кусочков и обрывков, такой информационный фастфуд, приводит к бесполезному зависанию в интернете. Поэтому предпочтение нужно отдавать системному изучению какой-то темы.
Еще один способ получить дофамин — это занятия спортом и любая физическая активность. Дофамин выделяется в черной субстанции — особой зоне среднего мозга, которая регулирует мелкие и точные движения, в частности пальцев, играет роль в регуляции дыхания, сердечной деятельности, тонусе кровеносных сосудов. Активность черной субстанции определяет склонность человека к лени и комфорту или к двигательной активности. Вообще же управлением движением занимаются две трети всех нейронов мозга (60 из 90 млрд) — так что двигательная активность очень важна для нашего мозга.

Источником сильных положительных эмоций является взаимодействие с близкими людьми — членами семьи, возлюбленными, детьми, друзьями.
У млекопитающих за такое взаимодействие отвечают два гормона: окситоцин и вазопрессин. Они делают нас более щедрыми и альтруистичными, заставляют чувствовать любовь и глубокую привязанность.
Очень важными видами деятельности являются игра и творчество. Изначально игровое поведение служит для тренировки двигательных и социальных навыков, обучения чему-то, но во взрослом возрасте тоже очень полезно играть, например, в буриме, рифмы, головоломки — это очень сильно стимулирует наш мозг. Творчество же является способом удовлетворения потребности в новизне и активного освоения мира. Творческие занятия могут подарить кучу позитивных эмоций, даже если вы никогда ничем таким не занимались и всегда считали, что для этого нужен талант.
Полное видео лекции можно посмотреть на канале Myatom в Youtube.
Механизм разрушения мозга при стрессе
Во время стресса из надпочечников выделяется кортизол. Кортизол (он же гидрокортизон, 17-оксикортикостерон, или соединение F) — биологически активный гормон, производимый корой надпочечников. Эти парные эндокринные железы, прилегающие к почкам и проецирующиеся на уровне 6–7 грудного позвонка, вырабатывают кортизол при содействии адренокортикотропного гормона (АКТГ). В свою очередь сигнал к выработке АКТГ идет из гипоталамуса — центра управления нейроэндокринной деятельностью, расположенного в головном мозге.
Повышенный уровень кортизола напрямую формирует патологические процессы в мозге.
В первую очередь от кортизола страдают лобные доли, которые ответственны за кратковременную память, внимание, контроль эмоций, планирование, принятие решений.
Дети, на которых родители кричат, позорят, запугивают, игнорируют, обзывают, а еще хуже бьют, растут в постоянном стрессе и это влияет на лобные доли мозга. Даже если просто детей постоянно во всем контролируют и лишают самостоятельности, лобные доли у них уменьшаются, перестают активно работать и могут вообще в принципе не развиться до нормальных размеров. Это значит, что академическая успеваемость детей будет низкой, они будут не способны принимать правильные решения, контролировать эмоции, мотивировать себя на учебу, а будут ленивы, расхлябаны и подвержены влиянию дурных компаний.
При хроническом стрессе также начинают уменьшаться в объеме гиппокампус и амигдала, части лимбической системы мозга, расположенной в подкорке.
Гиппокампус стимулирует рост новых нейронов в мозгу, новых нейронных сетей, принимает участие в формировании долговременной памяти. Когда гиппокампус поврежден, то может наступить амнезия, неспособность запоминать, хотя старые воспоминания могут быть по-прежнему прочными. Взрослые люди, переживающие стресс, иногда не могут вспомнить, что они ели на завтрак, но помнят в деталях, что они проходили в школе по литературе, могут цитировать стихи часами.
АМИГДАЛА (МИНДАЛЕВИДНОЕ ТЕЛО)
Амигдала предназначена для выживания и реагирует на триггеры, не вовлекая кору головного мозга. Просто когда мы видим что-то, что когда-то испугало нас в прошлом, амигдала считает, что это угроза нашей жизни и запускает симпатическую нервную систему без всяких рассуждений, и мы мгновенно чувствуем страх или гнев, «убегаем или защищаемся». Амигдала, в сущности неплохая, она хочет нас спасти. Но ее реакция бывает настолько сильной, что она превращается в террориста и захватывает весь мозг, никакие умные доводы не помогают. С точки зрения эволюции это правильно, в каменном веке нам надо было убегать от хищных зверей или бороться с соседними врагами без проволочек, просто на автомате, чтобы спастись от смерти. Сейчас уже нет ни диких зверей, ни врагов, но реагируем мы как древние люди.
Поскольку при стрессе лобные доли, которые ответственны за контроль эмоций, тоже уменьшаются, то эмоциональное регулирование становится еще более затруднительным. Некому укротить строптивую амигдалу.
Публикации в СМИ
Нейрогенез во взрослом мозге: влияние стресса и депрессии
Головной мозг – основной орган, реагирующий на стресс. Эта реакция является комплексным, очень сложным процессом, в котором происходит как активация, так и подавление различных мозговых структур, связанных с формированием памяти, осуществлением двигательных, эмоциональных и когнитивных функций.
Мозг определяет, какие ситуации и события могут оказаться для человека стрессорными, и его ответ на стресс может быть как адаптивным, так и маладаптивным (адекватным либо неадекватным). Хронический стресс приводит к депрессии, которая в свою очередь вызывает повреждения нейронных сетей. Стресс, производимый окружающей средой (стресс на работе, в семье) и в особенности стрессирующие события в жизни, такие как психологические травмы – наиболее распространенные факторы, вызывающие депрессию. Поскольку разработка новых подходов к созданию антидепрессантов и их применению базируется на более глубоком понимании нейробиологических основ этого процесса, необходимо изучение влияния стресса и депрессии на клеточном уровне.
Депрессия является хроническим, рецидивирующим, имеющим множественную этиологию и опасным для здоровья и жизни состоянием, которая представляет из себя набор психологических, нейроэндокринных, физиологических и поведенческих симптомов. Выраженность этих симптомов определяет степень депрессии, которой в те или иные моменты жизни подвергаются до 20% людей во всем мире. Около 20-50% населения земного шара страдают от депрессии, но часто это состояние неверно диагностируют (Wittchen, 2000).
Депрессивные психические расстройства – наиболее распространенное заболевание в мире, провоцирующее серьезные социоэкономические проблемы (WHO, 2001). По прогнозам, к 2015 году депрессия окажется второй после сердечнососудистых заболеваний причиной недееспособности среди европейцев.
Зоны мозга, наиболее сильно страдающие от депрессии – это зоны, отвечающие за формирование эмоций, за процессы обучения и памяти, а именно префронтальная кора, базальные ядра и гиппокамп. Изменения, происходящие в них, включают уменьшение объема структур, размеров нейронов и их плотности, что связано с нарушениями гемодинамики и метаболизма глюкозы. Также снижается количество клеток глии, которые играют ключевую роль в передаче нервного импульса.
Так называемая «стресс-гипотеза» аффективных психических расстройств подтолкнула разработку моделей депрессии на животных. Эти модели стали незаменимы в доклинических исследованиях по психопатологии, патофизиологии депрессии и специфических реакций на антидепрессанты. Открытие того, что в дефинитивной нервной системе продолжаются процессы нейрогенеза, привлекло в свое время большой интерес научного сообщества, так как до этого нейрональные сети взрослого мозга считались неизменными и неспособными к регенерации. Эта аксиома была в 1928 году высказана известным испанским нейрофизиологом Сантъяго Рамоном и Кайялом (Santiago Ramon y Cajal), который в одной из работ написал про нервную ткань: «здесь все может погибнуть, но ничто не способно восстанавливаться» (Cajal, 1928). Современные исследования опровергли этот взгляд, продемонстрировав формирование новых нейронов (нейрогенез) во взрослом мозге. При этом процессы нейрогенеза могут усиливаться позитивными регуляторами и подавляться негативными, такими как острый и хронический стресс.
В то время как стресс ингибирует нейрогенез в гиппокампе, антидепрессанты имеют противоположный эффект. Более того, пациенты с расстройствами эмоциональной сферы в среднем имеют гиппокамп с меньшими средними размерами, чем у здоровых людей. Когда об этом стало известно, это привело к возникновению «нейрогенной гипотезы» депрессии, которая гласит, что нейрогенез в гиппокампе, а точнее его нарушения, могут оказаться первопричиной развития депрессивных расстройств. Однако, согласно сегодняшнему взгляду на эту проблему, нейрогенез в гиппокампе не играет ключевой роли в патогенезе депрессии, хотя и может быть ответственен за некоторые поведенческие эффекты антидепрессантов (Sahay & Hen, 2007).
Также растет количество данных о том, что, помимо воздействия на нейрогенез, стресс и антидепрессанты оказывают влияние на формирование специфических клеток нервной ткани – глии (глиогенез), необходимых для выживания нейронов. Нервная ткань содержит примерно в 100 раз больше глиальных клеток, чем нейронов. Глия выполняет трофическую функцию и принимает участие в регуляции передачи нервных импульсов через синапсы (контакты между отростками нервных клеток). Глиальные клетки также обладают рецепторами к нейротрансмиттерами и стероидным гормонам и способны к генерации электрических импульсов. По этой причине структурные изменения в глиальных клетках могут быть существенны для обмена информацией между нейронами, а также между нейронами и глией.
Во взрослом мозге терапия различными антидепрессантами может стимулировать не только нейрогенез, но и глиогенез. Более того, исследования на животных показали, что хронический стресс подавляет деление клеток не только в гиппокампе, но также и в префронтальной коре, и что этот эффект может быть отменен антидепрессантами (Czeh et al., 2007). Результаты эти были подтверждены исследованиями пациентов с расстройствами эмоций. С помощью компьютерной томографии было показано, что префронтальная кора, несомненно, вовлечена в патофизиологические процессы. В дальнейшем была проведена оценка состояния тканей умерших пациентов, показавшая, что число глиальных клеток в образцах мозга от пациентов, в анамнезе которых была указана тяжелая депрессия, существенно снижено.
В последние два десятилетия представления о мозге сильно изменились. Теперь ясно, что нейрональные и глиальные сети не неизменны, и находятся под контролем множества факторов, таких как факторы внешней среды (например, обучение), и внутренние факторы: нейротрофины, глюкокортикоиды, половые гормоны, и проч. Антидепрессанты стимулируют нейро- и глиогенез, поэтому структурные повреждения, вызванные стрессом и депрессией, не являются необратимыми.
Сегодня считается, что нейрогенез во взрослом мозге ограничен несколькими зонами: гиппокампом и областями, прилегающими к латеральным мозговым желудочкам. Однако появляется все больше данных о том, что образование новых нейронов происходит также в неокортексе. Несмотря на небольшое число этих клеток, они имеют важное значение для функционирования неокортекса. Взаимосвязь психических заболеваний и цитогенеза в дефинитивном неокортексе пока не ясна, но уже ведутся ее доклинические исследования. Возможно, на основе этих работ будут созданы более эффективные подходы к лечению депрессии.
Wittchen HU, Hoefler M, Meister W. Depressionen in der Allgemeinpraxis. Die bundesweite Depressionsstudie. Stuttgart: Schattauer, 2000
Moussavi S, Chatterji S, Verdes E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007;370:851-858
World Health Organisation (WHO). The World Health Report 2001. Mental Health: New Understanding, New Hope. Download http://www.who.int/whr/2001/en/whr01_en.pdf
Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nature Neuroscience 2007;10:1110-1115
Ramon y Cajal, SR. Degeneration and regeneration of the nervous system. London, Oxford University Press, 1928
Czeh B, Mueller-Keuker JIH, Rygula R, et al. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007;32:1490-1503
Код вставки на сайт
Нейрогенез во взрослом мозге: влияние стресса и депрессии
Головной мозг – основной орган, реагирующий на стресс. Эта реакция является комплексным, очень сложным процессом, в котором происходит как активация, так и подавление различных мозговых структур, связанных с формированием памяти, осуществлением двигательных, эмоциональных и когнитивных функций.
Мозг определяет, какие ситуации и события могут оказаться для человека стрессорными, и его ответ на стресс может быть как адаптивным, так и маладаптивным (адекватным либо неадекватным). Хронический стресс приводит к депрессии, которая в свою очередь вызывает повреждения нейронных сетей. Стресс, производимый окружающей средой (стресс на работе, в семье) и в особенности стрессирующие события в жизни, такие как психологические травмы – наиболее распространенные факторы, вызывающие депрессию. Поскольку разработка новых подходов к созданию антидепрессантов и их применению базируется на более глубоком понимании нейробиологических основ этого процесса, необходимо изучение влияния стресса и депрессии на клеточном уровне.
Депрессия является хроническим, рецидивирующим, имеющим множественную этиологию и опасным для здоровья и жизни состоянием, которая представляет из себя набор психологических, нейроэндокринных, физиологических и поведенческих симптомов. Выраженность этих симптомов определяет степень депрессии, которой в те или иные моменты жизни подвергаются до 20% людей во всем мире. Около 20-50% населения земного шара страдают от депрессии, но часто это состояние неверно диагностируют (Wittchen, 2000).
Депрессивные психические расстройства – наиболее распространенное заболевание в мире, провоцирующее серьезные социоэкономические проблемы (WHO, 2001). По прогнозам, к 2015 году депрессия окажется второй после сердечнососудистых заболеваний причиной недееспособности среди европейцев.
Зоны мозга, наиболее сильно страдающие от депрессии – это зоны, отвечающие за формирование эмоций, за процессы обучения и памяти, а именно префронтальная кора, базальные ядра и гиппокамп. Изменения, происходящие в них, включают уменьшение объема структур, размеров нейронов и их плотности, что связано с нарушениями гемодинамики и метаболизма глюкозы. Также снижается количество клеток глии, которые играют ключевую роль в передаче нервного импульса.
Так называемая «стресс-гипотеза» аффективных психических расстройств подтолкнула разработку моделей депрессии на животных. Эти модели стали незаменимы в доклинических исследованиях по психопатологии, патофизиологии депрессии и специфических реакций на антидепрессанты. Открытие того, что в дефинитивной нервной системе продолжаются процессы нейрогенеза, привлекло в свое время большой интерес научного сообщества, так как до этого нейрональные сети взрослого мозга считались неизменными и неспособными к регенерации. Эта аксиома была в 1928 году высказана известным испанским нейрофизиологом Сантъяго Рамоном и Кайялом (Santiago Ramon y Cajal), который в одной из работ написал про нервную ткань: «здесь все может погибнуть, но ничто не способно восстанавливаться» (Cajal, 1928). Современные исследования опровергли этот взгляд, продемонстрировав формирование новых нейронов (нейрогенез) во взрослом мозге. При этом процессы нейрогенеза могут усиливаться позитивными регуляторами и подавляться негативными, такими как острый и хронический стресс.
В то время как стресс ингибирует нейрогенез в гиппокампе, антидепрессанты имеют противоположный эффект. Более того, пациенты с расстройствами эмоциональной сферы в среднем имеют гиппокамп с меньшими средними размерами, чем у здоровых людей. Когда об этом стало известно, это привело к возникновению «нейрогенной гипотезы» депрессии, которая гласит, что нейрогенез в гиппокампе, а точнее его нарушения, могут оказаться первопричиной развития депрессивных расстройств. Однако, согласно сегодняшнему взгляду на эту проблему, нейрогенез в гиппокампе не играет ключевой роли в патогенезе депрессии, хотя и может быть ответственен за некоторые поведенческие эффекты антидепрессантов (Sahay & Hen, 2007).
Также растет количество данных о том, что, помимо воздействия на нейрогенез, стресс и антидепрессанты оказывают влияние на формирование специфических клеток нервной ткани – глии (глиогенез), необходимых для выживания нейронов. Нервная ткань содержит примерно в 100 раз больше глиальных клеток, чем нейронов. Глия выполняет трофическую функцию и принимает участие в регуляции передачи нервных импульсов через синапсы (контакты между отростками нервных клеток). Глиальные клетки также обладают рецепторами к нейротрансмиттерами и стероидным гормонам и способны к генерации электрических импульсов. По этой причине структурные изменения в глиальных клетках могут быть существенны для обмена информацией между нейронами, а также между нейронами и глией.
Во взрослом мозге терапия различными антидепрессантами может стимулировать не только нейрогенез, но и глиогенез. Более того, исследования на животных показали, что хронический стресс подавляет деление клеток не только в гиппокампе, но также и в префронтальной коре, и что этот эффект может быть отменен антидепрессантами (Czeh et al., 2007). Результаты эти были подтверждены исследованиями пациентов с расстройствами эмоций. С помощью компьютерной томографии было показано, что префронтальная кора, несомненно, вовлечена в патофизиологические процессы. В дальнейшем была проведена оценка состояния тканей умерших пациентов, показавшая, что число глиальных клеток в образцах мозга от пациентов, в анамнезе которых была указана тяжелая депрессия, существенно снижено.
В последние два десятилетия представления о мозге сильно изменились. Теперь ясно, что нейрональные и глиальные сети не неизменны, и находятся под контролем множества факторов, таких как факторы внешней среды (например, обучение), и внутренние факторы: нейротрофины, глюкокортикоиды, половые гормоны, и проч. Антидепрессанты стимулируют нейро- и глиогенез, поэтому структурные повреждения, вызванные стрессом и депрессией, не являются необратимыми.
Сегодня считается, что нейрогенез во взрослом мозге ограничен несколькими зонами: гиппокампом и областями, прилегающими к латеральным мозговым желудочкам. Однако появляется все больше данных о том, что образование новых нейронов происходит также в неокортексе. Несмотря на небольшое число этих клеток, они имеют важное значение для функционирования неокортекса. Взаимосвязь психических заболеваний и цитогенеза в дефинитивном неокортексе пока не ясна, но уже ведутся ее доклинические исследования. Возможно, на основе этих работ будут созданы более эффективные подходы к лечению депрессии.
Wittchen HU, Hoefler M, Meister W. Depressionen in der Allgemeinpraxis. Die bundesweite Depressionsstudie. Stuttgart: Schattauer, 2000
Moussavi S, Chatterji S, Verdes E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007;370:851-858
World Health Organisation (WHO). The World Health Report 2001. Mental Health: New Understanding, New Hope. Download http://www.who.int/whr/2001/en/whr01_en.pdf
Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nature Neuroscience 2007;10:1110-1115
Ramon y Cajal, SR. Degeneration and regeneration of the nervous system. London, Oxford University Press, 1928
Czeh B, Mueller-Keuker JIH, Rygula R, et al. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007;32:1490-1503