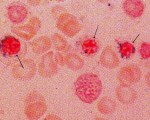
при исследовании костного мозга у больного сидероахрестической анемией выявляется
Публикации в СМИ
Анемии сидеробластные
Сидеробластная сидероахрестическая анемия (сидероахрестическая анемия) — гипохромная микроцитарная гипорегенераторная анемия вследствие нарушения утилизации внутриклеточного железа для синтеза Hb, несмотря на нормальное или повышенное содержание железа в митохондриях эритробластов. В результате в костном мозге увеличивается количество сидеробластов — нормобластов с характерным кольцевидным расположением гранул железа вокруг ядра (кольцевидные сидеробласты).
Диагностика. Нарушение синтеза Hb вызывает снижение среднего содержания Hb в эритроците; появляется популяция гипохромных микроцитов. У пациентов старше 60 лет (а также при врождённой форме у подростков) анемия может быть относительно тяжёлой • В костном мозге — эритроидная гиперплазия, при окраске мазка на железо видны кольцевидные сидеробласты • В сыворотке крови обнаруживают увеличение количества ферритина и значительное увеличение содержания сывороточного железа с высоким насыщением трансферрина • Содержание ретикулоцитов снижено (гипорегенераторная анемия) • Сочетание гипохромных микроцитарных клеток с нормоцитами или даже макроцитами — диагностический признак сидеробластной анемии.
Лечение • Исключение провоцирующих факторов (ЛС, алкоголь) • Всем пациентам следует пробно назначить пиридоксин в больших дозах (в большинстве случаев, исключая почти все наследственные формы, улучшения состояния нет). Аналогичен и эффект андрогенов • Гемотрансфузии (больные часто трансфузиозависимы).
МКБ-10 • D64 Другие анемии
Код вставки на сайт
Анемии сидеробластные
Сидеробластная сидероахрестическая анемия (сидероахрестическая анемия) — гипохромная микроцитарная гипорегенераторная анемия вследствие нарушения утилизации внутриклеточного железа для синтеза Hb, несмотря на нормальное или повышенное содержание железа в митохондриях эритробластов. В результате в костном мозге увеличивается количество сидеробластов — нормобластов с характерным кольцевидным расположением гранул железа вокруг ядра (кольцевидные сидеробласты).
Диагностика. Нарушение синтеза Hb вызывает снижение среднего содержания Hb в эритроците; появляется популяция гипохромных микроцитов. У пациентов старше 60 лет (а также при врождённой форме у подростков) анемия может быть относительно тяжёлой • В костном мозге — эритроидная гиперплазия, при окраске мазка на железо видны кольцевидные сидеробласты • В сыворотке крови обнаруживают увеличение количества ферритина и значительное увеличение содержания сывороточного железа с высоким насыщением трансферрина • Содержание ретикулоцитов снижено (гипорегенераторная анемия) • Сочетание гипохромных микроцитарных клеток с нормоцитами или даже макроцитами — диагностический признак сидеробластной анемии.
Лечение • Исключение провоцирующих факторов (ЛС, алкоголь) • Всем пациентам следует пробно назначить пиридоксин в больших дозах (в большинстве случаев, исключая почти все наследственные формы, улучшения состояния нет). Аналогичен и эффект андрогенов • Гемотрансфузии (больные часто трансфузиозависимы).
При исследовании костного мозга у больного сидероахрестической анемией выявляется
Комплексное исследование всех необходимых лабораторных маркеров различных анемий, используемое для дифференциальной диагностики заболеваний из этой группы.
Комплексная лабораторная диагностика анемий.
Anemia Laboratory Panel, Complex Laboratory Diagnostics of Anemia.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
О наличии анемии говорят при снижении гематокрита менее 41 % (гемоглобина менее 13,5 г/дл) у мужчин и менее 37 % (гемоглобин менее 12 г/дл) у женщин. Существует множество причин развития анемии:
1. Нарушение образования эритроцитов:
2. Усиленное разрушение эритроцитов:
Хотя причин анемии очень много, их дифференциальная диагностика достаточно проста при исследовании клинико-лабораторных маркеров анемий. Это комплексное исследование включает следующие анализы и маркеры.
Общий анализ крови – скрининговый анализ при подозрении на анемию. Позволяет получить важную информацию о природе анемии при его правильной интерпретации:
Кроме того, независимо от причины анемии, степень ее тяжести оценивается на основании данных ОАК.
Ретикулоциты – клетки-предшественники эритроцитов. Их количество отражает «эффективность» эритропоэза. Повышение количества ретикулоцитов отражает текущий или недавний интенсивный эритропоэз, который наблюдается в следующих случаях:
Снижение количества ретикулоцитов отражает нарушение эритропоэза, которое наблюдается в следующих случаях:
Витамин В12, витамин В9 (фолиевая кислота), железо – это элементы, необходимые для разных этапов эритропоэза. При интерпретации уровня этих маркеров необходимо учитывать следующие моменты:
Ферритин – внутриклеточный белок, обеспечивающий хранение железа в тканях. Считается, что концентрация ферритина в крови отражает запасы железа в организме. Трансферрин – белок плазмы крови, обеспечивающий транспорт железа. Как правило, концентрации трансферрина и ферритина в крови находятся в обратной пропорциональной зависимости: чем выше уровень ферритина, тем ниже уровень трансферрина. Следует помнить, что трасферрин и ферритин относятся к так называемым белкам острой фазы воспаления, поэтому их концентрация зависит не только от уровня железа, но и от многих других факторов, в первую очередь от воздействия на гепатоциты про- и противовоспалительных цитокинов. По уровню трансферрина, ферритина и железа сыворотки можно судить о природе анемии.
Распространенные анемии
Анемия хронического заболевания
Витамин В12-дефицитная анемия
Креатинин, с определением СКФ и эритропоэтин. Исследование этих параметров позволяет исключить заболевания почек как причину анемии.
Развернутая лабораторная диагностика анемий включает основные, но не все анализы, которые могут быть необходимы при выявлении причин анемии. В некоторых случаях могут потребоваться более сложные анализы, например иммуноморфологическое исследование красного костного мозга. Более того, при определении причины анемии могут потребоваться дополнительные тесты, например анализ кала на скрытую кровь при диагностике железодефицитной анемии у взрослого. Результат исследования оценивают с учетом всех значимых анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:
41 Антитела к внутреннему фактору Кастла
12 Определение рецепторов в опухоли молочной железы иммуногистохимическим методом (трепанбиоптат, операционный материал)
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, гематолог.
Сидеробластная анемия ( Сидероахрестическая анемия )
Сидеробластная анемия – это приобретенное или наследственное заболевание крови, характеризующееся гипохромией эритроцитов, высоким уровнем сывороточного железа с отложением в тканях органов. Клиническая картина представлена анемическим синдромом (головокружение, утомляемость, бледность кожи), гемосидерозом внутренних органов (гепатомегалия, кардиомегалия, ХПН), изменением картины крови. Диагноз выставляется на основании клинических и биохимических анализов (ОАК, сывороточное Fe, ферритин, трансферрин, витамин В6), генодиагностики, исследования миелограммы. Лечение может включать гемотрансфузии, витамино-, гормонотерапию, хелаторную терапию.
МКБ-10
Общие сведения
Сидеробластные (сидероахрестические) анемии включают несколько гетерогенных синдромов, которые протекают с нарушением синтеза гема, несмотря на повышенное содержание железа в плазме. Популяционная частота сидеробластных анемий (СБА) не выяснена ввиду их клинической неоднородности, однако известно, что приобретенные формы встречаются чаще наследственных. Врожденные анемии обычно манифестируют в детстве, но могут оставаться нераспознанными вплоть до зрелого возраста. Первичная приобретенная сидеробластная анемия диагностируется преимущественно у лиц среднего и пожилого возраста.
Причины
Врожденная сидеробластная анемия
Врожденные СБА связаны с мутациями в генетическом материале. Они различаются по типу наследования и патогенетическому механизму:
Приобретенная сидеробластная анемия
Идиопатические (первичные) СБА ‒ рефрактерные анемии с кольцевыми сидеробластами ‒ рассматриваются как разновидность миелодиспластического синдрома (МДС) и занимают в его структуре 5-15%. Чаще возникают как следствие лучевой или цитостатической терапии, проводимой по поводу коллагенозов, гемобластозов, различных онкопроцессов. Риск развития МДС повышен у курильщиков, лиц, контактирующих с химическими веществами (бензином, растворителями, инсектицидами).
Вторичная сидеробластная анемия может быть этиологически связана со следующими факторами:
Патогенез
Независимо от многообразия причин все они тем или иным путем приводят к нарушению образования гема. Гем является соединением, состоящим из протопорфирина и атома железа (Fe2+). При его связывании с белком глобином образуется гемсодержащий хромопротеин гемоглобин, главная функция которого заключается в транспорте кислорода к тканям, а углекислоты из тканей.
При СБА в результате дефектов ферментных систем, дефицита пиридоксальфосфата, токсического влияния или других факторов нарушается биосинтез протопорфирина, что делает образование гема невозможным, несмотря на достаточный уровень Fe в сыворотке крови. Развивается гипохромная анемия. В условиях, когда железо не используется клетками, оно начинает накапливаться в тканях и внутренних органах с развитием их дисфункции.
Классификация
Сидеробластные анемии делятся на 2 большие группы – наследственные и приобретенные, внутри которых выделяют конкретные клинические формы, связанные с определенными этиофакторами:
1. Наследственные сидеробластные анемии:
2. Приобретенные сидеробластные анемии:
Симптомы сидеробластной анемии
В клинической картине сидероахрестических анемий преобладают две группы симптомов: циркуляторно-гипоксические и недостаточность органов, обусловленная гемосидерозом. Гематологические изменения выявляются при диагностическом исследовании крови и костного мозга.
Гипоксический синдром сопровождается недомоганием и слабостью, тахикардией, снижением АД. Характерны жалобы на головокружение, ноющие боли в сердце, появление «мушек» перед глазами, одышку при движениях. Отмечается сухость и бледность кожи, ломкость ногтей. У детей ухудшается запоминание учебного материала, снижается успеваемость.
Депонирование железа приводит к развитию гепатоспленомегалии, а в поздних стадиях – циррозу печени. Поражение поджелудочной железы сопровождается манифестацией сахарного диабета. Гемосидероз миокарда проявляется кардиомегалией, нарушением ритма, сердечной недостаточностью. Отложение железа в тканях мужских половых желез вызывает вторичный гипогонадизм. При поражении легких возникает дыхательная недостаточность, почек – ХПН.
Осложнения
Перегрузка железом вызывает необратимые органные поражения, приводящие к стойкой функциональной недостаточности сердца, печени, почек, эндокринных органов. Таким пациентам требуется пожизненная заместительная и поддерживающая терапия, у них снижена общая продолжительность жизни. Течение идиопатической формы сидеробластной анемии у 5-10% пациентов осложняется острым лейкозом, рефрактерным к полихимиотерапии.
Диагностика
Основанием для выставления диагноза «сидеробластная анемия» служат клинические и лабораторные данные. Больных консультирует врач-гематолог, при необходимости – генетик, токсиколог, ревматолог, нарколог. Опорными диагностическими критериями выступают:
Лечение сидеробластной анемии
При токсических и лекарственных формах СБА в первую очередь устраняют провоцирующий фактор (отменяют ЛС, проводят дезинтоксикационную терапию и т.д.). Лекарственная терапия сидеробластной анемии включает назначение следующих препаратов:
При выраженном анемическом синдроме возникает необходимость в гемотрансфузиях. В случае значительного увеличения селезенки производится спленэктомия. В литературе имеются отдельные сообщения об эффективности аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК) для терапии наследственной пиридоксин-резистентной сидеробластной анемии.
Прогноз и профилактика
Прогноз при сидеробластной анемии обусловлен ее этиологией. Лучше поддаются коррекции пиридоксин-зависимые и некоторые приобретенные формы (лекарственные, алиментарные). Существенно снижена продолжительность жизни у лиц с СБА, трансфузионно-зависимыми, рефрактерными к лечению, ассоциированными с лейкемией, синдромом Пирсона. Профилактика, прежде всего, касается вторичных сидеробластных анемий: следует полноценно питаться, принимать витаминные комплексы, не допускать интоксикаций (этанолом, свинцом) и контакта с вредными веществами. Для исключения наследственных СБА рекомендуется генетическое консультирование.
Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Куриляк О.А., к.б.н.
Анемией обозначается состояние, которое характеризуется снижением содержания в крови гемоглобина ( 3 4,5-11,0*10 9 /л
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
Гипохромные анемии характеризуются низким значением МСН ( 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Алгоритм диагностического поиска при анемии
Гипохромно-микроцитарные анемии
Как было упомянуто выше, при выявлении у пациента гипохромного характера анемии в первую очередь следует заподозрить ЖДА (все ЖДА являются гипохромными!). Однако факт наличия гипохромной анемии сам по себе не исключает других патогенетических вариантов анемии, поскольку не все гипохромные анемии являются железодефицитными. Например, гипохромная анемия может возникать при нарушении синтеза гемоглобина в результате нарушения включения в его молекулу железа при нормальном или даже повышенном уровне железа в сыворотке крови (см. нарушение синтеза порфиринов). Поэтому для дифференциальной диагностики этих состояний следует в первую очередь провести исследование содержания железа в сыворотке. Причем, этот анализ надо выполнять обязательно до назначения больным лекарственных препаратов железа или проведения трансфузий эритроцитов.
Если уровень железа в сыворотке крови находится в пределах нормы или повышен, следует заподозрить у пациента анемию, связанную с нарушением синтеза порфиринов или талассемию и на следующем этапе диагностики целесообразно определить концентрацию ретикулоцитов. Выявление пониженного уровня железа в сыворотке крови однозначно указывает на необходимость определения других показателей обмена железа (ОЖСС и уровень ферритина).
При ЖДА этот показатель снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%).
Еще одним высоко специфичным диагностическим признаком ЖДА является концентрация ферритина в сыворотке крови. Уровень ферритина отражает величину запасов железа в организме. Поскольку истощение запасов железа является обязательным этапом формирования ЖДА, то снижение содержания ферритина (менее 15 мкг/л) – характерный признак не только ЖДА, но и латентного дефицита железа. Однако этот показатель следует оценивать с осторожностью при сопутствующих острых воспалительных процессах, болезнях печени и некоторых опухолях. Дело в том, что ферритин принадлежит к классу острофазных белков и при перечисленных выше состояниях его синтез увеличивается, что при ЖДА может маскировать гипоферритинемию.
снижение содержания ферритина в сыворотке.
Клинический пример №1: У 34-летней женщины выявлена гипохромная микроцитарная анемия с очень низкими MCV (49,0 фл) и МCH (15.0 пг), а также существенно увеличенным значением RDW ( 21.3%).
Т. о., биохимические исследования подтвердили диагноз ЖДА.
После 10-дневного курса терапии пероральными препаратами железа отмечено увеличение RDW, а также появление на гистограмме распределения эритроцитов по объему второго пика в области нормоцитов (отмечен стрелкой).
Полученная кривая свидетельствует об адекватности назначенного лечения.
Таким образом, по данным гемограммы анемия отсутствует. Однако, в картине крови преобладают микроциты с низким содержанием гемоглобина. Наиболее вероятен диагноз – латентный дефицит железа.
2. Анемии при хронических заболеваниях (АХЗ) = железораспределитель-ные анемии
Среди микроцитарно-гипохромных анемий второе место по частоте после ЖДА занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения.
При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных при АХЗ считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных или опухолевых процессах. Поступающее в организм и высвобождающееся из разрушающихся эритроцитов железо переходит, главным образом, в депо, где и накапливается в макрофагальных клетках в виде железосодержащего белка ферритина. В то же время, перенос железа из клеточного ферритина к трансферрину нарушен, что влечет за собой снижение уровня сывороточного железа. Развивается перераспределительный, или функциональный, дефицит железа вследствие накопления и блокады освобождения железа в тканевых макрофагах, что приводит к снижению доставки железа к эритрокариоцитам костного мозга, нарушению эритропоэза и развитию анемии. Поскольку истинного дефицита железа при этих АХЗ не наблюдается, более оправданно говорить не о железодефицитных, а о железоперераспределительных анемиях. Выделение железоперераспределительных анемий в отдельный патогенетический вариант имеет важное значение, так как при сходстве данного варианта с ЖДА терапевтические подходы при этих анемиях абсолютно различны.
Критерии железоперераспределительных анемий:
3. Анемии, связанные с нарушением синтеза порфиринов = сидероахрести-ческие анемии
Картина гемограммы при данном типе анемий аналогична таковой при ЖДА, поэтому для уточнения диагноза следует обращать пристальное внимание на биохимические показатели обмена железа (Табл.3).
Критериями сидероахрестических анемий являются:
Пациентку лечили препаратами железа. Эффекта не было. После проведения дополнительных исследований получены следующие результаты:
Поскольку при мегалобластном типе кроветворения соотношение лейкопоэз/эритропэз сдвигается в сторону эритропоэза, при анализе гемограммы обычно отмечается лейкопения и тромбоцитопения, которые носят умеренно выраженный характер. Нарушение процессов созревания гранулоцитарного ростка приводит к появлению в крови гигантских гиперсегментированных нейтрофилов.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический тип кроветворения с высоким уровнем неэффективного эритропоэза. Данное исследование должно проводиться до назначения витамина В12, т.к. иньекция В12 в течение 1-2 суток изменяет тип кроветворения в костном мозге. Мегалобласты уменьшаются в размерах, меняется структура ядра, клетки становятся макронормобластами. Только по присутствию гиганских форм нейтрофилов можно предположить, что имело место мегалобластическое кроветворение. При невозможности выполнить диагностическое исследование костного мозга допустимо пробное назначение витамина В12 с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если анемия связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что приводит к значительному увеличению в периферической крови количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Окончательная верификация В12-дефицитного характера анемии может быть осуществлена с помощью исследования концентрации в крови витамина В12 (норма для взрослых: 148-616 пмоль/л, старше 60-ти лет: 81-568 пмоль/л).
Макроцитоз в комбинации с гиперсегментацией нейтрофилов и дефицитом витамина В12 подтверждают диагноз В12-дефицитной анемии.
Фолиево-дефицитные анемии
Фолиево-дефицитные анемии по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) аналогичны В12-дефицитным анемиям. Отличительной особенностью является снижение в сыворотке крови уровня фолата (норма 6-20 нг/мл), а также снижение его концентрации в эритроцитах (норма 160-640 нг/мл).
Нормохромно-нормоцитарные анемии
1. Гемолитические анемии ГА
Основным патогенетическим механизмом развития гемолитической анемии (ГА) является укорочение продолжительности жизни эритроцитов (в норме в среднем 120 дней) и их преждевременный распад под воздействием различных причин.
Критерии ГА:
Большинство ГА являются нормохромными, за исключением ГА, связанной с нарушением синтеза глобина (талассемия), которая, как было отмечено выше, является гипохромной. Основным лабораторным признаком, позволяющим заподозрить ГА, является повышение в крови количества ретикулоцитов, в связи с чем данный анализ следует считать обязательным при всех неясных анемиях. Фактически ретикулоцитоз встречается в двух ситуациях, при которых активируется нормальный эритропоэз – при гемолизе и острых кровопотерях. Наряду с ретикулоцитозом при интенсивном гемолизе в крови обнаруживаются ядросодержащие эритроидные клетки (эритрокариоциты), обнаруживаемые в норме только в костном мозге. Наличие или отсутствие гипербилирубинемии определяется, с одной стороны, интенсивностью гемолиза, а с другой – функциональной способностью печени связывать билирубин с глюкуроновой кислотой и экскретировать его в желчь. Поэтому нормальные показатели содержания билирубина в крови не исключают гемолиза. При некоторых ГА, сопровождающихся внутрисосудистым гемолизом (болезнь Маркиафавы, аутоиммунные ГА), в крови увеличивается содержание свободного гемоглобина, выделяющегося с мочой в виде гемосидерина. Последний может быть обнаружен в моче с помощью бензидиновой пробы (аналогичной исследованию скрытой крови в кале) или при окраске осадка мочи на выявление гемосидерина. Эти информативные тесты должны чаще использоваться в лабораторной практике при подозрении на внутрисосудистый гемолиз.
Наследственные ГА связаны с различными генетическими дефектами, в частности с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо-6-фосфат-дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Среди приобретенных ГА наиболее распространенными являются аутоиммунные ГА (симптоматические и идиопатические). Симптоматические аутоиммунные ГА возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности, вирусных, при приеме ряда медикаментов (альфа-метилдопа). Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГА. К приобретенным ГА относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГА (гемолиз вследствие ДВС-синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГА при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
При наличии соответствующих подозрений уточнению причины ГА, т.е. нозологической диагностике, могут способствовать следующие исследования:
2. Анемии при костномозговой недостаточности
В основе данного патогенетического варианта анемий лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеется нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития анемии.
Критерии анемии при костномозговой недостаточности:
Ключевой особенностью, позволяющей предположить данный патогенетический вариант анемий, является нарушение со стороны других ростков костного мозга (гранулоцитопения, тромбоцитопения), что может проявляться соответствующей клинической симптоматикой в виде инфекционных осложнений (часто отмечается только лихорадка) или геморрагического синдрома (зависит от выраженности тромбоцитопении). Уместно напомнить, что при В12-дефицитной анемии также может наблюдаться лейко- и тромбоцитопения, однако цитопении при этом выражены умеренно и обычно не сопровождаются описанными симптомами.
Анемия при костномозговой недостаточности может возникать при следующих заболеваниях и патологических процессах: острые и хронические лейкозы; метастазы злокачественных опухолей в костный мозг; замещение костного мозга фиброзной тканью (миелофиброз) вследствие различных причин; замещение костного мозга жировой тканью (апластическая анемия) вследствие различных причин; изолированное угнетение продукции эритроидных клеток костного мозга, чаще иммунной природы (парциальная красноклеточная анемия); миелодиспластический синдром (гетерогенная группа гематологических нарушений, одними из которых являются так называемые рефрактерные анемии).
Фактически с помощью исследования костного мозга (цитологического, гистологического) при данном патогенетическом варианте осуществляется нозологическая диагностика, хотя часто требуется уточнение формы и причины выявленных изменений.
В основе развития анемии может лежать так называемый миелодиспластический синдром (МДС), который является результатом приобретенного дефекта стволовой клетки-предшественницы миелопоэза, что приводит к нарушению нормальной дифференцировки клеток различных ростков костного мозга (эритроидного, гранулоцитарного, тромбоцитарного). В результате этого гемопоэз оказывается неэффективным, что в конечном счете проявляется цитопениями в различных сочетаниях. Неэффективность эритропоэза позволяет трактовать анемию при МДС как следствие костномозговой недостаточности. Основным признаком, позволяющим заподозрить МДС, является бедность клетками периферической крови в сочетании с высокой клеточностью костного мозга и признаками дисплазии всех ростков кроветворения. МДС встречается почти исключительно у больных пожилого и старческого возраста, характеризуется анемией, рефрактерной к лечению препаратами железа, витамином В12, фолиевой кислотой, повышением в костном мозге эритроидных клеток, содержащих железо (рефрактерная анемия с сидеробластами).
3. Анемия при уменьшении массы циркулирующих эритроцитов
Данный патогенетический вариант анемии отличается от остальных и характеризуется уменьшением количества эритроцитов и гемоглобина за счет уменьшения массы циркулирующей крови. Основной причиной развития данного варианта анемий являются острые кровопотери различной локализации.
Основные признаки анемии при уменьшении массы эритроцитов: