Предположите с чем могут реагировать s элементов учитывая их восстановительные свойства
Окислительно-восстановительные свойства элементов в Периодической таблице
Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
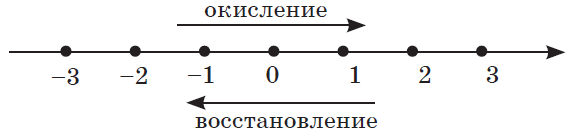
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).
С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
Перманганат калия KMnO4 является окислителем в любой среде:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Реакции окислительно-восстановительные (часть С)
Теория к заданию 30 из ЕГЭ по химии
Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее
Признаки окислительно-восстановительных реакций
Многообразие классификаций химических реакций по различным признакам (числу и характеру реагирующих и образовавшихся веществ, направлению, фазовому составу, тепловому эффекту, использованию катализатора) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
Например, в реакции
степени окисления атомов химических элементов после реакции не изменились. А вот в реакции взаимодействия соляной кислоты с цинком
а каждый атом цинка отдал два электрона:
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Окислитель и восстановитель. Окисление и восстановление
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
Отдавать свои электроны могут отрицательные ионы:
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
Метод электронного баланса
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакция взаимодействия алюминия с хлоридом меди (II) описывается схемой:
а электронные уравнения будут иметь вид:
Молекулярное уравнение этой реакции:
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Известно, что первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространяется на концентрированную серную кислоту и азотную кислоту любой концентрации.
Подчеркнем знаки химических элементов, изменивших свои степени окисления:
Составим электронные уравнения, т.е. отразим процессы отдачи и присоединения электронов:
и уравняем число атомов водорода:
Коррозия металлов
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто повторяем слова «ржавчина», «ржавление», видя коричнево-желтый налет на изделиях из железа и его сплавов. Ржавление — это частный случай коррозии.
Коррозия — это процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т.д.
Коррозия металлов бывает сплошной и местной.
Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов — точечная. Она заключается в образовании сквозных поражений, т.е. точечных полостей — питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений.
Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования.
Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличивать расход металла, что требует дополнительных экономических затрат.
Из всего сказанного следует, что очень важной проблемой является изыскание способов защиты металлов и сплавов от коррозии. Они весьма разнообразны. Но для их выбора необходимо знать и учитывать химическую сущность процессов коррозии.
По химической природе коррозия — это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями-неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах.
II. Электрохимическая коррозия происходит в токопроводящей среде (в электролите с возникновением внутри системы электрического тока). Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Рассмотрим разрушение железного образца в присутствии примеси олова.
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
Итак, электрохимическая коррозия — окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл).
На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение).
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и, конечно же, хорошо из вестные вам электролиты — растворы солей, щелочей, кислот.
Вы, очевидно, помните, что зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия, иногда хлорид кальция). Образующиеся растворы стекают в канализационные трубопроводы, создавая тем самым благоприятную среду для электрохимической коррозии подземных коммуникаций.
Способы защиты от коррозии
Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии:
1. Шлифование поверхности изделий, чтобы на них не задерживалась влага.
3. Нанесение защитных покрытий. Рассмотрим их виды.
А. Неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы.
В. Металлические — это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т.д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты.
А. Протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк.
Б. Катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая кон струкция.
А. Введение веществ-ингибиторов, замедляющих коррозию.
Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись только окалина и ржавчина. Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Б. Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :