показания к назначению антибактериальных препаратов в амбулаторно поликлинической практике
Современные подходы к антибактериальной терапии госпитальных инфекций
В повседневной практике в стационаре клиницисту приходится сталкиваться с двумя группами инфекционных болезней. К первой из них относятся внебольничные инфекции — инфекционные процессы, возникшие вне стационара и по поводу которых пациент поступил в стац
В повседневной практике в стационаре клиницисту приходится сталкиваться с двумя группами инфекционных болезней. К первой из них относятся внебольничные инфекции — инфекционные процессы, возникшие вне стационара и по поводу которых пациент поступил в стационар. Ко второй группе — госпитальные (внутрибольничные, нозокомиальные) инфекции, развившиеся у пациента в стационаре.
Практически важные различия между двумя указанными группами инфекционных болезней касаются их этиологической структуры и антибиотикорезистентности возбудителей. Для внебольничных инфекций характерен ограниченный и достаточно стабильный состав наиболее вероятных возбудителей, зависящий от локализации инфекционного процесса. Спектр возбудителей госпитальных инфекций, как правило, несколько менее предсказуем. Возбудители внебольничных инфекций, в сравнении с возбудителями госпитальных, характеризуются также существенно меньшим уровнем антибиотикорезистентности. Указанные различия важны для выбора рациональной эмпирической терапии инфекций в стационаре.
В стационарах в условиях тесного контакта между отдельными пациентами, а также между больными и персоналом появляется возможность обмена штаммами микроорганизмов. Параллельно на фоне интенсивного применения антибиотиков происходит селекция антибиотикорезистентных штаммов.
В результате в лечебных учреждениях складывается микроэкологическая ситуация, характеризующаяся доминированием определенных штаммов микроорганизмов и преобладанием среди них антибиотикорезистентных штаммов. Доминирующие в лечебном учреждении штаммы называют госпитальными. Четких критериев, позволяющих признать тот или иной штамм госпитальным, не существует. Антибиотикорезистентность является важным, но необязательным признаком.
При попадании в стационар происходит неизбежный контакт пациента с госпитальными штаммами бактерий. При этом, по мере удлинения сроков пребывания в лечебном учреждении, возрастает вероятность замены собственной микрофлоры пациента госпитальной, а соответственно и развития инфекций, вызванных госпитальной микрофлорой. Точно установить срок, в течение которого происходит колонизация нестерильных локусов пациента госпитальной микрофлорой, достаточно сложно, так как это определяется многими факторами (возраст, нахождение в палатах интенсивной терапии, тяжесть сопутствующей патологии, антибиотикотерапия или применение антибиотиков с профилактической целью). Соответственно так же сложно установить временной интервал — когда возникающую инфекцию следует считать госпитальной. В большинстве случаев инфекция считается таковой при проявлении клинической симптоматики через 48 и более часов от момента госпитализации пациента.
Оценить частоту госпитальных инфекций в нашей стране сложно из-за отсутствия официальной регистрации данных заболеваний. По данным международных многоцентровых исследований, средняя частота госпитальных инфекций в лечебных учреждениях составляет 5–10% [1–3], а в отделениях реанимации и интенсивной терапии (ОРИТ) достигает 25–49% [4–6]. В значительной части исследований, посвященных этиологии госпитальных инфекций, отражена ситуация в тех стационарах, в которых выполнялись данные работы. Поэтому их результаты могут быть экстраполированы на другие учреждения лишь с большой долей условности. Даже многоцентровые исследования не могут считаться исчерпывающими, хотя и являются наиболее репрезентативными.
Сходные результаты, касающиеся этиологической структуры инфекций, были получены в другом исследовании [4], в ходе которого также было установлено, что большинство пациентов, находящихся в ОРИТ (72,9%), получали антибиотики с лечебной или профилактической целью. Наиболее часто назначались аминогликозиды (37,2%), карбапенемы (31,4%), гликопептиды (23,3%), цефалоспорины (18,0%). Спектр применяемых препаратов косвенно подтверждает высокий уровень антибиотикорезистентности в ОРИТ.
Таким образом, в этиологической структуре наиболее частых форм госпитальных инфекций наибольшее значение имеют пять групп микроорганизмов, на долю которых приходится до 90% всех случаев заболеваний: Staphylococcus aureus; КНС, среди которых наибольшее значение имеют S. epidermidis и S. saprophyticus; энтерококки, прежде всего E. faecalis и E. faecium; Еnterobacteriaceae, среди которых доминируют E. coli, Klebsiella spp., Enterobacter spp., Proteus spp., Serratia spp.; группа неферментирующих бактерий, прежде всего P. aeruginosa и в меньшей степени Acinetobacter spp.
На основании первичной локализации очага инфекции можно судить о предполагаемой этиологии заболевания, что, безусловно, служит надежным ориентиром в выборе эмпирического режима антибактериальной терапии (табл. 1).
Сложности лечения госпитальных инфекций зависят от следующих факторов:
Кроме того, необоснованное, часто бессистемное применение антибиотиков ведет к быстрой селекции и распространению в рамках стационара устойчивых штаммов микроорганизмов.
Проведение рациональной антибактериальной терапии госпитальных инфекций невозможно без современных знаний об этиологической структуре инфекционных заболеваний и антибиотикорезистентности их возбудителей. На практике это означает необходимость выявления микробиологическими методами этиологического агента инфекции и оценки его антибиотикочувствительности. Только после этого речь может идти о выборе оптимального антибактериального препарата.
Однако в практической медицине ситуация не так проста, и даже самые современные микробиологические методики часто не в состоянии дать клиницисту быстрый ответ или даже вообще уточнить возбудителя заболевания. В этом случае на помощь приходят знания о наиболее вероятных этиологических агентах конкретных нозологических форм госпитальных инфекций (табл. 1), спектре природной активности антибиотиков и уровне приобретенной резистентности к ним в данном регионе и конкретном стационаре. Последнее представляется наиболее важным при планировании антибактериальной терапии госпитальных инфекций в стационаре, где отмечается наиболее высокий уровень приобретенной резистентности, а недостаточная оснащенность микробиологических лабораторий и низкий уровень стандартизации исследований по оценке антибиотикочувствительности не позволяют сформировать реальное представление об эпидемиологической ситуации в медицинском учреждении и разработать взвешенные рекомендации по лечению.
Из наиболее распространенных в стационарах нашей страны механизмов антибиотикорезистентности следует выделить следующие, имеющие наибольшее практическое значение.
Учитывая указанные сложности лечения госпитальных инфекций (тяжесть состояния пациентов, часто полимикробный характер инфекции, возможность выделения при нозокомиальных инфекциях возбудителей со множественной устойчивостью к антибактериальным средствам), необходимо сформулировать следующие принципы рационального применения антибиотиков в стационаре.
Выбор антибактериального препарата может осуществляться на основании установленной этиологии заболевания и уточненной чувствительности возбудителя к антибиотикам — такую терапию определяют как этиотропную. В других ситуациях, когда возбудитель не определен, препарат назначается эмпирически. В последнем случае выбор антибиотика основывается на вероятном спектре микроорганизмов, вызывающих инфекцию определенной локализации, и знании основных тенденций антибиотикорезистентности наиболее вероятных возбудителей. Понятно, что в клинической практике до уточнения этиологии заболевания эмпирический подход используется наиболее часто.
При тяжелых инфекциях принципиально важно назначение уже на первом этапе лечения адекватного режима антибактериальной терапии, что подразумевает применение эмпирической терапии с максимально полным охватом всех потенциальных возбудителей инфекции данной локализации. Этот принцип стартовой эмпирической терапии, проводимой в полном объеме, особенно актуален при лечении таких инфекций, как НПивл, перитонит, сепсис, так как установлено, что в случае неадекватной стартовой терапии достоверно увеличивается риск летального исхода [8–10]. По нашим данным [11], в случае неадекватного выбора стартовой эмпирической терапии НПивл риск летального исхода увеличивается в 3 раза.
Адекватная эмпирическая антибактериальная терапия должна отвечать следующим требованиям.
Рекомендации по эмпирическому назначению антибактериальных препаратов для лечения госпитальных инфекций во всех случаях будут иметь очень условный характер, так как они не учитывают локальные данные по уровню антибиотикорезистентности в каждом конкретном медицинском учреждении. Поэтому в представленных ниже рекомендациях лишь оговаривается перечень антибиотиков, потенциально наиболее эффективных при конкретных инфекциях с учетом глобальных тенденций и состояния антибиотикорезистентности в стране, причем в связи с этим препараты перечисляются в алфавитном порядке. В лечебных программах приведенные режимы антибактериальной терапии разделены на две группы — оптимальные средства и альтернативные средства.
Под оптимальными средствами подразумеваются режимы антибактериальной терапии, применение которых, по мнению автора и с позиций доказательной медицины, позволяет с наибольшей долей вероятности достичь клинического эффекта. При этом также учитывался принцип разумной достаточности, т. е. по возможности в качестве средств выбора рекомендовались антибиотики с наиболее узким спектром антимикробной активности.
При составлении представленных рекомендаций авторы также принимали во внимание ряд документов, опубликованных в последние годы [12–15].
Антибактериальная терапия проводится до достижения стойкой положительной динамики состояния пациента и исчезновения основных симптомов инфекции. В связи с отсутствием патогномоничных признаков бактериальной инфекции абсолютные критерии прекращения антибактериальной терапии установить сложно. Обычно вопрос о прекращении антибиотикотерапии решается индивидуально, на основании комплексной оценки динамики состояния пациента. В общем виде критерии достаточности антибактериальной терапии могут быть представлены следующим образом:
Обычные сроки антибактериальной терапии госпитальных инфекций различной локализации составляют от 5 до 10 дней. Более длительная антибиотикотерапия не желательна из-за развития возможных осложнений лечения, риска селекции резистентных штаммов и развития суперинфекции. При отсутствии стойкого клинико-лабораторного ответа на адекватную антибактериальную терапию в течение 5–7 дней необходимо проведение дополнительного обследования (УЗИ, КТ и др.) для выявления осложнений или очага инфекции другой локализации.
В определенных клинических ситуациях требуются более длительные режимы антибактериальной терапии. Обычно такой подход рекомендуется для инфекций, локализующихся в органах и тканях, в которых терапевтические концентрации антибиотиков труднодостижимы и, следовательно, имеется более высокий риск персистирования возбудителей и рецидивов инфекции. Это относится прежде всего к остеомиелиту, инфекционному эндокардиту, вторичному гнойному менингиту. Кроме того, при инфекциях, вызванных S. aureus, обычно также рекомендуют более длительные курсы антибактериальной терапии — 2–3 нед.
Представленные схемы антибактериальной терапии действенны в отношении наиболее характерных и часто встречающихся в медицинской практике госпитальных инфекций. Вместе с тем некоторые сложные клинические ситуации не рассматриваются в рамках данной статьи, так как с трудом поддаются стандартизации. В таких случаях вопрос о тактике лечения следует решать совместно со специалистом по антимикробной химиотерапии или клиническим фармакологом.
Литература
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Рациональная антибактериальная терапия инфекций респираторного тракта у детей в амбулаторной практике (клинические рекомендации)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Антимикробные средства относятся клекарственным препаратам, эффективность которых является наиболее очевидной. Внедрение антибиотиков вмедицинскую практику привело кснижению летальности при наиболее тяжелых ишироко распространенных инфекционных болезнях (пневмония, менингит, эндокардит, туберкулез идр.), атакже уменьшению заболеваемости некоторыми социально значимыми болезнями (ревматическая лихорадка).
Первоначальные успехи применения антибиотиков и связанные с этим фактом оптимизм и дальнейшие перспективы разработки новых антимикробных средств позволили ученым и клиницистам в и гг. высказать мнение о победе медицины над микробами и реальном устранении инфекционных болезней как значительного фактора общественной жизни человечества. Однако вскоре ситуация осложнилась появлением устойчивых к антибиотикам стафилококков и пневмококков, а впоследствии и грамотрицательных бактерий, причем особую остроту проблема приобрела в последние 5–10 лет, когда в лечебных учреждениях стали распространяться микроорганизмы, устойчивые ко многим, а иногда и ко всем антибиотикам. Такая ситуация заставила специалистов высказать опасение о приближении «постантибиотической эры».
Основное ограничение эффективности антимикробных препаратов — это способность микроорганизмов вырабатывать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения, средств стимуляции роста животных и птиц в сельском хозяйстве. Угроза формирования и распространения антибактериальной резистентности была осознана научным сообществом практически сразу после появления первых антибиотиков, однако в течение многих лет проблема решалась за счет разработки и внедрения новых препаратов, преодолевающих устойчивость.
Ситуация стала меняться к худшему с середины гг., когда в силу ряда экономических причин и фундаментальных биологических препятствий процесс разработки и внедрения в практическую медицину новых антимикробных препаратов замедлился, а процесс распространения резистентности ускорился за счет роста потребления этих препаратов, прежде всего за счет их доступности. Осознание угрозы резистентности нашло отражение в принятом ВОЗ в 2001 г. документе «Глобальная стратегия по сдерживанию устойчивости к противомикробным препаратам». В этом документе были предложены конкретные меры по сдерживанию антибактериальной резистентности на государственном уровне, а их реализацию было рекомендовано рассматривать как приоритет в деятельности национальных систем здравоохранения [1].
Однако в глобальном плане эти меры оказались недостаточными. Результаты различных эпидемиологических исследований документируют рост и распространение антибиотикорезистентных микроорганизмов как в стационарах, так и вне их [2–6]. Это объясняется тем, что формирование устойчивости микробов к антибиотикам — процесс многофакторный, причем многие его составляющие взаимосвязаны. Известно, что использование антибиотиков сопровождается селективным давлением на возбудителей заболевания, что ведет к росту их устойчивости к используемым антибиотикам и снижению их эффективности. Другим, гораздо более глобальным по последствиям феноменом, является формирование устойчивости не только у микробов — возбудителей инфекции, но и среди представителей сапрофитной микрофлоры, не являющихся этиологически значимыми. Этот феномен получил название «сопутствующий ущерб» (collateral damage) антибиотикотерапии. Таким образом, распространение антибиотикорезистентных возбудителей инфекций находится в прямой зависимости от количества назначаемых антибиотиков и широты их антимикробного спектра.
В глобальном плане наибольшее количество антимикробных препаратов назначается врачами первичного звена, прежде всего для лечения острых респираторных инфекций. Поэтому определяющими составляющими сдерживания антибиотикорезистентности являются ограничение потребления антибиотиков в амбулаторной практике и рационализация их использования. Комплекс мероприятий по рационализации применения антимикробных препаратов с целью повышения их эффективности и сдерживания антибиотикорезистентности был разработан экспертами Альянса клинических химиотерапевтов и микробиологов и опубликован в 2014 г. в виде рекомендаций по стратегии и тактике применения антимикробных препаратов в лечебных учреждениях первичного звена России [7, 8]. Ключевые положения по рациональному использованию антибиотиков у детей при инфекциях респираторного тракта, изложенные в указанных выше рекомендациях, представлены в настоящей публикации. При этом особое внимание обращается на общие положения, которые обозначены как 10 принципов рационального применения антимикробных средств в амбулаторной практике (табл. 1).
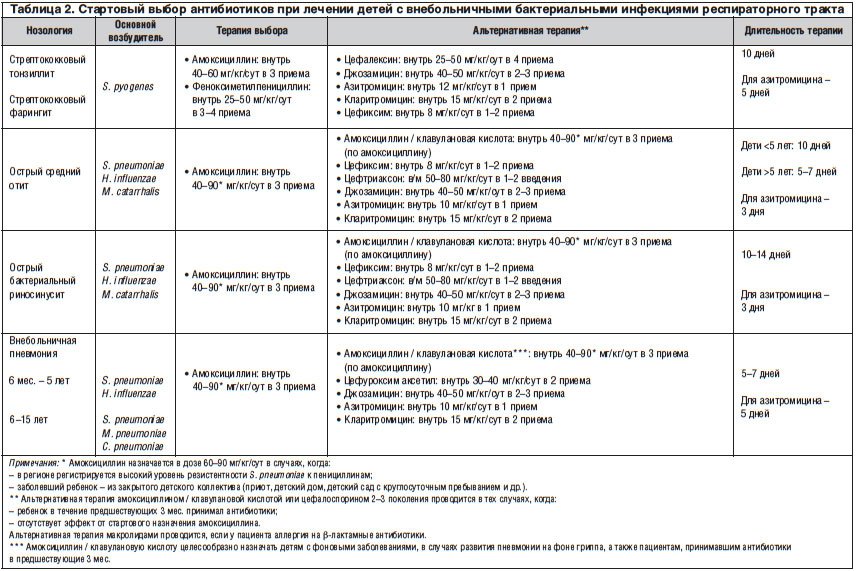
Данные об основных бактериальных возбудителях заболеваний органов дыхания у детей, а также тактика стартовой антибиотикотерапии приведены в таблице 2. Как видно из представленных данных, основным бактериальным возбудителем острого тонзиллофарингита является β-гемолитический стрептококк группы, А (БГСА) [7–10]. Однако провести дифференциальный диагноз между тонзиллофарингитами вирусной и бактериальной этиологии на основании исключительно клинических данных — весьма трудная задача. В связи с этим возрастает роль верификации. Подтверждение стрептококковой этиологии тонзиллофарингита считается обоснованием незамедлительного назначения антибактериальной терапии. Следует подчеркнуть, что БГСА продолжает сохранять высокую чувствительность к пенициллину и амоксициллину, что позволяет рекомендовать их в качестве препаратов выбора. При использовании пенициллинов в предшествующие месяцы или при рецидивирующем стрептококковом тонзиллофарингите показана альтернативная терапия амоксициллином / клавулановой кислотой или пероральными цефалоспоринами (цефалексин, цефиксим). Макролиды могут быть рекомендованы только при аллергии на β-лактамные антибиотики. Продолжительность антибактериальной терапии не должна быть меньше 10 дней (исключение — азитромицин), что является непременным условием для эрадикации возбудителя и предупреждения осложнений (табл. 2).
Основными бактериальными возбудителями острого среднего отита и синусита являются Streptococcus (S.) pneumoniaе, Haemophilus (Н.) influenzae и реже — Moraxella (М.) catarrhalis. Большинство штаммов указанных возбудителей сохраняют высокую чувствительность к аминопенициллинам (амоксициллин, амоксициллин / клавулановая кислота) и цефалоспоринам третьего поколения (цефтриаксон, цефиксим и др.), что и определяет их выбор в качестве препаратов выбора. Макролиды могут быть использованы только в том случае, если имеются указания на аллергию к β-лактамным антибиотикам (табл. 2). Особо следует отметить, что абсолютными показаниями для назначения антибиотиков при остром среднем отите являются гноетечение из уха и двустороннее поражение у детей в возрасте до 2 лет [7–10].
Среди бактериальных поражений респираторного тракта особое место занимают пневмонии. У детей дошкольного возраста наиболее частым бактериальным возбудителем внебольничных пневмоний является S. pneumoniaе, реже заболевание вызывается H. influenzaе [11–16]. Учитывая этиологические особенности пневмонии, препаратом первого ряда является амоксициллин. В том случае, когда в регионе регистрируется высокий уровень резистентности S. pneumoniae к пенициллинам, дозу амоксициллина необходимо повысить до 60–90 мг/кг/сут. Аналогичную тактику используют и тогда, когда заболевший ребенок находится в коллективе закрытого типа (табл. 2). У детей школьного возраста основным возбудителем внебольничных пневмоний также является S. рneumoniaе. Однако нередко этиологическими факторами пневмонии у детей указанной возрастной группы становятся Mycoplasma (М.) рneumoniae и Chlamydia (С.) рneumoniaе [11–16]. В связи с особенностями этиологии внебольничных пневмоний у детей школьного возраста стартовая антибиотикотерапия может проводиться не только аминопенициллинами или цефалоспоринами, но и макролидами — в случае подозрения на атипичную этиологию пневмонии (табл. 2).
Активное внедрение в педиатрическую практику принципов антибактериальной терапии, изложенных в представленных рекомендациях, позволит не только добиться положительного результата лечения и уменьшения частоты осложнений, но и существенно снизит риск селекции антибиотикоустойчивых штаммов.
Только для зарегистрированных пользователей
Показания к назначению антибактериальных препаратов в амбулаторно поликлинической практике

Поиск
Основные принципы и показания к антибиотикотерапии при лечении болезней органов дыхания у детей
В лекции представлены современные данные о значении антибиотикотерапии в клинической практике педиатра, показания, ошибки при назначении, классификация антимикробных препаратов. Отдельно изложены особенности применения антибиотиков при заболеваниях органов дыхания у детей.
Underlying principles and indications to antibiotic therapy аt treatment diseases of respiratory apparatus at children.
At lecture modern data about value antibiotic therapy in clinical practice of the pediatrist, the indication, a mistake at purpose, classification of antimicrobic preparations are presented. Features of application of antibiotics at diseases of respiratory apparatus at children are separately stated.
В летописи истории мировой медицины особая страница отведена одному из великих открытий ХХ века, обеспечившему сохранение жизни сотням тысяч, миллионам больных, — получению антибактериальных препаратов. Современная медицина немыслима без антибактериальной терапии. Значение эры антибиотиков можно показать на конкретном примере, особенно понятном врачам- педиатрам: летальность от пневмонии детей до 3-х лет до применения антибиотиков составляла 30%, детей старше 3-х лет — 15%, летальность от крупозной пневмонии — 84,5%, она была почти абсолютно смертельным заболеванием. Применение современных антибиотиков обеспечивает возможность не допускать летальность от внебольничной пневмонии.
Однако несмотря на появление в арсенале врачей огромного перечня лекарственных средств, активных в отношении практически всех патогенных микроорганизмов, проблема антимикробной терапии остается принципиально важной и сложной и в текущем столетии. Во всем мире наблюдается совершенно объективный процесс — глобальный рост резистентности микроорганизмов к антимикробным препаратам. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием антимикробных средств, необоснованным назначением антибиотиков. По международной статистике до 64% и более назначение антибиотиков в стационарах необоснованно или нерационально. Естественный эволюционный процесс изменчивости возбудителей в неблагоприятных условиях жизнедеятельности, обусловленных повсеместным использованием антимикробных препаратов, привел к развитию множественных механизмов устойчивости микроорганизмов.
Выбор антибактериальных препаратов для лечения инфекционных процессов в педиатрической практике представляет значительные трудности в связи с низким уровнем этиологической расшифровки, меняющимися представлениями об эволюции и смене возбудителей ряда инфекционно- воспалительных заболеваний (инфекции верхних и нижних дыхательных путей, ЛОР-органов, органов мочевой системы, кишечные инфекции), ростом резистентности микроорганизмов. Имеют значение также недостаточные знания практикующих врачей об особенностях фармакокинетики, спектрах антимикробной активности и токсичности современных антибактериальных препаратов.
Назначение антибиотиков в практической работе врача в каждом конкретном случае требует клинического мышления, которое нельзя подменить шаблонным использованием стандартов. Основой клинического мышления являются теоретические знания и практический опыт. Лечение болезней органов дыхания представляется педиатру простым и обыденным делом — ведь это самая частая патология у детей.
Однако,прежде всего надо ответить на основной вопрос: показаны ли антибиотики данному больному, лечить или не лечить антибиотиками данный респираторный эпизод. Основное показание для назначения антибиотиков — микробное воспаление.
Одной из наиболее существенных ошибок является назначение антимикробных препаратов без соответствующих показаний, и в первую очередь, необоснованно частое их применение при вирусных инфекциях, что повышает риск развития устойчивой флоры и побочных явлений. Нерациональное использование антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
Накоплен большой клинический опыт, на основе которого выработаны объективные критерии диагностики бактериальных инфекций и оценки эффективности проводимой терапии. Четко установлено, что антибиотики при бактериальных инфекциях должны быть назначены как можно раньше: именно раннее назначение антибиотиков предупреждает развитие осложнений и обеспечивает благоприятный прогноз. Так, например, при пневмонии антибиотик должен быть назначен не позднее 4 часов с момента постановки диагноза. С этих позиций, если на практике у конкретного больного педиатр не имеет возможности исключить бактериальное заболевание, например, отит без отоскопии или пневмонию без рентгеновского исследования, учитывая тяжесть состояния больного, назначение антибиотика может быть оправдано. Если диагноз не подтвердился, препарат отменяют. Особенно усложняется выбор антибиотика в амбулаторных условиях, когда кроме медицинских проблем необходимо учитывать психологический фактор (комплаентность — готовность родителей выполнить назначенный курс лечения) и социальный фактор (стоимость препарата).
К сожалению, современная тенденция развития фармацевтической промышленности такова, что гарантий появления в ближайшее время новых групп антибактериальных препаратов нет. Высказывается мнение, что возможности в этой области практически исчерпаны (Сидоренко С.В., 2009).
На сегодняшний день одной из актуальных проблем современной медицины остается рациональная антибиотикотерапия, учитывая продолжающий рост резистентности возбудителей инфекционных заболеваний и резкое уменьшение количества новых антибиотиков.
Основные принципы антибактериальной терапии
При выборе антибактериальной терапии в практической работе необходимо сочетать решение тактических задач, к которым относится рациональный выбор антибактериального препарата с наибольшим терапевтическим и наименьшим токсическим воздействием, с решением стратегической задачи, которую определяют как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В настоящее время сформулированы классические принципы антибактериальной терапии:
· главный принцип — целенаправленное проведение, назначение антибактериального препарата в соответствии с чувствительностью возбудителя;
· антибиотик должен создавать терапевтическую концентрацию в очаге инфекции;
· выбор антибиотика с максимальной эффективностью и минимальной токсичностью должен сочетаться с наименьшей стоимостью лечения.
К основным критериям, лежащим в основе выбора антибактериальных препаратов у детей, относят активность воспаления, тяжесть течения болезни, предполагаемые бактериальные возбудители инфекции и их чувствительность к антибиотикам, побочные эффекты препаратов, возраст ребенка и переносимость им антибиотика.
Выбор препарата и пути его введения
При отсутствии данных о виде возбудителя у конкретного больного назначается стартовая эмпирическая терапия. Необходимо «вычислить» вероятного возбудителя болезни и его лекарственную чувствительность в данном регионе, учитывая возраст больного ребенка, условия инфицирования (внебольничная или госпитальная инфекция), клинические признаки заболевания. Быстрое наступление эффекта указывает на правильность выбора антибиотика. Препарат 1-го выбора используют в случаях, когда нет оснований думать о лекарственной устойчивости, в первую очередь, при внебольничной инфекции. Там, где устойчивость вероятна (внутрибольничная инфекция, предшествующая за 1-3 месяцев терапия антибиотиками, дети из ДДУ, интернатов), лечение следует начинать с препаратов 2-го выбора. Средства 3-его выбора (резервные) применяют в случаях выраженной полирезистентности в стационарах.
Для повышения эффективности лечения показано использование максимальных, а не «стандартных» доз (Таточенко В.К., 2008).
Современные антибиотики высокоэффективны в режиме монотерапии. Например, один антибиотик меропенем, из группы карбапенемов, у детей с тяжелой хирургической абдоминальной инфекцией обеспечивает такую же эффективность, более 90%, как и комбинированное назначение 3-х препаратов (цефотаксим, амикацин, метронидозол).
При наличии факторов риска неблагоприятного исхода лечение проводится по принципу деэскалационной терапии: начинается с применения антибиотиков с потенциально максимально широким спектром действия (карбапенемы, комбинация гликопептида или ингибиторзащищенного карбоксипенициллина или цефалоспорина III поколения с аминогликозидом) с последующим переходом на антибактериальные препараты более узкого антибактериального спектра.
Комбинацию препаратов в настоящее время рекомендуют применять для расширения антибактериального спектра при отсутствии данных о возбудителе и тяжелом течении процесса, в основном, не более 2-х препаратов: синергидный эффект дает сочетание β-лактамных антибиотиков с аминогликозидами или макролидами или фторхинолинами.
Выбор удобной лекарственной формы препарата — одна из ключевых проблем в педиатрии.
Увлечение парентеральными препаратами привело в свое время к «инъекционной эпидемии», например, при пневмонии требовалось 50-60 инъекций на курс лечения. Рекомендации о 4-, 6- и 8-кратном введении антибиотиков на заре их применения были связаны с использованием низких доз. В настоящее время используется 2-3-кратное введение β-лактамных антибиотиков, макролидов и 1-2-кратное — аминогликозидов. При сепсисе для постоянства концентрации антибиотика в крови показано 4-кратное или непрерывное капельное введение. Из парентеральных путей введения более приемлем внутривенный как менее травматичный при наличии периферического венозного катетера. Внутримышечный путь следует использовать лишь кратковременно и после наступления эффекта, через 1-2 дня нормальной температуры, при неосложненных инфекциях переходить на оральный прием аналогичного препарата (ступенчатая терапия).
Наименее травматичным является оральный путь введения препаратов. Среди оральных препаратов детские формы (сиропы, суспензии, порошки или гранулы для их приготовления) характеризуются не только хорошими вкусовыми свойствами, но и точностью дозировки.
Качественный «прорыв» в фармакокинетике антимикробных препаратов для перорального применения обеспечивают инновационные лекарственные формы солютаб (Ушкалова Е.К, 2007). Диспергируемые лекарственные препараты в виде раствора имеют более высокую биодоступность, равномерное нарастание концентрации действующего вещества в крови, минимальное воздействие на микрофлору кишечника за счет низкой остаточной концентрации. Благоприятные органолептические свойства повышают комплаентность. В России зарегистрировано 4 антибиотика в лекарственной форме солютаб: амоксициллин («Флемоксин Солютаб»), амоксициллин — клавуланат («Флемоклав Солютаб»), доксициклина моногидрат («Юнидокс Солютаб») и джозамицин («Вильпрофен Солютаб»).
Оценка эффекта и смена препарата
Продолжать лечение стартовым препаратом имеет смысл только при наступлении эффекта, который при острых заболеваниях наступает через 36-48 часов от его начала. Полный эффект — падение температуры ниже 38°С, улучшение общего состояния, появление аппетита, уменьшение клинических проявлений. Это указывает на чувствительность возбудителя к препарату и позволяет продолжить его прием. Отсутствие эффекта — сохранение фебрильной температуры при ухудшении состояния и/или нарастании патологических изменений в очаге и общих расстройств (одышки, токсикоза и др.). Требуется смена антибиотика.
Длительность терапии должна быть достаточной для подавления жизнедеятельности возбудителя, с тем, чтобы его инактивацию и элиминацию из организма осуществили иммунологические механизмы. При острой инфекции может оказаться достаточным продолжение лечения в течение 2-х дней после падения температуры, исчезновения болей и т.д.
Однако длительность терапии определяется не только непосредственным клиническим эффектом, но и необходимостью эрадикации возбудителя (полного уничтожения). При многих процессах оптимальная длительность лечения установлена экспериментально с учетом как непосредственного эффекта, так и риска развития клинического и/или бактериологического рецидива, например, при пневмонии — 7-10 дней.
Определена роль антибиотиков местного действия, в частности, в лечении респираторной инфекции у детей. Местная антибактериальная терапия обеспечивает непосредственное воздействие на очаг инфекции, создает оптимальную концентрацию препарата и не имеет системных побочных эффектов. Антибиотик фюзафюнжин («Биопарокс») имеет уникальный антимикробный спектр действия против большинства бактериальных возбудителей респираторного тракта, в том числе против атипичных возбудителей и грибов Candida, и на 1/3 снижает потребность в назначении системных антибиотиков.
При раннем назначении на 2-3 день ОРВИ детям из группы риска фюзафюнжин играет роль превентивной терапии, предупреждая бактериальную и грибковую суперинфекцию, в том числе и развитие пневмонии.
При выборе антимикробных препаратов необходимо учитывать не только характер возбудителя и его чувствительность к антибиотикам, но и факторы пациента. В педиатрии к факторам пациента относят возраст, учет аллергических проявлений, оценку функции почек и печени. Использование у детей некоторых препаратов из-за их токсичности запрещено: фторхинолонов — до 12 лет, тетрациклинов — до 8 лет. Больший объем внеклеточной жидкости ребенка требует использования больших, по сравнению со взрослыми, доз препаратов в расчете на 1 кг массы тела.
Из-за низкой клубочковой фильтрации, а также незрелости ферментативных систем печени новорожденным вводят меньшие суточные дозы большинства антибиотиков. У больных со сниженной клубочковой фильтрацией дозы препаратов, выводимых в основном почками, снижают путем удлинения интервалов между введениями и/или снижения разовых доз.
При нарушении функции печени не используют антибиотики, которые выводятся из организма в основном с желчью.
Все антибиотики потенциально способны вызвать побочные эффекты. Аллергические реакции чаще встречаются в виде сыпи при нерациональном использовании антибиотиков у больных без бактериальных инфекций. При микробных процессах, в отличие от вирусного заболевания, происходит выброс цАМФ, цГМФ и других медиаторов, препятствующих реализации аллергической реакции (Таточенко В.К., 2007).
При коротких курсах антибиотиков применять биопрепараты и противогрибковые средства нет смысла, так как клинически выраженный дисбактериоз (псевдомембранозный колит) и усиление роста дрожжевых грибков развиваются редко (при длительном применении комбинации препаратов широкого спектра действия). Исключение составляют дети первого месяца жизни и больные с иммунодефицитными состояниями.
Одним из важнейших аргументов против профилактического использования антибиотиков является щадящее отношение к условнопатогенной аутофлоре, которая в физиологических условиях препятствует колонизации, в частности дыхательных путей, патогенной флорой и развитию антибиотик-ассоциированный диареи.
Помимо риска побочных эффектов и развития резистентности микроорганизмов в связи с широким применением антибиотиков становится все более очевидным их влияние на развитие иммунной системы ребенка (Таточенко В.К.,2008г). Дети первых месяцев жизни склонны давать иммунный ответ преимущественно T-хелпер — 2-го типа (Th2), при котором снижена продукция γ- интерферона, интерлейкина 2, иммуноглобулина G и повышен синтез иммуноглобулина Е. Преобладание ответа Th2 у детей объясняет большую частоту у них аллергических проявлений. Созревание иммунной системы с развитием преимущественно ответа Th1-го типа происходит под влиянием внешних воздействий, в первую очередь микробных. Подавление размножения эндогенной микрофлоры антибиотиками, неоправданно применяемыми при каждом ОРВИ, может способствовать замедлению созревания ответа Тh1-го типа. Имеется ряд исследований, в которых раннее применение антибиотиков ассоциировалось с развитием бронхиальной астмы (гигиеническая теория).
Основные ошибки при проведении антибактериальной терапии
Неоправданное применение антибактериальных препаратов в тех ситуациях, когда их назначение не показано. Наиболее распространенная ошибка — назначение антибиотиков при ОРВИ. Ошибки могут быть обусловлены неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную инфекцию), так и стремлением предотвратить бактериальное осложнение ОРВИ. Системные антибиотики не предотвращают бактериальную суперинфекцию, более того способствуют селекции «агрессивной флоры».
Выделение грибов рода Candida из полости рта или мочевых путей пациентов при отсутствии симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.) является свидетельством бессимптомной колонизации и в большинстве случаев не требует противогрибковой терапии (Дворецкий Л.И., Яковлев С.В., 2003).
Неправильный выбор препарата.
При выборе препарата определяющим фактором является спектр природной активности антибиотика:
— β-лактамы имеют высокую активность против большинства основных
возбудителей, но не действуют на атипичные микробы;
— макролиды активны в отношении грамположительной флоры и атипичных
возбудителей, но имеют низкую активность против гемофильной палочки
— гентамицин — не имеет природной активности в отношении пневмококка;
— пероральные цефалоспорины III поколения (цефтибутен) имеют низкую
активность в отношении пневмококка.
Педиатрам также надо иметь ввиду препараты с эмбриотоксическим действием при приеме их во время беременности: тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол (бисептол), фторхинолоны, аминогликозиды. У беременных можно применять β-лактамы и макролиды.
Неадекватный режим дозирования.
Ошибки в выборе оптимальной дозы антибактериального средства могут заключаться в назначении как недостаточной, так и избыточной дозы препарата. Если доза антибиотика недостаточна и не создает в крови и тканях концентрацию, превышающую минимальную дозу для подавления основного возбудителя инфекции, что является условием эрадикации соответствующего возбудителя, то это не только может служить одной из причин неэффективности терапии, но и создает реальные предпосылки для формирования резистентности микробов.
Не всегда оправдано стремление врачей к обязательному назначению парентеральных антибиотиков, так как современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами.
Необусловленная или нерациональная комбинация антибиотиков.
В современной ситуации при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра действия, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет остается за монотерапией.
Комбинированная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов, увеличивается риск нежелательных реакций и стоимость лечения.
Основным показанием к комбинированной антибактериальной терапии является тяжелое течение заболевания и инфекция у иммунокомпрометированных больных (лечение цитостатиками, иммунодефицитные состояния), при которых имеется высокая вероятность ассоциации возбудителей.
Неправильные критерии оценки эффекта лечения.
Несвоевременная оценка неэффективности первоначального антибиотика затягивает назначение другого, более адекватного, что ведет к прогрессированию заболевания, развитию осложнений, удлиняет сроки лечения, повышает риск побочных реакций, способствует развитию антибиотикорезистентности, подрывает доверие родителей к лечащему врачу.
Отсутствие эффекта от первоначально назначенного антибиотика является дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от β-лактамных антибиотиков при бронхолегочной патологии позволяет предполагать атипичную этиологию заболевания, с учетом, разумеется, других клинических признаков.
Необоснованная продолжительность антибактериальной терапии.
Необоснованно длительная антибактериальная терапия обусловлена прежде всего недостаточным пониманием цели самой антибактериальной терапии, которая сводится к эрадикации возбудителя или подавлению его дальнейшего роста, то есть направлена на подавление микробной агрессии.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками регрессирует медленнее и не требует продолжения антибактериальной терапии.
Перспективы антимикробной терапии
Проблема антибиотикотерапии, как и любой другой терапии, складывается из 2-х компонентов: проблемы эффективности и проблемы безопасности. В отличие от других лекарственных средств для антибактериальных препаратов эффективность не является постоянным показателем. Эффективность антибиотиков со временем снижается в результате формирования бактериями приобретенной резистентности. Рост резистентности имеет глобальный характер, происходит во всем мире. Глобальные тенденции имеют две полярных ситуации: Юг Европы, частично Северная Америка, Юго-восточная Азия имеют резко выраженную резистентность респираторных патогенов, на другом полюсе находятся страны Северной Европы, где резистентность респираторных патогенов практически отсутствует. Россия по уровню резистентности ближе к этим странам: эффективность β-лактамных антибиотиков по прогнозам на ближайшие 5-7 лет будет сохраняться. Группа β-лактамов и прежде всего амоксициллин сохраняет до сегодняшнего дня клиническую эффективность, несмотря на резистентность пневмококков.
Необходимо учитывать, что микробиологическая чувствительность/устойчивость абсолютно не равна клинической чувствительности/устойчивости. Европейский комитет по оценке чувствительности разделяет микробиологические критерии (стабильный видовой признак микроорганизма) и клинически ориентированные критерии чувствительности, связанные с прогнозом эффективности терапии — Сидоренко С.В., 2008).
В настоящее время разработана рациональная теория, позволяющая четко разделить эти критерии. Она связана с появлением такого понятия, как «предикторы эффективности антибактериальной терапии», представляющие собой интегральные параметры, которые устанавливают связь между фармакокинетикой антибиотиков и их антибактериальной активностью. Для β-лактамов и макролидов таким предиктором является формула Т>МПК, где Т- время, в течение которого концентрация антибиотика в крови превышает МПК (минимальную подавляющую концентрацию), выраженное в процентах от интервала дозирования. При величине этого параметра 40-50% наблюдают эрадикацию патогена из очага инфекции.
К сожалению, 100% эффективности антибактериальной терапии не бывает, как бы хорошо не обеспечивались фармакодинамические параметры. Установлено, что эффективность антибиотиков может быть ограничена за счет образования структуры «биопленки» и существования в любой бактериальной популяции «клеток-персистеров». Клетки-персистеры сохраняют жизнеспособность в присутствии антибактериальных препаратов и после удаления препарата возобновляют свой рост.
Биопленки — это полимикробные фиксированные сообщества микроорганизмов в синтезированном ими полимерном матриксе, адгезированные в виде тонкого слоя к органической или неорганической поверхности. Биопленки, основной фенотип почти всех бактерий, усиливают защиту от фагоцитоза, УФО, вирусов и деградации, а также от антибиотиков и факторов иммунной защиты организма. В частности, биопленки способны выдерживать концентрации антибиотиков в 100-1000 раз больше, чем плавающие клетки (Вознесенский Н.А., 2008).
Традиционные бактериологические методы при выделении чистой культуры определяют лишь около 1% клеток из множества штаммов, присутствующих в составе биопленки. Более того, эти методы не выявляют те бактерии в составе биопленки, которые являются жизнеспособными, но не культивируются, в результате делается ошибочное заключение о «стерильном воспалении» или вирусной инфекции (например, при среднем отите).
Формирование биопленок подтверждается визуально методом сканирующей электронной микроскопии. Идентифицировать микроорганизмы в составе биопленок позволяют современные молекулярные методы (электрофорез в геле, жидкостная хроматография, ПЦР и др.).
Все новые данные свидетельствуют о существовании биопленок при хронических инфекциях. В частности, доказана ведущая роль биопленок в формировании хронических синуситов и аденотонзиллярной патологии, что требует новых подходов к диагностике и лечению.
Биопленки должны стать терапевтической мишенью при хронических инфекциях. Способность разрушать даже уже сформированные биопленки обнаружена у муколитика N-ацетилцистеина, при этом значительно усиливается бактерицидная активность антибиотиков, в частности фосфомицина, тиамфеникола (Perez — Giraldo C. аt al., 1987; Marchese A. аt al, 2003; Olofsson A.C. аt al, 2003; цитир. по Н.А. Вознесенскому, 2008).
В течение ближайших 5-ти лет прогнозируется большой переворот, рождение «новой микробиологии». Прежде всего, это внедрение в практические лаборатории методов быстрой этиологической диагностики, обеспечивающих возможность получать микробиологический диагноз в день обращения.
Классификация антимикробных препаратов
(Яковлев С.В., Яковлев В.П., 2009)
— Природные пенициллины: бензилпенициллин (пенициллин G), прокаинпенициллин (новокаиновая соль пенициллина G), бензатинпенициллин (бициллин), феноксиметилпенициллин (пенициллин V).
— Пенициллины, резистентные к пенициллиназе: диклоксациллин, клоксациллин, оксациллин.
— Аминопенициллины: амоксициллин, ампициллин.
— Карбоксипенициллины: карбенициллин, тикарциллин.
— Уреидопенициллины: азлоциллин, пиперациллин.
— Цефалоспорины I поколения: парентеральный цефазолин; пероральные цефадроксил, цефалексин.
— Цефалоспорины II поколения: парентеральные цефамандол, цефокситин*, цефотетан*, цефуроксим; пероральные цефаклор, цефуроксим аксетил.
— Цефалоспорины III поколения: парентеральные цефоперазон,** цефотаксим,цефтазидим,** цефтриаксон; пероральные цефиксим, цефподоксим проксетил, цефтибутен.
— Цефалоспорины IV поколения: парентеральный цефепим**.
— Цефалоспорины V поколения***: парентеральный цефтобипрол.
* Карбапенемы: дорипенем, имипенем, меропенем, эртапенем.
Комбинированные препараты: амоксициллин/ клавуланат, амоксициллин/ сульбактам, ампициллин/ сульбактам, пиперациллин/ тазобактам, тикарциллин/ клавуланат, цефоперазон/ сульбактам**.
*Аминогликозиды: амикацин, гентамицин, канамицин, нетилмицин, стрептомицин, тобрамицин.
* Тетрациклины: доксициклин, тетрациклин.
* Макролиды: азитромицин, джозамицин, кларитромицин, мидекамицин, олеандомицин, рокситромицин, спирамицин, эритромицин.
*Линкозамины: клиндамицин, линкомицин.
* Гликопептиды: ванкомицин, тейкопланин.
* Полимиксины: полимиксин В.
* Сульфаниламиды: препараты короткого действия: сульфадимидин;
препараты среднего действия: сульфадиметоксин, сульфаметоксазол; препараты длительного действия: сульфален.
— Хинолоны: налидиксовая кислота, пипемидиевая кислота.
— Фторхинолоны: ранние (I поколения): ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин; новые (II поколение): гатифлоксацин, гемифлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин.
*Нитрофураны: нитрофурантоин, фуразидин, фуразолидон.
*Нитромидазолы: метронидазол, орнидазол, секнидазол, тинидазол.
*Производные хиноксалина: диоксидин, хиноксидин.
*Сульфаниламиды с триметопримом: ко-тримоксазол.
*Другие антимикробные препараты: спектиномицин, фосфомицин, фузидиевая кислота, хлорамфеникол.
*Противотуберкулезные средства: изониазид, метазид, парааминосалициловая кислота (ПАСК), пиразинамид, рифабутин, рифампицин, стрептомицин, фтивазид, циклосерин, этамбутол, этионамид.
*Противогрибковые средства: амфотерицин В, амфотерицин В липосомальный, анидулафунгин, вориконазол, итраконазол, каспофунгин, кетоконазол, клотримазол, миконазол, нистатин, флуконазол, флуцитозин, эконазол.
*Противовирусные средства: амантадин, ацикловир, валацикловир, ганцикловир, идоксуридин, ламивудин, рибавирин, фамцикловир, озельтамивир, занамивир, отмантадин, арбидол, интерфероны.
** Цефалоспорины, активные в отношении P. aeruqinosa.
*** Цефалоспорины, активные в отношении MRSA (метициллинрезистентный золотистый стафилококк).
Показания к назначению антибиотиков при болезнях
органов дыхания у детей (БОД).
В настоящее время в качестве антибактериальных препаратов первого выбора при БОД наиболее широко в педиатрической практике используются три группы антибиотиков, так называемые препараты «золотого стандарта»: β-лактамные антибиотики (ингибиторзащищенные пенициллины, цефалоспорины II-III поколения) и макролиды.
Антибиотики эффективны только при бактериальных инфекциях. Показанием к назначению антибиотиков являются общепринятые критерии наличия микробного процесса: длительная (более 3-х дней) лихорадка, выраженная интоксикация, наличие соответствующей клинической картины и гематологических сдвигов, обусловленных бактериальной или атипичной флорой.
| Признаки вероятной бактериальной инфекции | ||
| Признак | Возможная инфекция | Подтверждение |
| Боль в горле, налеты | Стрептококковая(группа А) ангина | Микробиологическое исследование мазка |
| Боль в ухе | Острый (средний) отит | Отоскопия |
| Увеличение лимфоузла | Лимфаденит | Посев из зева |
| Заложенность носа в течение 2-х недель и более | Синусит | Рентгенография, УЗИ придаточных пазух носа |
| Одышка без обструкции | Пневмония | Рентгенография грудной клетки |
| Асимметрия хрипов при аускультации | Пневмония, микоплазмоз | Рентгенография грудной клетки |
| Втяжение грудной клетки | Пневмония | Рентгенография грудной клетки |
| Тяжелый токсикоз | Сепсис, пневмония | Обследование после госпитализации |
| Лейкоцитоз (12000) и/или > 5% палочкоядерных нейтрофилов и/или СОЭ > 20мм/час | Пневмония или бактериальная инфекция другой локализации (в т.ч. мочевыводящих путей у детей) | Рентгенография, анализ мочи, наблюдение |
При неосложненных ОРВИ системные антибиотики не показаны. Однако рекомендуется подумать о назначении антибиотика ребенку с неосложненной ОРВИ по следующим показаниям: при рецидивирующем отите в анамнезе; у детей до 6 месяцев с неблагоприятным преморбидным фоном (выраженная гипотрофия, рахит, порок развития и др.), а также при наличии клинических признаков иммунодефицита.
Одновременное применение антибиотика и короткого курса в течение 4-х дней иммуномодулятора бактериального происхождения рибомунила в остром периоде ОРЗ может сокращать продолжительность и выраженность лихорадочного состояния, что уменьшает продолжительность антибактериальной терапии и снижает частоту побочных эффектов антибиотиков (Таточенко В.К., 2004).
Пневмония — острое инфекционное заболевание легких преимущественно бактериальной этиологии, характеризуется очаговым поражением респираторных отделов с внутриальвеолярной эксудацией (Проект классификации клинических форм бронхолегочных заболеваний у детей, 2008.). Пневмония является одним из наиболее частых и серьезных заболеваний легких у детей. В последние годы дети в России стали чаще болеть пневмонией. В то же время, начиная с середины 90 годов ХХ столетия, летальность детей при данной патологии в РФ существенно (в 2,1 раза по сравнению с 1991 годом) снизилась. В настоящее время смертность детей при пневмонии в нашей стране находится на стабильно низком уровне, не превышающем 0,52-0,64% (МЗ РФ, 2003), причем 96,1% всех летальных случаев приходится на ранний возраст (Коровина Н.А. и др., 2007).
Алгоритм диагностики острой пневмонии
| Бронхит | Критерии диагностики | Пневмония |
| I. Синдром общих нарушений | ||
| Не более 3-х дней Не характерна | Лихорадка Общая интоксикация | Длительный фебрилитет (более 3-х дней) Характерна потеря аппетита Бледность кожи и слизистых Адинамия или беспокойство |
| II. Синдром дыхательных расстройств | ||
| Одышка экспираторная при обструкции бронхов | Одышка смешанного типа Цианоз носогубного треугольника | |
| III. Физикальные изменения в легких | ||
| Коробочковый оттенок перкуторного звука Рассеянные сухие и разнокалиберные влажные хрипы | Локальное укорочение перкуторного звука Локальные влажные мелкопузырчатые хрипы или крепитация | |
| IV. Rо- логическая картина | ||
| Перибронхит Инфильтрация мелкоочаговая 5мм Долевая | ||
| V. Лабораторные критерии — «воспалительные» сдвиги в клиническом анализе крови | ||
| Не характерны СОЭ повышена | Лейкоцитоз СОЭ ускорена | |
| VI. Осложнения: легочно-сердечная недостаточность | ||
| Только при астматическом статусе | Характерна | |
Выбор стартовой этиотропной терапии при внебольничной пневмонии детей первых 2-х месяцев жизни
| Заболевание | Вероятный возбудитель | Препарат выбора | Альтернативный препарат |
| Пневмония нетяжелая, неосложненная | Стафилакокки, пневмококки | Амоксициллин, амоксициллин/ клавуланат, цефуроксим, цефазолин | Макролиды |
| Хламидия трахоматис, микоплазма гоминис, уреплазма уреалитика | Макролиды | ||
| Пневмония тяжелая, отягощенная наличием модифицирующих факторов | Стафилококки, энтеробактерии, пневмококки | Амоксициллин/ Клавуланат, цефотаксим, цефтриаксон, (монотерапия или в комбинации с аминогликозидами) | Оксациллин + аминогликозид, ванкомицин, карбапенемы |
| Пневмония с высоким риском неблагоприятного исхода | Стафилококки, клебсиеллы, кишечная палочка, пневмококк | Карбапенемы | Ванкомицин + аминогликозид |
Выбор стартовой этиотропной терапии при внебольничной пневмонии у детей старше 2-х месяцев
| Заболевание | Вероятный возбудитель | Препарат выбора | Альтернативный препарат |
| Пневмония нетяжелая, неосложненная | Пневмококк, палочка | Амоксициллин, амоксициллин/ клавуланат | Цефуроксим, макролиды |
| Микоплазма, хламидия | Макролиды | ||
| Пневмония тяжелая, отягощенная модифицирующими факторами | Пневмококк, гемофильная палочка, клебсиелла пневмонии | Амоксициллин/ клавуланат, цефтриаксон, цефотаксим или цефуроксим + аминозликозид | Карбапенемы, гликопептиды |
| Пневмония с высоким риском неблагоприятного исхода | Пневмококк, гемофильная палочка, клебсиелла пневмонии | Карбапенемы | Гликопептиды + аминогликозиды |
При остром бронхите у детей показаниями для назначений антибиотиков системного действия являются факторы, указывающие на возможность неблагоприятного течения заболевание (Самсыгина Г.А., 2004):
· наличие выраженных симптомов интоксикации и длительной гипертермии (более 3-х дней), особенно в группе детей раннего возраста;
· у детей всех возрастных групп — наличие неблагоприятного преморбидного фона, способного создать реальную угрозу развития пневмонии (так называемые модифицирующие факторы);
· наличие клинических признаков, указывающих на бактериальную природу воспалительного процесса (слизисто-гнойный и гнойный характер мокроты) в совокупности с выраженной интоксикацией;
· затяжное течение заболевания (свыше 2-х недель), особенно при подозрении на внутриклеточную природу возбудителя;
· клиническая и клинико-рентгенологическая картина бронхиолита, летальность от которого в детском возрасте достигает 3%, также рассматривается как показание к назначению антибиотиков;
· наличие выраженного трудно поддающегося терапии бронхообструктивного синдрома у детей раннего возраста.
К модифицирующим факторам, то есть утяжеляющим течение бронхита независимо от его этиологии и создающим риск развития пневмонии, необходимо отнести:
· недоношенность, особенно среди детей первого полугодия жизни;
· гипотрофию II и II степени;
· наличие врожденных аномалий развития, в первую очередь врожденных пороков сердца и сосудов, и других наследственных и врожденных заболеваний, создающих предпосылки для неблагоприятного течения болезни (например, спинальная аминотрофия Гофмана и т.п.).
Выбор стартовой этиотропной терапии при бронхитах у детей
| Основные возбудители | Антибиотики выбора | Альтернативные антибиотики |
| Пневмококк, моракселла катарралис | Амоксициллин/ клавуланат или «новые макролиды» (азитромицин, кларитромицин) внутрь | Цефалоспорины II — III поколения внутрь парентерально |
| Гемофильная палочка, устойчивая к бета- лактамам | Амоксициллин/ клавуланат | Комбинированная терапия: Амоксициллин/ клавуланат + макролид или цефалоспорин II — III поколения + макролид |
| Стафилококк | Цефалоспорины II — III поколения внутрь парентерально |
Выбор стартовой этиотропной терапии клинических форм бактериальных инфекций верхних отделов дыхательных путей у детей
| Клинические варианты | Основные возбудители | Препараты выбора | Альтернативные препараты |
| Фарингит | Str. Pyogenes гр.А | Пенициллин | Макролиды |
| Острый тонзиллит | Str. Pyogenes гр.А | Пенициллин Цефалоспорины I поколения | Макролиды Линкозамины |
| Рецидивирующий тонзиллофарингит | Пневмококк Стафилококки | Амоксициллин/ клавуланат | |
| Синусит острый | Пневмококк Гемофильная палочка Моракселла катарралис | Амоксициллин Амоксициллин/ клавуланат | Цефуроксим Цефаклор Азитромицин Кларитромицин |
| Синусит хронический | Пневмококк Гемофильная палочка Золотистый стафилококк Анаэробы | Амоксициллин/ клавуланат +/- аминогликозиды | Цефалоспорины III поколения (цефтриаксон) Флуконазол |
| Острый средний отит | Пневмококк Гемофильная палочка | Амоксициллин Амоксициллин/ клавуланат Азитромицин | Цефалоспорины II или III поколения |
| Ларингит | Str. Pyogenes гр.А Стафилококки | Азитромицин Цефуроксим аксетил | Цефалоспорины III поколения (цефтриаксон) |
| Эпиглоттит | Пневмококк Гемофильная палочка Менингококк | Цефалоспорины III поколения (цефтриаксон) | Карбапенемы |
Несмотря на большой арсенал антибактериальных препаратов, разработанных и внедренных в лечебную практику, лечение острых респираторных инфекций продолжает оставаться одной из самых актуальных проблем педиатрии. Среди причин недостаточной эффективности антибактериальной терапии БОД у детей можно выделить следующие:
· рост резистентности микроорганизмов к традиционным антибактериальным препаратам, используемым в педиатрии (пенициллины, макролиды);
· увеличение числа детей с дефектами факторов защиты, не способных к полной элиминации возбудителя из организма в процессе лечения и являющихся потенциальным источником распространения резистентных патогенных штаммов (особенно в детских коллективах);
· возникновение новых видов возбудителей и их ассоциацией;
· сложность выбора антибактериального препарата из-за ограниченного круга антибактериальных препаратов, разрешенных к применению в педиатрической практике.
В.М. Давыдова
Казанская государственная медицинская академия
Давыдова Валентина Михайловна — кандидат медицинских наук, доцент кафедры педиатрии с курсом поликлинической педиатрии
1. Болезни органов дыхания у детей: Руководство для врачей.Под ред.С.В. Рачинского, В.К. Таточенко М.: Медицина, 1987.
2. Вознесенский Н.А. Биопленки- терапевтическая мишень при хронических инфекциях. АтмосферА. Пульмонология и аллергология, 2008. С. 43.
3. Гусель В.А., Маркова И.В. Справочник педиатра по клинической фармакологии. Л.: Медицина, 1989. С. 156-160.
4. Дворецкий Л.И., Яковлев С.В. Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике. Лечащий Врач 2003; 8: 1-8.
5. Ключников С.О., Зайцева О.В. и др. Острые респираторные заболевания у детей. Пособие для врачей. М., 2009. 35с.
6. Котлуков В.К., Кузменко Л.Г. Рациональная антибиотикотерапия инфекций дыхательных путей и ЛОР- органов у детей в амбулаторной практике педиатра. Педиатрия 2008; 87: 6: 110-115.
7. Острые респираторные заболевания у детей: лечение и профилактика. Научно-практическая программа Союза педиатров России — М.: Международный Фонд охраны здоровья матери и ребенка, 2004.
8. Практическая пульмонология детского возраста (справочник- 3-е издание). Под ред. В.К. Таточенко. М., 2006.
9. Практическое руководство по антиинфекционной химиотерапии /Под ред. Л.С.Страчунского, Ю.Б.Белоусова, С.Н.Козлова. Смоленск: МАКМАХ. — 2007.
10. Пульмонология детского возраста: Проблемы и решения. Под ред.Ю.Л.Мизерницкого, А.Д.Царегородцева. Вып.4., М., 2007. 206с.
11. Рациональная фармакотерапия в педиатрии. Под ред. А.А. Баранова, В.В. Володина, Г.А. Самсыгина. М.: Литтерра. 2007.
12. Самсыгина Г.А. и др. Антибиотикотерапия при острых респираторных заболеваниях у детей. Педиатрия. Consilium medicum 2005; 2 4-8.
13. Сидоренко С.В. Перспективы антибиотикотерапии респираторных инфекций в России. Consilium medicum. «Медиа Медика», Экстравыпуск, 2009; 5-6, 21-22.
14. Страчунский Н.С., Козлов С.Н. Современная антимикробная химиотерапия. Руководство для врачей.М.:Боргес,2002.-436с.
15. Таточенко В.К. Антибиотико-и химиотерапия инфекций у детей. М., 2009. 253 с.
16. Ушкалова Е.К. Значение лекарственных форм для рациональной антибиотикотерапии. Лекарственная форма Солютаб. Врач 2007; 3: 1-4.
17. Яковлев С.В., Яковлев В.П. Современная антимикробная терапия в таблицах. Consilium medicum 2009: 11:4: 82.