первая помощь при гипоксии головного мозга
Гипоксия: последствия, причины, признаки, симптомы, лечение
Причины гипоксии
Признаки и симптомы гипоксии, механизмы защиты организма от гипоксии
Признаки гипоксии весьма разнообразны и почти всегда зависят от степени ее выраженности, длительности воздействия и причины возникновения. Мы приведем самые основные симптомы и объясним их причины развития.
Гипоксия бывает острой (развивается через несколько минут, часов) от начала воздействия причинного фактора или может быть хронической (развивается медленно, на протяжении нескольких месяцев или лет).
Острая гипоксия имеет более ярко выраженную клиническую картину и тяжелые быстро развивающиеся последствия для организма, которые могут быть необратимыми. Хроническая гипоксия т.к. развивается медленно, позволяет организму больного адаптироваться к ней, поэтому пациенты с тяжелой дыхательной недостаточностью на фоне хронических легочных заболеваний живут длительное время без драматических симптомов. В то же время хроническая гипоксия так же приводит к необратимым последствиям.
Основные механизмы защиты организма от гипоксии
1) Увеличение частоты дыхания, для усиления поступления кислорода к легким и его дальнейший транспорт кровью. Вначале дыхание частое и глубокое, однако, по мере истощения дыхательного центра становится редким и поверхностным.
2) Увеличение частоты сердечных сокращений, повышение артериального давления и увеличение сердечного выброса. Тем самым организм, испытывающий кислородный голод пытается «раздать» как можно больше и быстрее кислорода в ткани.
3) Выброс депонированной крови в кровоток и усиленное образование эритроцитов – для увеличения количества переносчиков кислорода.
4) Замедление функционирования некоторых тканей, органов и систем, с целью уменьшения потребления кислорода.
Вышеперечисленные механизмы при острой гипоксии краткосрочные быстро истощаются, что приводит к смерти пациента. При хронической гипоксии они способны длительно функционировать, компенсируя кислородный голод, но приносят постоянные страдания больному.
В первую очередь страдает центральная нервная система. Головной мозг всегда получает 20% всего кислорода организма, это т.н. «кислородный долг» организма, который объясняется колоссальной потребностью мозга в кислороде. К легким расстройствам при гипоксии мозга относят: головные боли, сонливость, заторможенность, быструю утомляемость, нарушение концентрации внимания. Тяжелые признаки гипоксии: дезориентация в пространстве, нарушения сознания вплоть до комы, отек головного мозга. Пациенты, страдающие хронической гипоксией, приобретают тяжелые расстройства личности связанные с т.н. гипоксической энцефалопатией.
Изменение формы ногтей и дистальных фаланг пальцев. При хронической гипоксии ногти утолщаются и приобретают округлую форму напоминающую «часовые стекла». Дистальные (ногтевые) фаланги пальцев утолщаются, придавая пальцам вид «барабанных палочек».
Диагностика гипоксии
Помимо характерного вышеописанного симптомокомплекса для диагностики гипоксии используют лабораторно-интрументальные методы исследования.
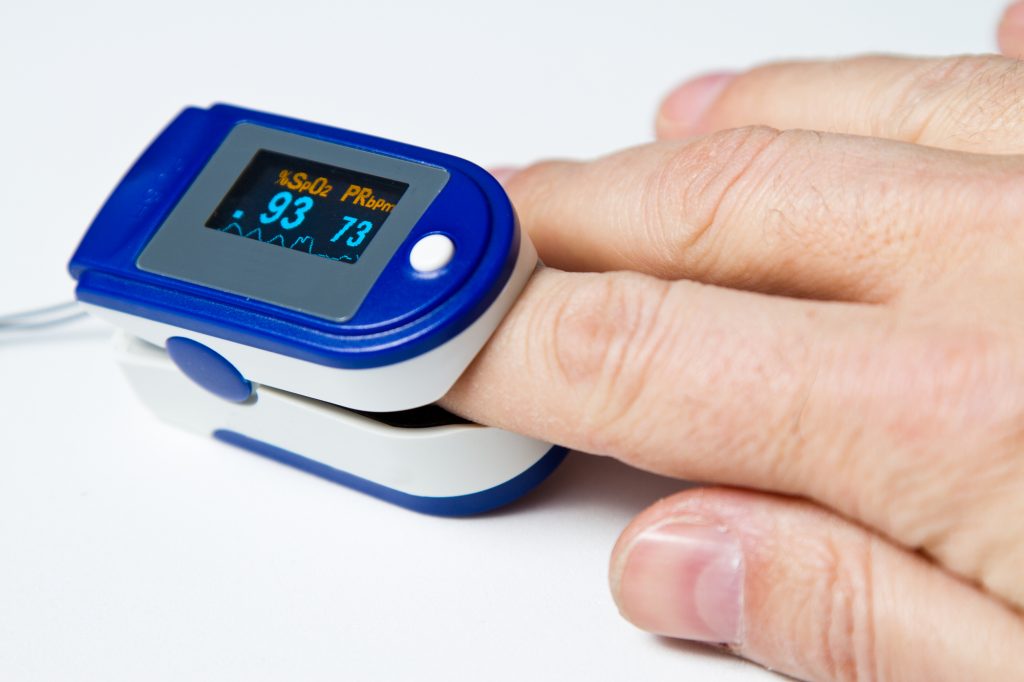
• Пульсоксиметрия – самый простой способ определения гипоксии. Достаточно одеть на палец пульсоксиметр и через несколько секунд будет определено насыщение (сатурация) крови кислородом. В норме этот показатель не ниже 95%.
• Исследование газового состава и кислотно-щелочного равновесия артериальной и венозной крови. Данный вид позволяет провести количественную оценку главенствующих показателей гомеостаза организма: парциальное давление кислорода, углекислого газа, pH – крови, состояние карбонатного и бикарбонатного буфера и т.д.
• Исследование газов выдыхаемого воздуха. Например капнография, СО-метрия и т.д.
Лечение гипоксии
Лечебные мероприятия должны быть направлены на устранение причины гипоксии, борьбу с недостатком кислорода, коррекцию изменений в системе гомеостаза.
Иногда для борьбы с гипоксией достаточно простого проветривания помещения или прогулки на свежем воздухе. В случаях гипоксии, которая стала следствием заболеваний легких, сердца, крови или отравлений – требуются более серьезные мероприятия.
• Гипоксическая (экзогенная) — применение кислородного оборудования (кислородные аппараты, кислородные боллончики, кислородные подушки и т.д.);
• Дыхательная (респираторная) — применение бронхорасширяющих препаратов, антигипоксантов, дыхательных аналептиков и т.д., использование концентраторов кислорода или централизованной подачи кислорода вплоть до искусственной вентиляции легких. При хронической дыхательной гипоксии лечение кислородом становится одним из главных компонентов;
• Гемическая (кровяная) — переливание крови, стимуляция кроветворения, лечение кислородом;
• Гистоксическая (тканевая) — антидоты при отравлении, искусственная вентиляция легких, препараты улучшающие утилизацию кислорода тканями, гипербарическая оксигенация;
Как видно из сказанного почти при всех видах гипоксии находит применение лечение кислородом: от дыхания смесью из кислородных баллончиков или концентратора кислорода до до искусственной вентиляции легких. Помимо этого для борьбы с гипоксией используют препараты позволяющие восстановить кислотно-щелочное равновесие в крови, нейро и кардиопротекторы.
Кислородные баллончики являются бюджетным и удобным средством лечения гипоксии. Они не требуют настройки, особых навыков обращения, обслуживания, их удобно брать с собой. Ниже представлена подборка наиболее популярных моделей кислородных баллончиков:
В таких случаях, неоспоримым преимуществом обладают кислородные концентраторы. Это аппараты, которые вырабатывают из окружающего воздуха обогащенную кислородом смесь для дыхания. Такая кислородотерапия компенсирует гипоксию, что приводит к уменьшению одышки и интоксикации:
Статью подготовил Гершевич Вадим Михайлович
(врач торакальный хирург, кандидат медицинских наук).
Остались вопросы? Позвоните нам сейчас по телефону бесплатной линии 8 (800) 100-75-76 и мы с радостью квалифицированно проконсультируем и ответим на все интересующие Вас вопросы.
Нарушение мозгового кровообращения
Диагностика головной боли – комплексное обследование
Кровоснабжение головного мозга – это его питание. Мозгу для нормального функционирования необходима высокая скорость клеточного метаболизма (обмена веществ), что требует отличной циркуляции крови, несущей кислород. Ведь именно мозг потребляет 25% поступающего при дыхании кислорода.
Причины ухудшения кровообращения головного мозга
При некоторых патологиях происходит стеноз (сужение) просвета сосуда или его обтурация (закупорка). В результате замедляется скорость кровотока, в отдельных участках мозга возникает ишемия (кислородное голодание ткани), приводящее к некрозу (омертвлению) ткани.
Факторами риска являются:
Симптомы ухудшения кровообращение головного мозга
Различают острое (ОНМК – инсульт) и хроническое (ХНМК – дисциркуляторная энцефалопатия) нарушение мозгового кровообращения (МК).
Для ОМНК характерны следующие симптомы:
При ХНМК развивается следующая симптоматика:
Последствия нарушения кровообращения головного мозга
Мозг – наиболее уязвимый к нехватке кислорода орган. Циркуляционный объем крови в головном мозге остается практически неизменным и составляет порядка 750 мл. Так как нервная ткань не способна сохранять кислород, его запаса хватает на 8–10 секунд. Когда клетки мозга лишены кровоснабжения, т. е. нет доступа жизненно важных питательных веществ и кислорода, они умирают – происходит инсульт.
Последствия инсульта могут варьировать в широких пределах в зависимости от участка головного мозга, серьезности нарушений, общего состояния здоровья человека.
Нарушения кровообращения головного мозга включают:
Они, как правило, являются результатом ранее существовавших сосудистых заболеваний, врожденной патологии или могут быть спровоцированы травмой.
Лечение и профилактика нарушений мозгового кровообращения
Инсульт – одна из ведущих причин смерти и наиболее распространенная причина инвалидности.
Профилактика инсульта включает:
Адекватная терапия нарушений мозгового кровообращения начинается с обследования и установления точной причины патологии. Нельзя заниматься самолечением и бессистемно сбивать давление – это нарушает скоординированную работу сердечно-сосудистой системы, повышает нагрузку на стенки сосудов, что приводит к образованию аневризм, стенозов и как следствие, нарушению почечной фильтрации, усугубляя тем самым течение гипертонической болезни, повышая риск инсультов и инфарктов. При нерегулярном и неправильно приеме гипотензивных средств, падает церебральное перфузионное давление, что вызывает закупорку кровеносных сосудов и гипоксию мозга. Присутствие малейших симптомов нарушения МК – повод незамедлительно обратиться к врачу.
К большому сожалению, на фоне постоянных стрессов, неправильного питания, несвоевременного обследования, бесконтрольного приема лекарственных средств, нарушение мозгового кровообращения стало поражать людей молодого возраста. Иногда, частые головные боли могут свидетельствовать о начале изменений в сосудах головного мозга, в связи, с чем прием обезболивающих средств может затруднять своевременную диагностику и приводить к осложнениям.
Начальное обследование кровоснабжения головного мозга должно включать:
Это обязательный перечень для базового исследования для определения рисков или степени нарушения мозгового кровообращения, но врач на основании полученных данных осмотра, анамнеза и результатов исследований может порекомендовать более глубокие обследования, вплоть до КТ и МРТ, для установки степени тяжести состояния, установки правильного диагноза и подбора лечебно-профилактических мероприятий.
Для более подробной консультации, осмотра и обследований обращайтесь к специалистам медицинского центра «Президент-Мед».
Длительная и ситуационная кислородотерапия на дому
Время чтения: 6 мин.
Что такое сатурация, почему при разных заболеваниях нормы сатурации будут различаться, в каких случаях кислородотерапия помогает справиться с одышкой, в каких нет, что такое ситуационная кислородотерапия? Об этом рассказывает врач-анестезиолог-реаниматолог, эксперт Центра паллиативной помощи ДЗМ Варвара Брусницына.
Что такое кислородотерапия и кому она показана
Кислородотерапия — это метод лечения, при котором пациент получает воздушную смесь с повышенным содержанием кислорода.
В составе воздуха, которым мы дышим, помимо прочих газов 21% кислорода. И такого содержания кислорода нам вполне хватает для жизни.
Но существует такое состояние, при котором организм нуждается в большей концентрации кислорода для обеспечения жизнедеятельности. Оно носит название синдром дыхательной недостаточности и возникает в трех случаях:
Первые два варианта еще называют кислородным голоданием, или гипоксией, или гипоксической дыхательной недостаточностью. А третий вариант — гиперкапнической дыхательной недостаточностью (от слов «гипер» — сверх, больше, и «капнос» — дым).
В чем же заключается опасность синдрома дыхательной недостаточности? При кислородном голодании организм всеми возможными способами пытается насытиться недостающим кислородом: мы чаще дышим (одышка), учащается пульс, возникает тревога, повышенная утомляемость. Чем более выражена гипоксия, тем сильнее будут проявляться вышеописанные симптомы. А при гиперкапнической дыхательной недостаточности избыточное количество углекислого газа будет отравлять организм.
Если не лечить дыхательную недостаточность, меняется химический состав крови, что ведет к патологическим и необратимым изменениям в деятельности внутренних органов. Поэтому целью кислородотерапии будет поддержание кислорода крови на должном уровне. Вывод: кислородотерапия применяется при первых двух типах дыхательной недостаточности.
А при третьем типе не показана. Давайте рассмотрим, почему. Что нужно для того, чтобы мы нормально выдыхали избыток СО2? Полноценный выдох. А при некоторых заболеваниях (например, при хронической обструктивной болезни легких) полноценный выдох затруднен тем, что просвет бронхов сужен, например, отеком, мокротой. Эти препятствия затрудняют выдох. И тогда человек начинает выдыхать с усилием. Но во время сна или когда он устает от этих усилий, углекислый газ скапливается в организме. Поэтому главная задача лечения при таком состоянии — выведение углекислого газа, а не подача кислорода (дополнительный кислород не решит проблему избытка углекислого газа). Эту проблему решает неинвазивная вентиляция легких.
Важно помнить, что у пациентов паллиативного профиля при ХОБЛ или нейромышечных заболеваниях дыхательная недостаточность бывает смешанная (одновременно наблюдаются недостаток кислорода и избыток углекислого газа). И тогда может понадобиться и кислородотерапия, и неинвазивная вентиляция легких.
Заболевания, при которых бывает дыхательная недостаточность ( Currow JPSM 2010).
У пациентов паллиативного профиля одышка встречается чаще всего ввиду тяжести состояния.
Определение наличия дыхательной недостаточности
При дыхательной недостаточности пациент будет испытывать трудности с вдохом или выдохом, учащенное дыхание, утомляемость, тревогу, сердцебиение. Может отмечаться синюшность или гиперемия лица, синюшность конечностей.
Существуют специальные анализы крови, которые показывают снижение уровня кислорода или повышение содержания углекислого газа, а также — насколько хорошо организм компенсирует дыхательную недостаточность, что называется, «своими силами». Более доступным и неинвазивным методом диагностики является пульсоксиметрия, то есть определение насыщения крови кислородом (или сатурации). Нормальная сатурация — 95-99%. Следовательно, если она опускается ниже 95%, значит, у пациента дыхательная недостаточность.
Причем измерять сатурацию необходимо и в покое, и при физической нагрузке. Почему?
Представьте себе ситуацию, когда вы утром спешите на работу, увидели на остановке автобус и бежите к нему, чтобы успеть сесть. Зайдя в автобус, вы будете часто дышать, ведь при беге организм интенсивней, чем обычно, потреблял кислород, возник его дефицит — надо его восполнить, насытить организм кислородом. Вскоре ваше дыхание нормализуется, уровень кислорода в крови восстановится. А как будет обстоять дело у человека с дыхательной недостаточностью в аналогичной ситуации? Он также будет тяжело дышать, однако ему потребуется гораздо больше кислорода, чем вам. И даже если он будет дышать чаще и глубже, чем вы, все равно ему не хватит содержащегося в воздухе кислорода. Значит, ему понадобится кислородотерапия.
Даже если у такого человека сатурация в покое нормальная, обязательно нужно измерить ее после посильной для него физической нагрузки. Если выяснится, что после нагрузки сатурация серьезно падает, понадобится так называемая ситуационная кислородотерапия, то есть дополнительный кислород нужен на какую-то ситуацию, например, при нагрузке или во время сна.
Однако бывает и так, что дополнительное количество кислорода человеку нужно постоянно. Тогда ему показана длительная кислородотерапия (более 15 часов в день).
Я уже упоминала о том, что нормальные показатели сатурации — 95-99%. Это называется целевая сатурация. Однако надо учитывать, что при некоторых заболеваниях целевая сатурация будет другой. Когда у пациента есть риск гиперкапнии (то есть избыточного скопления углекислого газа в крови), целевая сатурация — 88-92%. Эти цифры были озвучены Британским торакальным сообществом. Кроме того, если врач поставит диагноз хронического легочного сердца, то целевой сатурацией будет 89-94%.
Когда противопоказан кислород
При нейромышечных заболеваниях кислород противопоказан. Рассмотрим причину этого на примере бокового амиотрофического склероза.
Это заболевание, при котором поражается нервная система (так называемый двигательный нейрон), что ведет к нарушению работы важнейших систем организма, в том числе и к ослаблению дыхания. Оно становится более поверхностным, вследствие чего часто снижается сатурация. Но несмотря на это кислород назначать нельзя.
Что организм делает, когда понимает, что дыхание стало поверхностным, а значит, и кислорода для организма мало? Конечно, мы начинаем чаще дышать. Хоть и поверхностно. Такая одышка позволяет организму жить и при сниженных цифрах сатурации. Если же назначается кислородотерапия, организм отменяет этот защитный механизм — одышку. И тогда нарастает концентрация углекислого газа в крови. Сознание человека угнетается. По этой причине кислородотерапия может серьезно навредить человеку с нейромышечным заболеванием.
В любом случае показания и противопоказания к кислородотерапии определяет врач.
О методах симптоматичнской терапии при БАС, применяемых лекарствах, их преимуществах и недостатках мы уже писали. Читайте статью специалиста по этому заболеванию, врача-невролога Льва Брылева «Жить лучше и дольше при БАС: доказанные методы».
Эффекты от кислородотерапии
Если кислородотерапия назначена по показаниям, человек отмечает улучшение самочувствия, уменьшение одышки, сердцебиения, он меньше утомляется.
Довольно часто родственники спрашивают, будет ли эффект от кислородотерапии, когда близкий — в терминальной стадии заболевания. Здесь ответ один: в терминальной стадии показаний нет: кислородотерапия способна оказать эффект только тогда, когда снижена сатурация, одышку кислород не лечит. Скорее, кислородотерапия способна оказать положительный психологический эффект.
Побочные эффекты
Они могут возникнуть, если кислородотерапия назначена не по показаниям. Однако чаще всего побочные эффекты связаны с неправильной техникой. Во-первых, это ранки слизистой полости носа от кислородной канюли. Чтобы избежать этого осложнения, нужно смазывать слизистую носа облепиховым маслом, чаще менять канюли. Со временем канюли дубеют. Если вы почувствовали, что они стали очень жесткими, их нужно поменять.
Другая проблема — сухость слизистых, чаще — в первое время использования кислорода. Чтобы избежать сухости, можно дополнительно опрыскивать полость носа физраствором, однако это, скорее, психологическая мера. Поскольку кислород из аппарата проходит через колбу с водой, воздух увлажнен, и сухость, скорее, связана с субъективными ощущениями пациента.
Как выбрать кислородный концентратор
Сначала нужно определиться, есть ли у пациента необходимость перемещаться по улице, используя кислородотерапию. Или пациент лежачий и за пределы квартиры не перемещается. В первом случае можно использовать портативные кислородные концентраторы. Они легкие и удобные. Однако необходимо помнить, что, во-первых, в них, как правило, не используется увлажнитель, а сухим воздухом дышать долго нельзя. Во-вторых, при максимальном потоке кислорода 5 л/мин они держат заряд максимум час, если нет дополнительной батареи.
Портативные кислородные концентраторы различаются по потоку кислородной смеси: бывают аппараты с импульсным и постоянным потоком. В портативных концентраторах с постоянным потоком кислород поступает из аппарата постоянно, в импульсных — короткими «пшиками». И если пациент, например, испытывает большую для него нагрузку, коротких «пшиков» может не хватить для нормального функционирования организма.
Стационарные кислородные концентраторы — массивные, тяжелые, все они — с постоянным потоком кислородной смеси. В составе всегда есть увлажнитель. Если пациент не мобилен, это идеальный вариант для него.
Стационарные кислородные концентраторы бывают на 5 и 10 литров.
Организация пространства
Итак, вы выбрали кислородный концентратор. Стационарный необходимо разместить в комнате так, чтобы на него сверху ничего не могло упасть. Накрывать его нельзя. Под аппарат лучше постелить коврик для йоги. Концентратор не должен стоять рядом со шторой, она может закрыть отверстие, в которое поступает воздух, и поток снизится. Домашних питомцев к аппарату тоже лучше не подпускать.
Концентратор не должен стоять вплотную к стене, как минимум — в 10 см от нее, иначе он может перегреться. Нельзя размещать аппарат рядом с отопительными приборами, плитой.
Пыль с поверхности концентратора можно протирать обычной влажной тряпкой.
Что касается расходных материалов, то колба-увлажнитель рассчитана на год, а канюли — на 3 месяца. Но если канюли стали очень жесткими раньше этого срока, лучше их заменить.
Основные страхи, связанные с кислородотерапией
Несмотря на то, что использование кислородных концентраторов на дому широко распространено, у многих людей остается страх, связанный с тем, что кислород взрывоопасен. Это действительно так, однако при соблюдении мер предосторожности этот риск сводится к нулю.
Также многие думают, что человек «подсядет на кислород». На это я всегда отвечаю, что пациенту нужен кислород в силу его заболевания. И если потребность в кислороде растет, это значит, что заболевание прогрессирует. Если же симптомы дыхательной недостаточности полностью проходят, то кислородотерапию врач отменит. Однако отмена — редкое явление у паллиативных пациентов.
Таким образом, кислородотерапия — метод лечения, который помогает тогда, когда есть конкретные показания. Общее правило гласит: кислород не лечит одышку, он помогает справиться со сниженным содержанием кислорода в крови. Но нужна кислородотерапия или нет, должна она быть длительной или ситуационной — это должен определять только врач. У пациентов паллиативного профиля показания к кислородотерапии чаще всего есть. И когда кислородный концентратор появляется у пациента дома, при условии соблюдений правил эксплуатации и правильной организации пространства, это значительно облегчает жизнь больному.
Вам может быть интересно:
Расходные материалы для респираторной поддержки: как ухаживать за ними дома. Что можно обрабатывать, а что нельзя? Как и с помощью чего дезинфицировать многоразовые изделия, как часто менять одноразовые?
Портативные источники кислорода. Как использовать кислородные концентраторы и баллоны.
Все о масках для неинвазивной вентиляции легких (НИВЛ). Виды масок, правила подбора, проблемы и осложнения при использовании маски, уход за маской.
Рекомендации для пациентов, получающих респираторную поддержку дома во время пандемии COVID-19. Что делать, если установлена трахеостома, как часто обрабатывать и менять расходники для устройств искусственной вентиляции легких.
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.
Антигипоксанты в неотложной терапии черепно-мозговых травм
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Не считая самой черепно–мозговой травмы (ЧМТ), требующей хирургического лечения, отек мозга является основной причиной гипоксии головного мозга и летальности больных. Реанимационные мероприятия при отеке мозга за последние десять лет свелись к единому подходу. Вся консервативная терапия направлена на прямое или косвенное обеспечение адекватного поступления кислорода к ишемизированным тканям мозга. Наше внимание привлек препарат Актовегин – безбелковый гемодиализат крови телят, в состав которого входят низкомолекулярные дериваты пептидов и аминокислот и который широко используется в терапии цереброваскулярных расстройств. Как было показано ранее, этот препарат увеличивает поступление кислорода и глюкозы в клетки, что наряду с нейропротективным эффектом в условиях гипоксии позволяет считать Актовегин препаратом с большим потенциалом в терапии черепно–мозговых травм.
Профилактика и лечение
гипоксии головного мозга
Все консервативные терапевтические и профилактические процедуры направлены, прямо или опосредованно, к своей конечной цели. Интенсивная терапия отека мозга за последние десять лет достигла единого подхода, который лишь незначительно различается в различных лечебных учреждениях. Борьба с отеком головного мозга включает в себя подачу кислорода путем контролируемой искусственной вентиляции с контролируемой гипокапнией и с парциальным давлением СО2 между 30 и 35 мм рт.ст., приподнятое положение верхней половины тела, стабилизацию кровообращения, устранение боли и седация, при необходимости использование кортикостероидов и барбитуратов. Протективный эффект больших доз барбитуратов изначально приветствовался за счет развития эйфории, но в настоящее время эти препараты в основном используются для общей седации. Осмодиуретики назначаются по особым показаниям, к которым относят внезапное повышение внутричерепного давления с признаками вклинивания среднего мозга или ствола мозга (табл. 1).

Дополнительно к этим общепринятым мероприятиям интенсивной терапии предпринимались попытки в экспериментах на животных и в клинических исследованиях повысить толерантность головного мозга к ишемии путем применения специальных медикаментозных средств. Такие исследования, в частности, были проведены в отношении местных анестетиков и антагонистов кальция. Эти препараты снижают потребность ткани головного мозга в кислороде и в то же время, предположительно, замедляют пагубные биохимические реакции (накопление кальция в цитозоле, появление жирных кислот и свободных радикалов), которые наблюдаются при черепно–мозговых травмах.
Аналогичный эффект – в основном в подострую фазу лечения, при так называемом переходном синдроме – ожидался от ноотропных препаратов (например, пиритинола гидрохлорида, меклофеноксата дихлорида, пирацетама).
Имея в виду тот факт, что все консервативные меры, используемые в интенсивной терапии, направлены на поддержание адекватного обеспечения кислородом, мы обратили внимание на препарат, используемый в терапии церебральной и периферической сосудистой недостаточности. Этим препаратом является Актовегин, обладающий антигипоксической активностью. Его фармакодинамические эффекты обычно обусловлены именно входящими в состав низкомолекулярными пептидами. Было доказано следующие эффекты препарата: повышение захвата кислорода и усиление транспорта глюкозы в клетки (последнее описано как инсулиноподобная активность), повышение утилизации кислорода и глюкозы, стимуляция синтеза АТФ, улучшение кровоснабжения головного мозга и улучшение микроциркуляции, оптимизация вигильности и уменьшение концентраций аммиака и лактата в крови при портальной энцефалопатии и алкогольном делирии.
Этот препарат с успехом применяется при нарушениях церебрального метаболизма и кровоснабжения, при ожогах и радиологических травмах. Цереброваскулярная недостаточность выделилась в отдельное показание к применению этого препарата. На рисунке 1 схематически представлен механизм действия Актовегина. Данных о применении его в острой и реабилитационной фазе при черепно–мозговых травмах пока не существует. Благодаря своей способности увеличивать потребление кислороды и транспорт глюкозы внутрь клеток, а также благодаря своему протективному эффекту при гипоксии этот препарат очень подходит для консервативной терапии черепно–мозговой травмы. На этом основании мы решили включить в схему лечения пациентов с первого дня пребывания в стационаре после травмы парентеральное введение 250 мл 20% раствора Актовегина. В так называемом ориентировочном (пилотном) исследовании мы проследили эффект терапии у 10 невыборочных пациентов с черепно–мозговой травмой. Поскольку у этих 10 пациентов результаты терапии были очень обнадеживающими и положительными, в последующее время были получены результаты такой терапии еще у 25 пациентов.

10 пациентов с черепно–мозговой травмой (табл. 2) ежедневно получали внутривенно 250 мл 20% раствора Актовегина. Такая терапия проводилась, начиная с 1–го дня после получения травмы.
В течение четырех месяцев все пациенты с черепно–мозговой травмой были включены в пилотное исследование без какого–либо отбора. При первичной терапии рассчитывался общий балл по Глазговской шкале комы (врачом скорой помощи на месте происшествия), и в среднем он составил 6,7 балла (минимум – 5, максимум – 10). Средний возраст 7 пациентов мужского пола и 3 пациенток составил 28 лет (15–46 лет).
Первичное проведение КТ выявило генерализованный отек мозга у 2–х пациентов, очаги ушиба и внутренние кровоизлияния, сопровождающиеся отеком ткани мозга у 5 пациентов. 2 пациента находились в состоянии комы после оперативного удаления эпидуральной гематомы, а 1 пациент имел кровоизлияния в ганглии ствола головного мозга и отек мозга. 5 пациентов имели изолированную черепно–мозговую травму. Еще четверо – имели сопутствующие переломы конечностей, один пациент имел травму грудной клетки с переломами двух ребер и правосторонним пневмотораксом. В дополнение к соответствующей терапии, адаптированной к состоянию пациентов, терапия черепно–мозговой травмы включала в себя контролируемую искусственную вентиляцию легких (в режиме легкой гипервентиляции, с уровнем артериального рСО2 от 27 до 35 мм рт.ст.), приподнятое положение верхней части тела, седативную терапию 200 мг фенобарбитала в/в от 3 до 4 раз в день (по необходимости в/в добавлялись флунитрозепам и пиритрамид), введение больших доз кортикостероидов (триамцинолон 40 мг каждые 6 часов). Такая интенсивная терапия проводилась в среднем в течение 6 дней.
Интересно отметить короткую и тихую фазу прояснения сознания у пациентов с черепно–мозговой травмой без органического субстрата (генерализованный отек мозга по данным КТ). Ни у кого из этих пациентов не развился транзиторный синдром с признаками беспокойства, возбуждения и ажитированного состояния. Пациенты с органическим поражением мозга (например, очагами ушиба, внутренними кровоизлияними) и последующей неврологической недостаточностью также имели спокойную фазу прояснения сознания после окончания интенсивной терапии.
Медленное, но стабильное улучшение сознания и неврологическим симптомов было типичным для подострой фазы у этих пациентов. Ни у кого их них не отмечалось длительного периода стагнации или ухудшения состояния.
После окончания терапии семь пациентов были выписаны без необходимости проведения дальнейшей реабилитационной терапии. Три других пациента были переведены в специализированный неврологический реабилитационный центр для последующего восстановительного лечения.
На сегодняшний день, спустя 3,5 года после этого пилотного исследования, мы знаем, что эти три пациента покинули реабилитационный центр. Двое из них полностью интегрировались в их прежний образ жизни, а один не смог вернуться к прежней работе из–за остаточных неврологических изменений.
После многочисленных малоудачных попыток свести к минимуму проявления транзиторного синдрома после черепно–мозговой травмы при помощи различных нейротропных препаратов, мы были также очень скептически настроены в отношении Актовегина.
Но, с другой стороны, клинически и экспериментально доказанные эффекты этого препарата в неврологии, ангиологии, диабетологии и хирургии были столь очевидными, что мы решили применить Актовегин при лечении черепно–мозговой травмы.
В экспериментах in vitro было показано, что депротеинизированный гемодиализат крови телят увеличивает поглощение кислорода митохондриями клеток, культурами клеток, гистологическими препаратами и отдельными органами. Также было показано, что в изолированных митохондриях увеличивается синтез АТФ. Эти эффекты позволяют сделать вывод о том, что этот препарат оказывает положительное воздействие на аэробный метаболизм и способствует процессам абсорбции и регенерации, которые требуют большого расхода энергии.
В экспериментах на животных было продемонстрировано, что гемодиализат крови телят обладает протективным эффектом в условиях гипоксии. Аналогичный протективный эффект был продемонстрирован Albrecht в его исследовании со здоровыми добровольцами, находившимися в высокогорных условиях гипоксии.
Кроме этого, указанный препарат обладает инсулиноподобной активностью. Bachmann и Heidrich сообщают о быстрой нормализации повышенного уровня глюкозы в крови при проведении внутривенного теста толерантности к глюкозе.
Большое количество положительных результатов было получено при использовании Актовегина при заболеваниях, обусловленных органическими поражениями головного мозга различной этиологии. Также имеется несколько публикаций, описывающих положительные результаты у пациентов с артериальной цереброваскулярной недостаточностью, церебральной интоксикацией и гериатрическими заболеваниями.
Эти исследования свидетельствуют о том, что усиление кровотока под действием гемодеривата в коре головного мозга и ганглиях ствола головного мозга, скорее всего, представляет собой вторичный эффект, то есть результат первичного усиления окислительного метаболизма в ганглиоцитах. Это предположение согласуется с исследованиями Бетманна (Bethmann) и Оттингера (Oettninger), которые подтвердили усиление церебрального кровотока и повышение церебрального потребления кислорода и глюкозы после внутривенного введения актовегина у собак. Эти данные коррелируют с результатами, полученными Хойером (Hoyer). Они использовали препарат для лечения пациентов с синдромом цереброваскулярной недостаточности и также отметили значительно увеличение потребления кислорода и глюкозы.
Протективный эффект в отношении непосредственно поврежденных и находящихся в потенциальной опасности участков головного мозга
Все эти работы свидетельствуют о том, что положительный эффект Актовегина можно в той же степени ожидать и при черепно–мозговых травмах и их последствиях. Положительный эффект в остром периоде черепно–мозговой травмы может быть объяснен антигипоксическим эффектом в отношении непосредственно поврежденной ткани головного мозга и в интактной ткани, которая может быть повреждена опосредованно. Использование глюкозы в терапии черепно–мозговой травмы является давним и общепринятым мероприятием. Проблемы возникали при введении высококалорийных растворов с высокой осмоляльностью (риск развития феномена «рикошета» при использовании растворов с осмотической активностью) и при частых превышениях нормального уровня глюкозы в крови за счет использования глюкокортикоидов. Использование гемодиализата в остром периоде черепно–мозговой травмы может избежать возникновения этих нежелательных эффектов использования больших количеств глюкозы. Поскольку этот препарат обладает инсулиноподобной активностью и способен увеличивать потребление глюкозы тканью головного мозга, нормокалорийные растворы глюкозы могут теоретически оказывать такое же терапевтическое воздействие, как и высококалорийные растворы.
Отсутствие резких колебаний
уровня глюкозы в крови
Факт того, что ни одного из наших пациентов с черепно–мозговой травмой не наблюдались резкие колебания уровня глюкозы в крови, еще раз косвенно свидетельствует о сказанном выше. Хотя здесь следует сразу оговориться: наше исследование не было двойным слепым и проводилось на небольшом числе пациентов. Все наши 25 пациентов получали одинаковую терапию. Они получали либо парентерально, либо энтерально 3000 ккал в день, а в первые 7 дней после травмы еще и большие дозы глюкокортикоидов. Мы ожидали, что у некоторых пациентов могут возникнуть проблемы с уровнем глюкозы в крови, учитывая и то, что пациенты были разных возрастных групп. Тем не менее таких проблем отмечено не было.
Кроме этого, улучшение микроциркуляции в ткани головного мозга под действием депротеинизированного гемодиализата крови телят гарантирует дальнейшее улучшение обеспечения кислородом травмированного мозга без увеличения объема циркулирующей крови. Это, несомненно, имеет большое значение в остром периоде после травмы.
В литературе неоднократно описывалось усиление репаративных процессов в стадии реабилитации и использование при них Актовегина. Таким образом, легко было провести экстраполяцию на черепно–мозговую травму, в особенности в случае ушибов головного мозга и внутренних кровоизлияний.
Короткая и спокойная фаза
восстановления сознания
У наших пациентов при проведении КТ было подтверждено наличие генерализованного отека мозга без органического субстрата. После прекращения интенсивной седативной терапии у них наблюдалась очень короткая и спокойная фаза восстановления сознания. Ни у кого из этих пациентов не наблюдался транзиторный синдром с выраженным беспокойством, возбуждением или агрессивностью. Напротив, пациенты были спокойны, как после продолжительного глубокого сна. И через 24 часа они продемонстрировали хорошую ориентацию во времени и пространстве с сохранением ретроградной и антеградной амнезии («синдром спящей красавицы»).
У пациентов с органическими поражениями головного мозга (например, кровоизлияния и участки ушиба) и последующим неврологическим дефицитом фаза восстановления сознания после прекращения интенсивной терапии также была отмечена спокойным пробуждением без побочного транзиторного синдрома. Медленное, но стабильное восстановление сознания и неврологических симптомов было характерно для подострой фазы у всех пациентов с церебральными повреждениями и неврологическим дефицитом. Ни у одного пациента не наблюдалось заметно пролонгированной стагнации или рецидива.
Поскольку эти результаты были получены в пилотном ориентировочном исследовании, невозможно сделать вывод о том, что без раннего использования Актовегина наблюдалось бы худшее течение заболевания.
Не вызывает вопросов тот факт, что наши результаты отражают наше собственное впечатление о положительном эффекте терапии с использованием Актовегина у пациентов с черепно–мозговой травмой, и то, что этим данным не достает объективизма. Наши первые наблюдения способствовали продолжению использования этого препарата, и вплоть до настоящего времени эта терапия давала хорошие результаты у пациентов с черепно–мозговой травмой. Мы убеждены, что положительные результаты, полученные при многих неврологических заболеваниях и подтвержденные во многих экспериментальных и клинических исследованиях, также оправдывают применение Актовегина при церебральных травмах.
Целью данной работы является привлечение внимания врачей к возможности расширения возможностей терапии при черепно–мозговой травме. Для объективизации результатов желательно проведение исследования по эффективности депротеинизированного гемодиализата крови телят при черепно–мозговой травме в расширенных по дизайну исследованиях в крупных неврологических центрах.
Обзор подготовлен по материалам
Aus Der Klinischen Praxis, 63, 11, 835–841 (1990)