пересадка костного мозга при лейкемии
ЧТО СЛЕДУЕТ ЗНАТЬ О ПЕРЕСАДКЕ КОСТНОГО МОЗГА
В народе когда говорят «пересадка костного мозга», подразумевают пересадку стволовых клеток. В этом смысле костный мозг понимается как источник стволовых клеток. У взрослых источником стволовых клеток может выступать кровь. Также стволовые клетки извлекаются из пуповинной крови.

При каких заболеваниях требуется пересадка костного мозга?
— Первую группу составляют заболевания крови. На первом месте стоит лейкемия. При лейкемии, которая не поддается лечению, или рецидивирующей лейкемии, особенно при таких заболеваниях, как острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз трансплантация костного мозга имеет важное значение. Хотя при диагнозе «острый лимфобластный лейкоз» пересадка может быть первым методом лечения. Заболевания, при которых костный мозг вообще не вырабатывает клетки крови, таких как апластическая анемия, трансплантация костного мозга является единственным методом лечения. Этот вид заболевания может быть врожденным, а также может развиться со временем. Некоторые вирусы, химические вещества и лекарства могут привести к апластической анемии. При врожденных заболеваниях крови пересадка костного мозга также занимает важное место. В лечении талассемии, известной как средиземноморская анемия, серповидно-клеточной анемии и при некоторых других редких заболеваниях крови пересадка костного мозга применяется как единственный метод лечения.
Следом за болезнями крови идут онкологические заболевания. Наблюдаемая у детей неходжкинская лимфома возглавляет этот перечень, следом идут болезни, не поддающиеся лечению другим образом или рецидивирующие, лимфома Ходжкина в случае рецидива. Для пациентов с такими диагнозами трансплантация костного мозга является единственным шансом на спасение.
Кто может быть донором костного мозга?
— В донорстве костного мозга может использоваться пуповинная кровь, сохранившаяся в плаценте и пупочной вене после рождения ребенка.

Существует ли опасность для донора?
— Вокруг трансплантации костного мозга существует много заблуждений относительно вреда для донора. Также как и при пересадке печени или почек, подобная ошибочная информация приводит к тому, что люди не хотят выступать донорами. Однако процедура трансплантации не несет в себе никакого вреда. Тем не менее, дети возрастом до 2 лет и те, кто старше 60 лет, не рассматриваются в качестве донора костного мозга. Перед забором стволовых клеток проводятся анализы крови, при которых изучаются ее показатели. Для оценки общего состояния пациента, проводятся медицинские обследования, в ходе которых исследуется печень, почки и кровь.
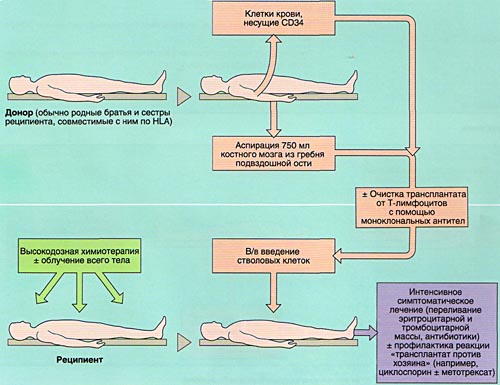
Аллогенная трансплантация проводится в операционной. Забор стволовых клеток осуществляется с помощью специальной иглы, которая вводится непосредственно в тазовую кость, где располагается основной резервуар костного мозга. Затем контейнер содержащей стволовые клетки доставляется в лабораторию для отбора стволовых клеток. Отбор стволовых клеток проводится на аппарате афереза. После этого оценивается количество живых клеток, на основании чего определяется, подходит ли отобранное количество для рецепиента. Если количество достаточное, то начинается подготовка к трансплантации. Количество костного мозга после забора у донора восстонавляется в течении 2-х недель.
Как осуществляется пересадка?

Что ожидает пациентов после трансплантации?
— В случае если у пациента онкологическое заболевание крови, для подавления деффектных клеток больному проводят курс лечения ХТ благодоря, которой разрушаются не только раковые клетки пациента, но и здоровые клетки костного мозга. Только после такого рода лечения, становиться возможным пересадка здорового донорского костного мозга. После начинается период иммунносупрессивной терапии, направленная на подавление иммунной системы пациента, которая может считать пересаженные клетки чужеродными.
Однако, это делает человека беззащитным перед инфекциями из внешнего мира. Поэтому основные усилия направлены на то, чтобы пациент ничем не заразился.
На 14-й дней после трансплантации определяется, воспроизводятся пересаженные клетки или нет. Однако, до достижения определенного количества клеток крови в течение 30-40 дней пациент содержится в стерильной среде. Если количество клеток увеличилось, то процедура трансплантации считается успешной. За этот период происходит увеличение числа кровяных клеток, вырабатываются эритроциты, лейкоциты и тромбоциты, а также если никакой инфекции не обнаружено, пациент может использовать общую среду с другими пациентами в больнице и переводится из бокса в отделение. Пациент находиться в клинике в течение 45-60 дней. После лечения, если состояние пациента удовлетворительное, больной выписывается. Следует так же отметить, что в течении года после выписки, пациенту необходимо находиться под потоянным контролем врача для обеспечения защиты от инфекций и контроля его восстановления.
Очень повезло, что у меня есть братья!
История 16 летней девочки из Аданы Х.Ф. с диагнозом лейкемия, которая выздоровела благодаря пересадке костного мозга от старшего брата.
Проф.Док. Бюлент Антмен знает эту пациентку в течение четырех лет. Отец на пенсии, мать домохозяйка, в семье 9 детей, Х.Ф. родилась шестой. Рассказывая о том, как началась ее болезнь, она говорит следующее: «В то время я училась в шестом классе. Был экзамен. У меня кружилась голова, тошнило. Я не смогла ответить на вопросы, хотела все выбросить из головы и уйти домой. Ушла из школы, с трудом добралась до дома. В аптеке купили лекарство от тошноты. Не помогало, пошли в больницу, оттуда отправили на обследование в Медицинский факультет университета Acibadem. Лечащим врачом стал доктор Бюлент Антмен…»

Доктор принял решение для первой попытки пересадки взять клетки у старшего брата, если будет отторжение, тогда у сестры. Первая попытка оказалась успешной.
Х.Ф. безостановочно рассказывает о своих планах после выздоровления: «Хочу пойти в школу. Поступлю в лицей. Я вижу своих друзей и волей-неволей расстраиваюсь. Вначале переживала из-за волос, но теперь не думаю об этом, как бы то ни было заново отрастут. Эта болезнь меня многому научила. Вместо того, чтобы жаловаться, пытаюсь смотреть на ситуацию с хорошей стороны. Хочу выучиться и получить профессию».
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
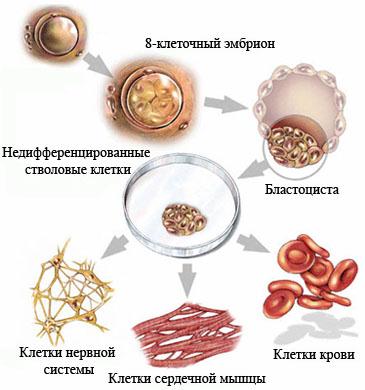
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 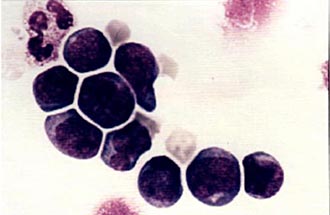 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Пересадка костного мозга при онкологических заболеваниях крови
Впервые сталкиваясь с таким страшным диагнозом, как, лейкоз, или лейкемия, лимфома – у человека после первого шока начинается хаос в голове из огромного количества вопросов: как, почему я, или мой ребенок, что делать, как лечить, какие шансы, нужна ли пересадка костного мозга, где найти донора…
Ниже мы выстроили систему из этих вопросов и попробуем ответить на каждый. Это и будет неким планом действий для человека, которому поставили диагноз – рак крови.
Как диагностировать рак крови?
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
Какая бывает пересадка костного мозга? Где найти донора?
Как происходит пересадка костного мозга? Что делают перед ТКМ? Сколько времени занимается вся процедура пересадки?
Сколько стоит пересадка костного мозга?
Где лучше делать трансплантацию?
Какой прогноз после пересадки костного мозга?
Как определить рак крови: лейкоз, лейкемию. Как выявить лимфому?
Виды рака крови:
Как диагностировать рак крови на ранней стадии, как он проявляется и как его заметить самостоятельно?
Внимание на симптомы:
Вы заметили эти симптомы у себя? У ребенка? Если испытываете подобные симптомы больше 1-2 недель, срочно проходите первичное обследование, а именно:
Именно по общему анализу крови врач может распознать серьезные отклонения от нормы. Если это случилось, необходимо делать пункцию и проводить иммуногистохимический анализ клеток костного мозга для определения вида рака крови.
Далее, в зависимости от типа рака крови, грамотный врач должен обследовать пациента с помощью ПЭТ КТ, или МРТ, КТ, сцинтиграфии.
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
Как лечится рак крови:
Ранняя стадия рака лейкоза, лейкемии или лимфомы: у 75% пациентов ремиссия наступает уже при первой линии лечения цитостатиками и химиотерапией.
Важно: первая линия лечения может длиться от 3 до 9 месяцев.
Вторая и третья стадии лимфомы, лейкемии и остром лейкозе: кроме цитостатиков и химиотерапии, применяют таргетную терапию и иммунотерапию. Комплексное лечение серьезно повышает шансы онкологического пациента на выход в ремиссию.
Важно: иммунотерапия не применяется как самостоятельный метод лечения рака крови, этот новейший метод биологического лечения является сильным вспомогательным лечением.
Четвертая, терминальная стадии, рецидив: требуется пересадка костного мозга, от донора или собственных стволовых клеток.
Важно: Некоторые виды лейкоза, лейкемии и лимфом даже на ранних стадиях предполагают впоследствии пересадку костного мозга. Поэтому если полученный диагноз по протоколу предполагает в будущем ТКМ (трансплантацию), сразу сдавайте анализы на типирование антигенов HLA сами и все ваши родные. Заранее определитесь, подходит ли кто-то из родственников как донор.
Какая бывает пересадка костного мозга? Где найти донора?
Виды трансплантации:
Как происходит пересадка костного мозга? Что делают перед ТКМ? Сколько времени занимается вся процедура пересадки?
Пересадка костного мозга является либо завершающим этапом лечения, когда предыдущие методы не дали 100% положительного результата, либо основным при рецидиве рака крови.
В случае аллогенной трансплантации забор клеток костного мозга производится у донора. Напомним, что 9 пациентам из 10 необходимо ожидать в очереди на получение донора из общей базы при совпадении антител HLA.
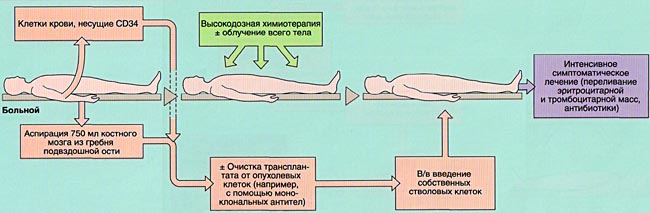
Если планируется пересадка собственных стволовых клеток костного мозга, то забор этих клеток делают заранее. Если от донора, то незадолго до процедуры. Особая подготовка не требуется, только обследование.
Стволовые клетки для пересадки берут из тазовой кости пункцией, однако, наиболее современный и щадящий способ – это фильтрование стволовых клеток из периферийной крови после лекарственной стимуляции выброса нужных клеток в кровь (недельный прием препарата). Болезненные последствия для донора или самого пациента отсутствуют. Не больно.
Перед процедурой необходимо буквально «убить» собственный костный мозг, который производит мутированные кровяные клетки. Для этого проводится интенсивная высокодозная химиотерапия или высокоточная лучевая терапия. Если вариант ТКМ с донором, то дополнительно применяют большие дозы иммуносупрессоров, чтобы организм сразу не отверг чужой костный мозг.
Операция по пересадке костного мозга не что иное, как переливание, ведь костный мозг выглядит просто как пакет крови для переливания.
На 2-4 недели после пересадки пациента помещают в стерильную палату клиники, так как он находится в состоянии цитопении: старый костный мозг убит и не работает, новый костный мозг еще не прижился. В этот период для пациента опасны любые возможные инфекции, даже самые незначительные.
Еще в течение 2 месяцев после выписки из стерильной палаты пациента наблюдают или стационарно или амбулаторно. Каждую неделю он сдает анализы крови, мочи, находится под контролем своего онколога.
По окончании всего этапа лечения, пациент проходит обследование каждые 3 месяца в течение 1 года. Далее еще 4 года – каждые 6 месяцев. Перешагнув 5-летний рубеж выживаемости, пациент вступает в период длительной ремиссии, что в 80% случаях означает полное излечение. Обследование раз в год!
Итак, вся процедура трансплантации костного мозга при лейкозе крови, лейкемии, при множественной миеломе (миеломной болезни), лимфоме Ходжкина и неходжкинской лимфоме занимает 3-4 месяца.
Пересадка костного мозга при лейкемии
Современная стратегия терапии острого миелоидного лейкоза (ОМЛ) определяется максимально возможным использованием потенциала интенсивной индукции, консолидации и поддерживающего лечения.
Во-первых, трансплантация стволовых гемопоэтических клеток всегда является этапом в лечении больных острым миелоидным лейкозом; во-вторых, всегда подразумевается отбор больных в соответствии с их возрастом и соматическим статусом, адекватностью химиотерапии, развитием рецидива до выполнения ТКМ, наличием HLA-совместимого донора (для аллогенной ТКМ); в-третьих, сравнение результатов лечения больными, которым проводят химиотерапию или выполняют трансплантацию, возможно лишь на основе анализа рандомизированных групп в рамках многоцентровых кооперированных исследований; в-четвертых, эффективность выполнения ТКМ необходимо оценивать в зависимости от цитогенетических аномалий, которые определяют течение заболевания.
К концу 2001 г. завершены 4 многоцентровых рандомизированных исследования, проведенных в Европе и США. Их цель — сравнить эффективность постремиссионной терапии острого миелоидного лейкоза, выполненной в 3 вариантах: в виде интенсивной химиотерапии, аутологичной и аллогенной ТКМ. В настоящем анализе данные отдельных исследовательских центров не учитываются.
Безрецидивная и общая выживаемость больных, которым выполнили аутологичную трансплантацию костного мозга (ТКМ) или осуществляли химиотерапию
В таблице приводится описание основных этапов лечения в рандомизированных исследованиях, проведенных итальянской исследовательской группой (GIMEMA) совместно с общеевропейской (EORTC), а также французской (GOELAM), американской (US Intergroup) и английской (MRC) группами.
Аутологичная трансплантация костного мозга является высокодозной консолидацией полной ремиссии острого миелоидного лейкоза (ОМЛ). Удалось полностью выполнить программу лечения, предусмотренного в исследованиях, по данным группы EORTC+GIMEMA, в 74,2 % случаях при запланированной аутотрансплантации и в 82,5 % — химиотерапии, во французском исследовании GOELAM в 87,2 и в 71 % соответственно, в объединенной американской группе — в 60 и 92 % соответственно и в Великобритании в 66,3 % в случае запланированной аутологичной ТКМ.
Частота развития рецидивов и смертность среди больных, которым проводили химиотерапию или выполняли аутологичную трансплантацию костного мозга (ТКМ)
Таким образом, процент выполняемости запланированной терапии достоверно отличается в зависимости от выбранной по случайному признаку программы лечения: аутологичная ТКМ — 71 %, химиотерапия — 88 %. Эти различия, по-видимому, характеризуют аутологичную ТКМ как рискованный метод лечения, требующий принятия очень ответственных решений как больным, так и врачом.
Ее долгосрочная эффективность по сравнению со стандартной консолидацией отражена в таблице. Анализ проведен по принципу «намерение лечить», т. е. в анализ включали всех больных независимо от того, выполнили ли им запланированное лечение или нет.
Безрецидивная выживаемость больных, которым выполнена аутологичная трансплантация костного мозга или проведена химиотерапия, в зависимости от группы прогноза, определенного по цитогенетическим маркерам
Результаты исследования MRC-10 целесообразно рассмотреть отдельно, поскольку в нем оценивали эффективность аутологичной ТКМ, выполняемой как пятый курс химиотерапии, в сравнении с 4 курсами химиотерапии и прекращением лечения после них. Это исследование доказало, что аутологичная трансплантация костного мозга достоверно улучшает безрецидивную выживаемость больных — 54 % в сравнении с 40 %, при этом авторы подчеркивают, что неясно, сама ли трансплантация костного мозга или дополнительный пятый курс химиотерапии сыграли принципиальную роль.
Последующее исследование MRC-12, сравнивающее эффективность 5 курсов химиотерапии и 4 в сочетании с аутологичной трансплантации костного мозга, показало отсутствие различий между двумя подходами. Общая выживаемость 1224 больных, включенных в исследование, одинакова при проведении 4 или 5 курсов. Тем не менее исследователи отмечают некоторые преимущества у больных в возрасте 15—35 лет после проведения им 5-го курса химиотерапии.
Безрецидивная выживаемость больных в зависимости от числа лейкоцитов и варианта ОМЛ по данным французского исследования
Достоверные различия по безрецидивной выживаемости у больных ОМЛ при проведении аутологичной трансплантации костного мозга получены еще в одном из приведенных в таблице исследований — EORTC+GIMEMA. При выполнении аутологичной трансплантации костного мозга безрецидивная выживаемость составила 48 % в сравнении с 30 % при химиотерапии. Предметом критики в этом исследовании стали результаты стандартной химиотерапии. Некоторые авторы расценивают 30 % безрецидивную выживаемость у больных моложе 55 лет как крайне низкий показатель, обусловленный недостаточной адекватностью химиотерапии.
Как видно из таблицы, вероятность развития рецидивов после выполнения аутологичной трансплантации костного мозга значительно меньше (притом, что аутологичная трансплантация костного мозга осуществлена лишь 70 % больных из всех рандомизированных на этот вариант терапии). Однако высокая летальность, обусловленная трансплантацией, нивелирует преимущества последней при анализе безрецидивной выживаемости.
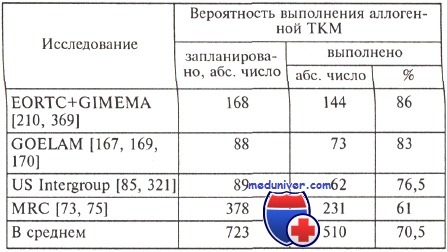
Выполняемость аллогенной трансплантации костного мозга
Анализ эффективности аутологичной трансплантации костного мозга в зависимости от группы прогноза, определенной по цитогенетическим маркерам, не позволяет сделать однозначные выводы. Это связано как с противоречивостью данных, так и с малым числом больных. Данные представлены в таблице.
Как видно из таблице, по результатам исследований MRC и US Intergroup безрецидивная выживаемость после выполнения аутологичной трансплантации костного мозга у больных из группы благоприятного прогноза выше. У больных из группы среднего прогноза преимущества аутологичной трансплантации костного мозга выявлены лишь в исследовании US Intergroup. Одинаково малоэффективной трансплантации костного мозга оказалась у больных из группы неблагоприятного прогноза, однако следует отметить, что показатели безрецидивной выживаемости у этих больных значительно отличаются в каждом исследовании. Это позволяет сделать вывод о том, что в американском исследовании программа химиотерапии менее интенсивная.
При отсутствии возможности оценивать цитогенетические маркеры в анализ прогностических факторов могут быть включены такие простые параметры, как число лейкоцитов в дебюте заболевания и вариант острого миелоидного лейкоза (ОМЛ).
Данные французского исследования GOELAM демонстрируют, что различий в 4-летней безрецидивной выживаемости в зависимости от числа лейкоцитов в дебюте заболевания (более или менее 30 • 109/л) и варианта ОМЛ при сравнении эффективности аутологичной трансплантации костного мозга и интенсивной консолидации не получено. Вывод этого исследования — выполнение аутологичной трансплантации костного мозга больным ОМЛ в период первой полной ремиссии не обязательно. Однако число больных в группах крайне невелико, и большинство исследователей указывают, что аутологичная трансплантация костного мозга может быть включена в программу терапии больных в период первой полной ремиссии ОМЛ при условии снижения летальности, связанной с самой трансплантацией.
Безрецидивная 5-летняя выживаемость больных острым миелоидным лейкозом в зависимости от группы прогноза и наличия у них HLA-совместимого донора
Эффективность аллогенной трансплантации костного мозга зависит не только от мощного лучевого и выраженного цитостатического воздействий, но и от реакции иммунной системы донора костного мозга на опухолевые клетки больного (реакция трансплантат против лейкоза). Именно иммунные механизмы обеспечивают основное противоопухолевое воздействие. К сожалению, у большинства пациентов HLA-совместимого донора нет. По данным обсуждаемых исследований, HLA-совместимого донора определяли у 22—26 % больных, у которых была достигнута полная ремиссия.
Причем учитывали только больных в возрасте максимально до 45 лет, при котором возможно было проведение аллогенной трансплантации костного мозга. Число больных, которым выполнили запланированную ранее аллогенную трансплантацию костного мозга, по данным разных исследований, колеблется от 60 до 86 %. Данные по выполняемости аллогенной трансплантации костного мозга представлены в таблице.
Существенные различия между запланированными и реально выполненными трансплантациями могут быть связаны с токсичностью предшествующей химиотерапии, с развитием ранних рецидивов, отказами пациентов.
Анализ ее эффективности следует проводить по так называемому принципу — донор есть/донора нет. В группу «донор есть» включают больных, у которых имеется HLA-совместимый донор, а в группу «донора нет» тех, у кого HLA-совместимый донор отсутствует. В группе «донор есть» анализируют результаты лечения всех больных независимо от того, выполнили им аллогенную трансплантацию костного мозга или нет.
Частота развития рецидивов у больных, которым выполнили аллогенную трансплантацию костного мозга или провели химиотерапию
В таблице приведены показатели 5-летней безрецидивной выживаемости больных в зависимости от наличия или отсутствия у них HLA-совместимого донора и группы прогноза, определенного по цитогенетическим маркерам, в трех исследованиях: MRC, US Intergroup, EORTC+GIMEMA.
Следует напомнить, что в группе «есть донор» представлены показатели больных, большинству из которых (в среднем 70 %) выполнили аллогенную трансплантацию костного мозга. Так же как и при анализе результатов аутологичной трансплантации костного мозга, становится очевидной разнородность результатов аллогенной трансплантации костного мозга. Так, если в английском исследовании MRC аллогенная трансплантация костного мозга имеет преимущество перед химиотерапией лишь у больных из группы среднего прогноза, то в американском исследовании US Intergroup статистически достоверные различия в пользу аллогенной трансплантации костного мозга получены у больных из группы благоприятного и неблагоприятного прогноза.
В европейском исследовании EORTC+GIMEMA, итоги которого подводились в 2001 г., показатели безрецидивной выживаемости во всех группах статистически не отличаются. По данным 2004 г., показатели безрецидивной выживаемости больных из разных прогностических групп были практически такими же, за исключением группы высокого риска: у больных из группы благоприятного прогноза — 61 % (донор есть) и 66 % (донора нет), промежуточного прогноза — 45 % (донор есть) и 49 % (донора нет), плохого прогноза —43 % (донор есть) и 18,4 % (донора нет).
Бесспорным доказательством преимущества аллогенной трансплантации костного мозга может служить анализ терапии 149 больных ОМЛ (15—55 лет), которых наблюдали и лечили в Северном регионе Великобритании. Так, полная ремиссия была достигнута у 74 % больных в возрасте до 40 лет и у 58 % — в возрасте от 40 до 55 лет. После проведения двух курсов индукции и двух курсов консолидации (протокол MRC-10) всем больным терапию прекращали. Тем больным, у которых были HLA-совместимые доноры, выполняли аллогенную ТКМ. У 28 больных моложе 40 лет выявили HLA-совместимых родственных доноров, 22 из них провели аллогенную ТКМ (одну — сингенную). Безрецидивная 4-летняя выживаемость с момента достижения полной ремиссии составила 24 % у больных, которым выполнили программу химиотерапии, и 62 % у больных, которым провели аллогенную ТКМ. Конечно, число анализируемых больных невелико.
Сравнительная оценка эффективности химиотерапии и аллогенной трансплантации костного мозга близнецовым методом
Кроме того, приведены результаты лечения, которое осуществляли в одном исследовательском центре, однако преимуществом этого исследования является то, что в анализ включены все заболевшие ОМЛ в одном географическом регионе и им четко выполнили программу лечения. Вывод однозначный — при наличии донора следует выполнять аллогенную ТКМ.
По данным Международного регистра, за период с 1988 по 1995 г. больным ОНЛЛ было выполнено в общей сложности 3503 аллогенных ТКМ от родственного донора и 208 от неродственного, 1403 аутологичных ТКМ. С учетом значительной селекции пациентов получены хорошие результаты у больных в первой ремиссии, во второй ремиссии и в развернутой фазе болезни. Более 5 лет без рецидива живут 59 % больных ОНЛЛ в первой ремиссии, 35 % во второй полной ремисии и 25 % больных, которым ТКМ была выполнена вне полной ремиссии.
Последние цифры — действительно уникальные результаты, поскольку при лечении больных ОМЛ во второй ремиссии и тех, у кого ремиссию не удается достичь, стандартные и даже агрессивные программы химиотерапии неэффективны. Выполнение аутоло-гичной ТКМ больным в первой полной ремиссии позволяет практически 50 % из них прожить более 5 лет. В том случае если аутологичную ТКМ выполняют больным во второй ремиссии, то безрецидивная выживаемость в течение 5—6 лет составляет 35— 40 %. Из тех больных, у которых не была достигнута полная ремиссия, без рецидива более 4 лет живут лишь 10 %. ТКМ от неродственного донора уступает по долгосрочным результатам как аутологичной, так и аллогенной родственной: более 4 лет без рецидива живут 40 % больных. Аллогенная ТКМ от неродственного донора характеризуется очень высокой летальностью в первые 100 дней и в течение 1-го года.
Приведенные данные свидетельствуют о том, что трансплантация костного мозга, как аллогенного, так и аутологичного костного мозга, можно рассматривать в качестве альтернативы стандартной современной химиотерапии для больных в первой ремиссии и считать единственным подходом, который предоставляет возможность определенному проценту больных во второй ремиссии или вне ремиссии прожить более 5 лет. Однако вновь хотелось бы остановиться на вопросах селекции, поскольку речь идет лишь о той категории больных, которым вообще возможно проведение ТКМ (возраст менее 45 лет, хороший соматический статус).
Выполнение как аутологичной, так и аллогенной трансплантации костного мозга у больных в период первой полной ремиссии ОМЛ не решает основных вопросов терапии этого заболевания, так как половина больных — лица старше 60 лет, полные ремиссии достигаются лишь у 2/3 больных моложе 60 лет, часть больных умирают в период консолидации, некоторые отказываются от предложенного лечения и т. д., однако ТКМ, особенно аллогенная, — это новый способ воздействия на опухолевые клетки. Аллогенная ТКМ, индуцируя такой феномен, как трансплантат против лейкоза, является эффективным противоопухолевым воздействием. Она может служить основой для моделирования и создания новых методов биологического лечения ОМЛ, не сопряженных, как сама ТКМ, с большим числом побочных эффектов.
Таким образом, трансплантация костного мозга — это этап в терапии ОЛ. Эту процедуру необходимо выполнять в специализированных центрах, где осуществляют не менее 10 аллогенных и 10 аутологичных ТКМ в год. Это условие представляется важным, иначе летальность, обусловленная развитием осложнений вследствие самой процедуры, будет очень высока, что естественным образом отразится на общей выживаемости больных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021