паренхима мозга у новорожденных что это такое
Паренхима мозга у новорожденных что это такое
Установление причины острой перинатальной гипоксии у детей вызывает большие трудности [1], вследствие которых в детском возрасте в 20-30 % случаев проходят под другими ошибочными диагнозами [3, 4].
Перинатальная гипоксия, повреждая цито-хемо-ангио-архитектонику нервной системы, приводит к полиорганным нарушениям, влияющим на адаптацию организма, степень тяжести и прогноз течения заболевания [1, 2].
Применяемые в клинической практике методы лечения постгипоксических изменений головного мозга у новорожденных, без учета анатомо-физиологических, возрастных особенностей детского организма.
Цель исследования – изучение клинических особенностей последствии постгипоксических изменений головного мозга у новорожденных.
Материалы и методы исследования
Методом ультразвуковой диагностики изучены нейросонографические признаки перинатальной постгипоксической энцефалопатии (ППЭ), выявлены клинические особенности постгипоксических повреждений головного мозга у новорожденных.
Изучены клинические особенности и результаты обследования головного мозга у 240 новорожденных с постгипоксическими повреждениями головного мозга.
Данная патология требует помимо клинико-неврологического обследования, эхоэнцефалографии, нейросонографии, исчерпывающих методик исследования: компьютерной томографии, магнитно-резонансной томографии, электроэнцефалографии, реоэнцефалографии, допплеросонографии, церебральной ангиографии.
В клинической практике используется адаптированная Международная Классификация Болезней X пересмотра, 2000 г.
Всем детям проведен дифференцированный комплекс консервативно-восстановительной терапии, адаптированный к особенностям возраста ребенка и нюансам морфологического субстрата в остром и реабилитационном периодах.
Результаты исследования и их обсуждение
Среди 240 новорожденных по срокам гестации преобладали доношенные дети 132 (55 %), недоношенные дети составили 108 (45 %). Изучение течения беременности выявило в 100 % случаев наличие патологического фактора – в 15 % случаев установлена патология плода: хроническая фетоплацентарная недостаточность, маловодие, в 85 % – патология матери: анемия, острые вирусные заболевания, гипертония, хронические заболевания.
Хроническая гипоксия плода, выявлена у 40 % беременных женщин. Среди новорожденных: 65 % дети (6-8 баллов по шкале Апгар) – в состоянии легкой степени тяжести асфиксии, дети средней степени тяжести и тяжелые составили соответственно 35 %.
Больные поступали в клинику в сроки от 1 часа до 9 суток от начала заболевания. До 60 % больных поступили из непрофильных клиник – обычных инфекционных больниц, после консультации невропатологов. Причиной поздней диагностики, является недостаточная осведомленность врачебного персонала об постгипоксических изменений головного мозга у новорожденных, сложность диагностики и необходимость дифференцировки с целой группой различных состояний.
У большинства детей в кругу семьи родственники страдали разнообразными цереброваскулярными заболеваниями и переносили инсульты головного мозга. У детей старшего возраста отмечались фоновые заболевания неврологического характера с элементами метеозависимости, протекавшие с обширной группой субъективных жалоб, эпизодами транзиторных нарушений мозгового кровообращения в прединсультном периоде.
При нейросонографических исследовании выявлены:
– перивентрикулярные кровоизлияния (ПВК) – 96 (40 %), с дилятацией желудочковой системы (гидроцефалией) – 48 (20 %), с ишемией подкорковых ядер – 24 (10 %);
– диффузные изменения мозговой ткани: отек мозговой паренхимы (36) и перивентрикулярная (субкортикальной) ишемия мозга (70).
Особенностью при УЗИ головного мозга острого периода ППЭ у 240 новорожденных являлось преобладание перивентрикулярной ишемии мозговой ткани (преимущественно у недоношенных новорожденных), с внутрижелудочковыми кровоизлияниями (преимущественно у доношенных новорожденных) и с отеком мозговой ткани (преимущественно у доношенных детей). Перивентрикулярная ишемия мозговой ткани – признак функциональной незрелости мозга [3,4] выявлялась и у недоношенных новорожденных, и у доношенных детей (15 %), что является проявлением нарушения мозгового кровообращения.
Отечность и ишемия мозговой ткани у детей с перенесенной гипоксией головного мозга, впервые появлялась именно в течение нескольких суток жизни.
Этиологическими факторами перинатальных поражений нервной системы у новорожденных явились: асфиксия у 75 % детей, у 10 % – инфекции, 8 % – эндокринные воздействия и 7 % – травма.
В острый период перинатальных поражений нервной системы у новорожденных чаще всего встречались следующие клинические синдромы:
– с повышенной нейрорефлекторной возбудимостью – 70 детей из 206 (34 %),
– в 2 раза реже встречались дети с синдромом общего угнетения – 17,5 %,
– в 7 раз реже – судорожный синдром (4,8 %).
У детей с церебральной ишемией в клинике преобладали синдромы возбуждения ЦНС, признаки внутричерепной гипертензии и угнетения ЦНС.
Среди новорожденных с внутричерепными кровоизлияниями в остром периоде ППЭ преобладали дети с ВЖК 2 степени (перивентрикулярными кровоизлияниями 2-3 степени) с доминированием в клинике признаков внутричерепной гипертензии, в том числе у 30 % пациентов – с развитием гидроцефального синдрома (у недоношенных новорожденных), а у 25 % детей – с симптомами угнетения ЦНС (у доношенных новорожденных).
У 25 % детей с ВЖК 2 степени выявлялся судорожный синдром (только у доношенных новорожденных).
Факт выявления клинических синдромов у части детей с отсутствием ультразвуковой патологии головного мозга во всех периодах перинатальной постгипоксической энцефалопатии (преимущественно в возрасте 1-3 месяца жизни), указывает на наличие нарушений мозговой гемодинамики как у новорожденных, подтвергшихся гипоксии, так и в более позднем возрасте.
При соотношении детей с ПВК различной степени тяжести встречались легкие формы патологии – 55 % детей с ПВК 1-2 степени.
Сочетанные формы патологии (ПВК и ишемии подкорковых ядер, гидроцефалии и ишемии подкорковых ядер) впервые выявлялся у детей 1-3 месяцев жизни (55 %), у 90 (37,5 %) детей – данная патология появлялась в возрасте от 4 до 9 месяцев, реже 18 (7,5 %) – в возрасте 6-30 дней.
Изучение обратного развития нейросонографических признаков ППЭ позволили установить, что компенсация патологии при образовании ее в остром периоде ППЭ (1 мес. жизни) составляет лишь 35 %, в раннем восстановительном периоде (1-3 мес. жизни) увеличивается почти в два раза – 75 %, а в позднем восстановительном периоде (4 мес.-З года жизни) сокращается до 31,4 %. Из 240 новорожденных с различными повреждениями нервной системы у 70 (27,5 %) компенсации патологии в дальнейшем не произошло.
Нейросонография является ценным методом диагностики постгипоксической патологии головного мозга у новорожденных, позволяющим вследствии неинвазивности, отсутствию лучевой нагрузки, возможности многократного исследования (мониторирование), не требуют специальной подготовки пациентов, выявлять сроки появления нейросонографических признаков ППЭ: ПВК, гидроцефалию, ишемические изменения мозговой ткани и подкорковых ядер, отечность мозговой паренхимы и их сочетания.
Профилактика перинатальной энцефалопатии заключается в возможной минимизации факторов риска при беременности, прежде всего в отказе матери от употребления потенциально опасных для ребенка веществ.
При соблюдении этих условий исключить перинатальную энцефалопатию, полностью нельзя. Своевременное лечение гарантирует полное выздоровление 20-30 % детей.
У остальных возможна незначительная мозговая дисфункция, вегето-сосудистая дистония, временная генерализация гидроцефального синдрома. В случае запоздалого диагностирования и лечебных процедур не исключены тяжелые исходы (ДЦП, эпилепсия, стойкое поражение ЦНС и прочие заболевания мозга), требующие очень серьезного долгого и дорогостоящего лечения [5].
Эти данные позволяет неонатологам, невропатологам и педиатрам более точно оценивать динамику постгипоксических изменений головного мозга у новорожденных и детей первых трех лет жизни, компенсаторные возможности и адаптационные резервы детского организма.
Микрососудистое УЗИ паренхимы головного мозга новорожденных: возможности, применение и нормальная визуализация с помощью SMI – Superb microvascular imaging
Авторы: Katharina Goeral, Azadeh Hojreh, Gregor Kasprian, Katrin Klebermass-Schrehof, Michael Weber, Christian Mitter, Angelika Berger, Daniela Prayer, Peter C. Brugger, Klara Vergesslich-Rothschild, and Janina M.
Оценить выполнимость SMI головного мозга новорожденного и описать нормальные особенности визуализации.
Мы провели транскраниальное ультразвуковое исследование с SMI у 19 здоровых новорожденных. SMI проводилась в соответствии со структурированным протоколом обследования с использованием двух линейных датчиков 18 МГц и 14 МГц. Поверхностные и глубокие снимки были получены в корональной и сагиттальной плоскостях, используя левую и правую верхнюю лобную извилину в качестве анатомических ориентиров.
Введение
Внутрипаренхиматозная сосудистая сеть мозга состоит из иерархической сети мелких артерий, вен и капилляров. Главные артериальные стволы снабжают головной мозг, разветвляясь на перфорантные артерии проксимально и пиальные кортикальные артерии – периферически. Пиальные артерии расходятся на внутрикортикальные, подкорковые и медуллярные артерии, которые снабжают кору, в то время как белое вещество головного мозга снабжается исключительно медуллярными артериями.
Помимо инвазивных процедур, визуализация сосудов головного мозга новорожденных возможна in vivo с использованием КТ и МРТ. КТ ограничивается использованием радиации и необходимостью для внутривенного введения контрастного вещества и МРТ из-за сложной логистики и применения седативных препаратов при визуализации новорожденных. При диаметрах 100–200 мкм внутрипаренхимальные сосуды головного мозга обычно остаются ниже пространственного разрешения методов клинической визуализации, включая КТ и МРТ (напряженность поля до 3 Тесла).
У новорожденных с открытыми родничками транскраниальное УЗИ (ТУЗИ) используется в качестве метода визуализации первой линии благодаря широкой доступности с возможностью использования у кровати, низкой стоимостью, безопасным для пациента профилем безопасности и высоким разрешением изображения.
Недавно УЗИ сосудистой системы получило новый поворот благодаря созданию инновационного метода, который называется SMI. SMI развился как новый инструмент для неинвазивной визуализации микроциркуляторного русла без использования внутривенного контрастного материала. Этот метод использует расширенное подавление помех и обрабатывает доплеровские сигналы с низким расходом, которые в противном случае фильтруются и удаляются как «шумы». Преимуществами являются высокое разрешение и частота кадров, а также визуализация низкоскоростного потока. Доступны два режима: монохромный SMI (mSMI) и цветной SMI (cSMI). cSMI отображает компоненты с низким расходом в цвете, наложенном на серое изображение с высоким временным и пространственным разрешением одновременно. mSMI показывает микроциркуляторное русло с еще более высокой чувствительностью, вычитая анатомический фон.
Ишикава и соавторы использовали SMI для визуализации опухолевых сосудов и краев опухоли во время операции на открытом мозге у взрослых. Что касается применения в педиатрии, SMI оказался полезным в оценке пузырно-уретрального рефлюкса, а также в неопущенных яичках.
В настоящее время мало известно о морфологии микрососудистой структуры человеческого мозга in vivo после рождения. Наше исследование направлено на визуализацию микрососудов головного мозга новорожденных с помощью ультразвукового исследования SMI. Во-первых, выполнимость и воспроизводимость SMI оценивается в когорте новорожденных. Во-вторых, описаны нормальные особенности SMI в здоровом мозге новорожденных.
Методы
Мы провели проспективное одноцентровое исследование изображений новорожденных, родившихся в срок: для основного исследования в отделение годичной педиатрии и подростковой медицины Медицинского университета Вены, Австрия, было включено 19 новорожденных в течение 1 года. Критерии включения были определены следующим образом: доношенные новорожденные с хорошей постнатальной адаптацией без неврологических нарушений или подозрений на церебральные патологии. История болезни во время беременности должна была быть ничем не примечательной, пренатальное УЗИ центральной нервной системы должно было быть нормальным. Поэтому новорожденные с хромосомными аномалиями, постнатальным неврологическим дефицитом или любым поражением головного мозга, диагностированным пренатальным или постнатальным УЗИ, были исключены из участия в исследовании. Информированное согласие было получено у всех пациентов. Исследование было одобрено Комитетом по этике Медицинского университета Вены.
Все участники прошли стандартное транскраниальное ультразвуковое исследование с использованием сканера Toshiba Aplio 400 в течение первых недель жизни в бодрствующем состоянии. Микроконвексный датчик (11 МГц) был помещен на открытый передний родничок для получения коронального и сагиттального стандартных изображений. Кроме того, было получено допплеровское изображение и резистивные показатели из внутренней сонной артерии и передней мозговой артерии.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
SMI – получение и интерпретация изображений
SMI было выполнено и задокументировано с использованием предварительно определенного протокола обследования двумя сертифицированными специалистами педиатрическими рентгенологами, с более чем 5-летним опытом в ультразвуковом исследовании новорожденных и анатомическими знаниями ангиоархитектуры паренхимы головного мозга. Протокол обследования включал поверхностное и глубокое сканирование. Поверхностные сканы были получены с использованием линейного 18 МГц датчика и захватили корональные и сагиттальные плоскости левой и правой верхней лобной извилины( F1) (рис. 1 и 2). F1 был выбран из-за близости к передней части родничка и, таким образом, оптимальной сонографической доступности. Максимальная глубина увеличения при поверхностном сканировании составляла 2,5 см. Глубина поверхностного сканирования составила 1,7 см. Настройки SMI составляли 7,2 МГц (доплеровская частота), 21 кГц (импульсно-волновая частота) и усиление цвета 45–50. Глубокие сканы были получены только в корональной плоскости с использованием линейного датчика 14 МГц (рис. 3). SMI глубина глубокого сканирования составляла 5–6 см. Настройки SMI составляли 7 МГц (доплеровская частота), 9 кГц (импульсно-волновая частота) и усиление цвета 45–50. Для типичного ультразвукового исследования параметры безопасности были следующими: механический индекс 0,8–1,5, тепловой индекс кости 0,6–0,8 и тепловой индекс мягких тканей 0,6–0,8.

Рисунок 1: Поверхностное сканирование: корональный вид правой верхней лобной извилины в режиме B (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют кортикальные (короткая стрелка) и медуллярные (стрелка) сосуды
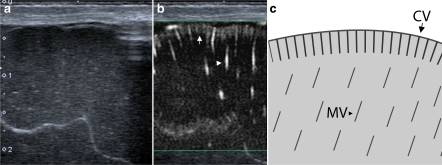
Рисунок 2: Поверхностное сканирование: сагиттальный вид правой верхней лобной извилины в режиме B (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют кортикальные (короткая стрелка) и медуллярные (стрелка) сосуды

Рисунок 3: Глубокое сканирование: корональное изображение в B-режиме (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют экстрастриатарные (корковые [короткая стрелка], медуллярные [стрелка]) и стриатарные (тонкая стрелка) сосуды.
Все предварительно определенные виды были отображены с помощью монохромного и цветного SMI с использованием настроек, предоставленных производителем. Видеопоследовательности в оттенках серого были получены и задокументированы дважды подряд, в то время как цветовые последовательности были запечатлены и задокументированы один раз для каждой анатомической области. Минимальная продолжительность каждой видеопоследовательности составляла 5 с. Видеопоследовательности SMI были сохранены и просмотрены с использованием AGFA PACS. На основании наблюдений радиологических признаков, сделанных во время получения изображений, была разработана и использована структурированная полуколичественная схема считывания: по этой схеме сосуды классифицировались как видимые или невидимые. В частности, мы различали две основные сосудистые территории: экстрастриарные сосуды (снабжающие кору и белое вещество) и стриарные сосуды (снабжающие хвостатое и лентиформное ядро). Эти сосуды были оценены как видимые, если они выглядели как яркие эхогенные криволинейные структуры на видеопоследовательностях mSMI или как красные криволинейные структуры на последовательностях cSMI.
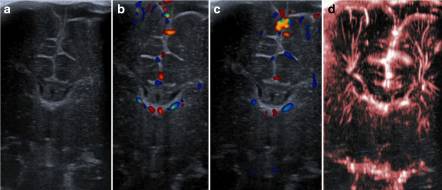
Рисунок 4: Сравнение УЗИ и SMI: глубокий корональный обзор в режиме B (a), цветное ультразвуковое допплеровское исследование (b, c) и сSMI (d)
Корковые микрососуды выглядят как короткие гиперэхогенные, параллельные полосы, перпендикулярные поверхности мозга на корональных и сагиттальных изображениях. Медуллярные микрососуды проявляются как криволинейные гиперэхогенности в белом веществе, демонстрирующие характерную «фонтаноподобную» морфологию на корональных изображениях. На сагиттальных сканах они показывали прямое направление. Глубокий коронарный SMI показал полосатые микрососуды, выглядящие как криволинейные гиперэхогенные полосы в форме цветка лотоса, проходящие через таламус и базальные ганглии (рис. 5).
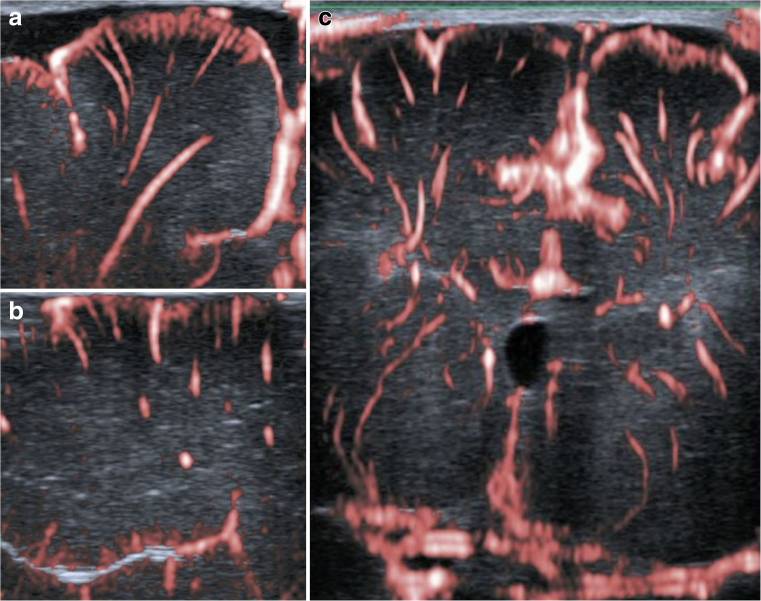
Рисунок 5: сSMI: корональные (а), сагиттальные (б) и глубокие корональные (с) изображения, демонстрирующие экстрастриатарные и стриатарные сосуды, наложенные на B-режим
С клинической точки зрения следует подчеркнуть, что существует большой потенциал для использования SMI для исследования головного мозга новорожденных: гипоксическая ишемическая энцефалопатия, церебральные пороки развития, инфекции и преждевременные роды являются состояниями, связанными с микрососудистыми нарушениями. После ишемии SMI может позволить выявить и контролировать постгипоксическую гиперперфузию (рис. 6). У недоношенных новорожденных с внутрижелудочковым кровоизлиянием SMI может позволить раннее выявление венозного скопления и перивентрикулярного инфаркта после внутрижелудочкового кровоизлияния.
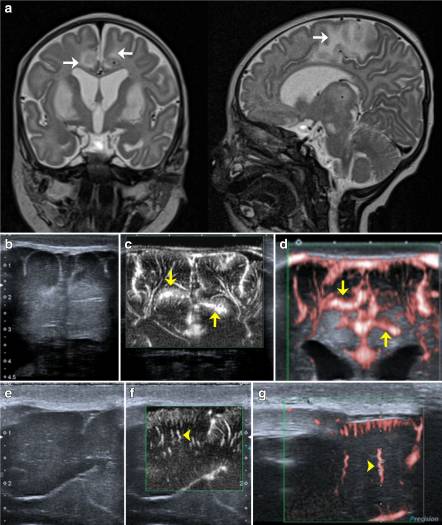
Рисунок 6: Патологический пример: пациент 3-месячного возраста с митохондриальной болезнью (болезнь Ли). В то время как МРТ показала метаболические инфаркты и сигнальные изменения базальных ганглиев и коры (a; белая стрелка), в коронарной mSMI наблюдалась постгипоксическая кортикальная гиперперфузия (c и d; желтая стрелка). Кроме того, SMI показал удлиненные и извилистые медуллярные микрососуды (f и g; желтая стрелка), которые были подтверждены гистологией (не показано)
Оглавление
К сожалению, далеко не всегда роды проходят идеально. Примерно в 80 % случаев возникают те или иные проблемы. Они могут касаться как слабой родовой деятельности, так и обвития малыша пуповиной, затяжных родов, болезненных потуг и др. Возникшие трудности обычно устраняются без вреда для новорожденного и его мамы. Если по каким-то причинам проблемы не были устранены и существует вероятность получения ребенком повреждений или наличия у него врожденных аномалий головного мозга, проводится нейросонография (НСГ).
Что такое нейросонография?
Нейросонография головного мозга – диагностическая процедура, которая стала проводиться относительно недавно. Она позволяет изучить головной мозг новорожденного с помощью ультразвука. Проводится НСГ как по направлению неонатолога, так и с целью профилактического осмотра. Раньше такая диагностика проводилась только в самых опасных случаях. Сегодня нейросонография головного мозга у детей назначается практически повсеместно. Методика пришла на смену МРТ.
Важно! Магнитно-резонансная томография достаточно опасна для ослабленного организма младенцев и может спровоцировать ряд серьезных осложнений.
В отличие от МРТ нейросонография головного мозга новорожденных максимально безопасна. Проводиться она может в первые же минуты жизни крохи. Современная диагностика позволила существенно сократить уровень смертности новорожденных благодаря быстрому обнаружению у них патологий головного мозга.
Показания к проведению обследования
Нейросонография новорожденных проводится с целью определения состояний:
Ультразвуковое исследование позволяет обнаружить:
Также во время диагностики определяются симптомы повышения внутричерепного давления, состояние нервов, выявляются различные патологии. Как правило, прохождение НСГ рекомендуют в профилактических целях.
Нейросонография ребенку может быть назначена при:
Исследование проводится не только малышам в первые дни жизни. Нередко назначается нейросонография в месяц, в год. В некоторых случаях диагностика проводится даже взрослым пациентам. Применяемый метод исследования называют уже не «нейросонография», а «УЗИ мозга». К современному методу исследований прибегают при травмах и во время оперативных вмешательств или после их завершения.
Безопасно ли обследование?
Нейросонография мозга – исследование, которое является абсолютно безопасным. Ультразвуковая диагностика проходит безболезненно. При этом ребенок не нуждается в специальной подготовке или восстановлении после процедуры. Доказанных фактов того, что ультразвуковые исследования негативно сказываются на здоровье детей в отдаленном периоде, не существует. Благодаря этому нейросонография проводится всем малышам (даже тем, которые находятся в реанимационных кювезах).
Виды нейросонографии
Существует несколько вариантов проведения нейросонографии. Методика выполнения зависит от того, как осуществляются диагностические манипуляции.
Различают следующие виды нейросонографии:
Выбор в пользу того или иного вида исследования делает врач. Зависит такой выбор от возраста пациента, его индивидуальных особенностей, способов проведения диагностики и ее целей.
Особенности процедуры
Основной особенностью процедуры является то, что она может проводиться только через щели черепа. Это обусловлено тем, что ультразвуковые волны не проходят через окрепшие кости. Благодаря этому проще всего выполнять обследование новорожденных.
Нейросонография – эффективная методика, не имеющая противопоказаний.
К ее достоинствам также относят:
Нейросонография позволяет подтвердить или опровергнуть предполагаемый диагноз, скорректировать проводимое лечение, выявить скрытые патологии, которые невозможно обнаружить путем проведения других обследований. При этом методика проста в реализации и доступна для многих.
Как проводится?
Обследование проводится с использованием стандартного ультразвукового аппарата.
Для осуществления обследования необходимо снять с головы шапочку или другой головной убор, заколки, бантики и др. Удобнее всего держать ребенка на руках. Так малыш успокоится и не будет совершать ненужных движений во время процедуры. На область исследования врач нанесет специальный гель (он абсолютно безопасен и не вызывает аллергических реакций), обеспечивающий улучшение проводимости ультразвука. После этого специалист выполнит непосредственно диагностику. Он будет водить датчиком по голове, но эти движения не вызовут у малыша неприятных ощущений. На мониторе специалист будет видеть динамическое изображение всех внутренних структур.
По окончании обследования вы получите заключение о состоянии головного мозга и тканей. За расшифровкой полученных результатов следует обратиться к врачу, который наблюдает вашего ребенка или дал направление на нейросонографию.
Нужно ли готовиться к диагностике?
Процедура не предполагает дополнительной подготовки.
Маме или другому человеку, который пришел на обследование с малышом, следует:
Никаких дополнительных рекомендаций не выдается. Не нужно как-то по-особенному кормить ребенка или ограничивать его в потреблении жидкости. Исследование ничем не отличается от традиционного УЗИ.
Расшифровка показателей исследования
Расшифровывать полученные результаты исследования должен специалист. Это связано с тем, что при оценке всех показателей врач ориентируется на вес ребенка и другие его индивидуальные особенности, уже выявленные патологии и перенесенные заболевания. Следует отметить и то, что у новорожденных практически в 70 % случаев обнаруживаются некоторые отклонения в развитии головного мозга. Они не являются критичными и не говорят об опасных патологических состояниях. В течение первого же года жизни все показатели обычно приходят в норму. Это не имеет негативных последствий для здоровья крохи. Как правило, небольшие отклонения становятся поводом для регулярного наблюдения за состоянием малыша. О необходимости (если она будет выявлена) в постоянном контроле сообщит врач.
При расшифровке показателей исследования внимание уделяется таким важным параметрам, как:
Нормы и отклонения показателей
В протоколе исследования врач указывает:
Важно! Об отклонениях от нормы вам обязательно расскажет врач. Он же объяснит все результаты полученного обследования. Не пытайтесь провести самостоятельную расшифровку. Для неспециалиста все цифры и различные описания совершенно непонятны. Кроме того, существуют различия в показателях, зависящие от возраста маленького пациента.
Где проводится диагностика?
Нейросонография – диагностика, которая сегодня проводится во всех крупных перинатальных центрах. Она проводится бесплатно сразу после рождения малыша (при наличии показаний). В профилактических целях исследование осуществляется только на платной основе. Цена нейросонографии головного мозга новорожденных и других пациентов зависит от ряда факторов. Уточнить ее вы всегда можете заранее.
Важно! Платную диагностику следует проводить только в известных медицинских учреждениях, располагающих современным оборудованием. Очень важно заранее уточнить, кто осуществляет исследование. Врач должен обладать всеми необходимыми профессиональными знаниями и навыками.
Преимущества проведения диагностики в МЕДСИ
Для записи на исследование достаточно позвонить Специалист озвучит точную стоимость диагностики и расскажет о том, как она проводится в нашей клинике.

