основную часть болевой чувствительности передает в головной мозг какой тракт
Основную часть болевой чувствительности передает в головной мозг какой тракт
Хотя все болевые рецепторы являются свободными нервными окончаниями, они используют два раздельных пути для передачи сигналов в центральную нервную систему. Эти пути в основном соответствуют двум типам боли: путь быстрой (острой) болим путь медленной (хронической) боли.
В связи с этой двойной системой болевой иннервации в ответ на внезапный болевой стимул часто возникает двойственное болевое ощущение: быстрая (острая) боль, передаваемая в мозг волокнами типа Аδ, и примерно через секунду развивается медленная боль, которая передается волокнами типа С. Острая боль быстро информирует о повреждающем влиянии и, следовательно, играет важную роль в инициации немедленной реакции человека, позволяющей ему устраниться от стимула. Медленная боль со временем обычно усиливается. Это ощущение в итоге вызывает невыносимые страдания, связанные с длительной болью, и заставляет человека делать все возможное, чтобы удалить источник боли.
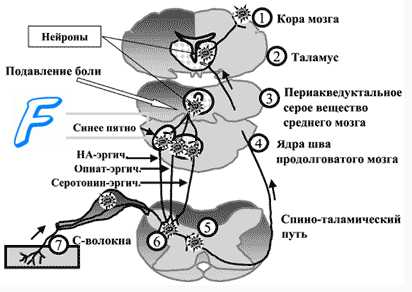
Войдя в спинной мозг через его задние корешки, болевые волокна заканчиваются на переключающих нейронах задних рогов. Здесь, как видно на рисунках ниже, также есть две системы обработки болевых сигналов на их пути в головной мозг.
б) Два пути болевых сигналов в спинном мозге и мозговом стволе. Неоспиноталамический и палеоспиноталамический тракты. После входа в спинной мозг болевые сигналы направляются в головной мозг по двум путям:
(1) неоспиноталамическому тракту;
(2) палеоспиноталамическому тракту.
1. Неоспиноталамический тракт для проведения быстрой боли. Быстрые болевые волокна типа Аδ передают главным образом сигналы механической и острой термической боли. Они заканчиваются в основном на уровне I пластины (краевой) заднего рога, как показано на первом рисунке выше, и возбуждают нейроны второго порядка неоспиноталами-ческого тракта. Они дают начало длинным волокнам, которые сразу же переходят на противоположную сторону спинного мозга через переднюю комиссуру и затем поднимаются вверх к головному мозгу в составе переднебоко-вых столбов.
2. Окончание неоспиноталамического тракта в стволе мозга и в таламусе. Немногие волокна неоспиноталамического тракта заканчиваются в ретикулярных областях ствола мозга, но большинство проходят весь путь к таламусу без перерыва, заканчиваясь в вентробазальном комплексе вместе с трактом задних столбов/медиальной петли для тактильных ощущений. Небольшое число волокон переключается также в задней группе ядер таламуса. Из этих таламических областей сигналы передаются к другим областям основания мозга, а также к соматосенсорной коре.
3. Способность нервной системы локализовать источник быстрой боли в организме. Источник быстрой (острой) боли в разных частях тела локализуется гораздо точнее, чем источник медленной (хронической) боли. Однако если стимулируются только болевые рецепторы без одновременного возбуждения тактильных, быстрая боль тоже плохо локализуется, часто лишь в пределах 10 см от стимулируемой зоны. Если же одновременно стимулируются тактильные рецепторы, возбуждающие систему задних столбов/медиальной петли, то возможна практически точная локализация.
Глутамат — возможный нейромедиатор волокон быстрой боли. Полагают, что окончания болевых волокон типа Аδ в спинном мозге выделяют медиатор глутамат. Это один из наиболее широко распространенных возбуждающих медиаторов в центральной нервной системе, длительность действия которого составляет лишь несколько миллисекунд.
Видео проводящие пути болевой и температурной чувствительности
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Основную часть болевой чувствительности передает в головной мозг какой тракт
Боль определяется как неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения. В отличие от других сенсорных модальностей боль всегда субъективно неприятна и служит не столько источником информации об окружающем мире, сколько сигналом повреждения или болезни. Болевая чувствительность побуждает к прекращению контактов с повреждающими факторами среды.
Болевые рецепторы или ноцицепторы представляют собой свободные нервные окончания, расположенные в коже, слизистых оболочках, мышцах, суставах, надкостнице и во внутренних органах. Чувствительные окончания принадлежат либо безмякотным, либо тонким миелинизиро-ванным волокнам, что определяет скорость проведения сигналов в ЦНС и дает повод к различению ранней боли, короткой и острой, возникающей при проведении импульсов с большей скоростью по миелиновым волокнам, а также поздней, тупой и длительной боли, в случае проведения сигналов по безмякотным волокнам. Ноцицепторы относятся к полимодальным рецепторам, поскольку могут активироваться стимулами разной природы: механическими (удар, порез, укол, щипок), термическими (действие горячих или холодных предметов), химическими (изменение концентрации ионов водорода, действие гистамина, брадикинина и ряда других биологически активных веществ). Порог чувствительности ноцицепторов высок, поэтому лишь достаточно сильные стимулы вызывают возбуждение первичных сенсорных нейронов: например, порог болевой чувствительности для механических стимулов примерно в тысячу раз превышает порог тактильной чувствительности.
Центральные отростки первичных сенсорных нейронов входят в спинной мозг в составе задних корешков и образуют синапсы с нейронами второго порядка, расположенными в задних рогах спинного мозга. Аксоны нейронов второго порядка переходят на противоположную сторону спинного мозга, где образуют спиноталамический и спиноретикулярный тракты. Спиноталамический тракт оканчивается на нейронах нижнего заднелате-рального ядра таламуса, где происходит конвергенция проводящих путей болевой и тактильной чувствительности. Нейроны таламуса образуют проекцию на соматосенсорную кору: этот путь обеспечивает осознаваемое восприятие боли, позволяет определять интенсивность стимула и его локализацию.
Волокна спиноретикулярного тракта оканчиваются на нейронах ретикулярной формации, взаимодействующих с медиальными ядрами таламуса. При болевом раздражении нейроны медиальных ядер таламуса оказывают модулирующее влияние на обширные регионы коры и структуры лимбической системы, что приводит к повышению поведенческой активности человека и сопровождается эмоциональными и вегетативными реакциями. Если спиноталамический путь служит для определения сенсорных качеств боли, то спиноретикулярный путь предназначен играть роль сигнала общей тревоги, оказывать на человека общее возбуждающее действие.
Субъективную оценку боли определяет соотношение нейронной активности обоих путей и зависимая от нее активация антиноцицептивных нисходящих путей, способных изменить характер проведения сигналов от ноцицепторов. В сенсорную систему болевой чувствительности встроен эндогенный механизм ее уменьшения путем регуляции порога синаптических переключений в задних рогах спинного мозга («ворота боли»). На передачу возбуждения в этих синапсах влияют нисходящие волокна нейронов серого вещества вокруг водопровода, голубого пятна и некоторых ядер срединного шва. Медиаторы этих нейронов (энкефалин, серотонин, норадреналин) тормозят активность нейронов второго порядка в задних рогах спинного мозга, чем уменьшают проведение афферентных сигналов от ноци-цепторов.
Аналгезирующим (обезболивающим) действием обладают опиатные пептиды (дайнорфин, эндорфины), синтезируемые нейронами гипоталамуса, которые имеют длинные отростки, проникающие в другие отделы головного мозга. Опиатные пептиды присоединяются к специфическим рецепторам нейронов лимбической системы и медиальной области таламуса, их образование увеличивается при некоторых эмоциональных состояниях, стрессе, продолжительных физических нагрузках, у беременных женщин незадолго перед родами, а также в результате психотерапевтического воздействия или акупунктуры. В результате повышенного образования опиатных пептидов активируются антиноцицептивные механизмы и повышается порог болевой чувствительности. Баланс между ощущением боли и ее субъективной оценкой устанавливается с помощью лобных областей мозга, участвующих в процессе восприятия болевых стимулов. При поражении лобных долей (например, в результате травмы или опухоли) порог болевой чувствительности не изменяется и поэтому сенсорный компонент болевого восприятия сохраняется неизменным, однако субъективная эмоциональная оценка боли становится иной: она начинает восприниматься лишь как сенсорное ощущение, а не как страдание.
Основную часть болевой чувствительности передает в головной мозг какой тракт
Согласно определению Международной ассоциации по изучению боли, боль — это неприятное чувствительное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения.
В этом определении сделан акцент на аффективном (эмоциональном) компоненте боли. Другой компонент боли — чувствительно-дискриминационый («Где и как сильно?»).
а) Периферические пути болевой чувствительности. За проведение болевых ощущений отвечают тонкие миелинизированные (А6) и немиелинизированные (С) волокна, исходящие от униполярных клеток спинномозгового ганглия. Иногда эти волокна называют «волокнами боли», хотя существуют и другие нервные волокна сравнимого диаметра, которые являются исключительно механорецепторными. В то же время другие волокна, связанные, например, с механорецепторами или терморецепторами, вызывают чувство боли только при работе на высокой частоте. В общем плане обсуждения боли последние волокна называют полимодальными ноцицепторами.
В составе спинномозговых нервов находятся дистальные отростки ганглионарных клеток, иннервирующих соматические ткани, в том числе кожу, париетальную плевру и брюшину, мышцы, суставные капсулы и кости. Проксимальные отростки отдают ветви на уровне зоны выхода задних корешков, далее в составе дорсолатерального пути Лиссауэра поднимаются вверх, пропуская пять или более сегментов спинного мозга, а затем оканчиваются в пластинах I, II и IV заднего рога. Аналогичные волокна тройничного нерва оканчиваются в спинномозговом ядре тройничного нерва.
Дистальные нервные отростки, направляющиеся от внутренних органов, имеют общую периневральную оболочку с постганглионарными волокнами симпатического ствола. Проксимальные отростки пересекаются с волокнами пути Лиссауэра и заканчиваются в этой же области. Считают, что перекрест соматических и висцеральных афферентных окончаний на дендритах центральных болевых нейронов объясняет возникновение отраженной боли при таких состояниях, как инфаркт миокарда или острый аппендицит.
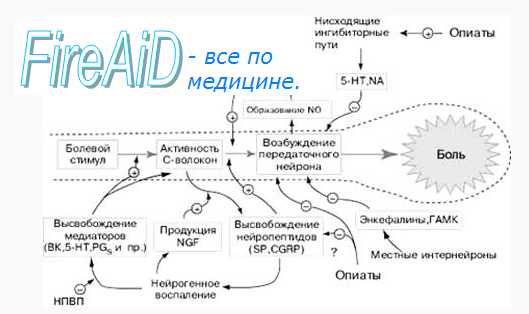
б) Сенситизация ноцицепторов. При повреждении тканей из них происходит выброс различных активных веществ — брадикининов, простагландинов и лейкотриенов, которые понижают порог возбудимости ноцицепторов. При повреждении С-волокон происходит также активация аксон-рефлексов, в окружающие ткани высвобождаются субстанция Р и кальцитонин ген-связанный пептид (CGRP), стимулируя выброс гистамина тучными клетками. Гистаминовые рецепторы, которые могут располагаться на нервных окончаниях (Глава 8), способы стимулировать синтез арахидоновой кислоты за счет гидролиза мембранных фосфолипидов.
Фермент циклооксигеназа превращает арахидоновую кислоту в простагландины. (Механизм действия аспирина и других нестероидных противовоспалительных препаратов заключается в угнетении этого фермента и снижении синтеза простагландинов.)
В результате возникают длительная активация большого числа С-волокон и сенситизация механических ноцицепторов. Клинически это проявляется аллодинией, при которой даже легкое прикосновение к какой-то области вызывает болевые ощущения, и гипералгезией, когда даже незначительные болезненные стимулы воспринимают как сильнейшую боль.
Для синдрома раздраженного кишечника характерна сенситизация ноцицептивных интерорецепторов брюшной стенки. Такой механизм развития болевого синдрома характерен также для интерстициального цистита.
Сенситизация нейронов С-волокон может также происходить за счет изменения транскрипции генов, когда аномальные натриевые каналы встраиваются в клеточную мембрану нейронов заднего спинномозгового ганглия. В этом месте может возникать спонтанная электрическая активность, которая, как считают, может быть ответственна за неэффективность анальгетиков, блокирующих проведение нервного импульса на высоких уровнях.
в) Нейропатическая боль. При рассечении периферического нерва его проксимальная и дистальная культи оказываются разделенными формирующейся рубцовой тканью. На аксонах, захваченных в этой рубцовой ткани, формируются небольшие нитевидные утолщения — невромы, которые очень чувствительны к сдавлению. При их длительной активации страдания пациента усиливаются, поскольку у него развивается синдром центральной боли. Постгерпетическая невралгия — это нейропатическая боль, которая становится следствием перенесенной инфекции herpes zoster («опоясывающий лишай») и проявляется появлением везикул вдоль зоны иннервации кожного нерва, обычно межреберного.
Вирус может поддерживать боль за счет активации механизма транскрипции генов, который был описан выше. Центральные пути болевой чувствительности Центральные ноцицептивные нейроны подразделяют на две группы—специфические, с небольшой зоной периферической иннервации (около 1 см 2 ), а также имеющие широкий динамический диапазон (более 2 см 2 ). Это механические ноцицепторы, которые кодируют тактильные стимулы как импульсы низкой чистоты и болевые стимулы как импульсы высокой частоты.
Согласно общепринятому мнению, спиноталамический путь (или переднебоковой, учитывая его расположение в спинном мозге) состоит из различных волокон, которые отвечают как за различение болевых, температурных и тактильных стимулов (неоспиноталамический, или прямой, путь), так и за аффективную, двигательную и вегетативную реакции на боль (палеоспиноталамический, или непрямой, путь).
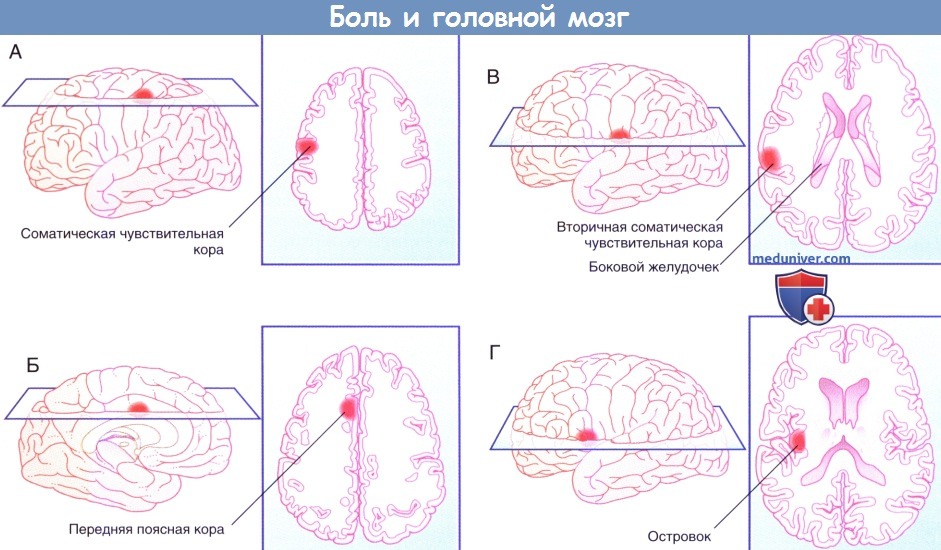
г) Прямой путь болевой чувствительности. Прямой путь для туловища и конечностей начинается от заднего рога спинного мозга и в составе спиноталамического пути направляется к задней части вентрального заднелатерального ядра таламуса с противоположной стороны. На голове и шее он начинается в спинномозговом ядре тройничного нерва и по тройнично-таламическим волокнам идет к задней части медиального ядра противоположного таламуса. Отсюда волокна преимущественно направляются к первичной соматической чувствительной коре (SI) и частично к верхней части латеральной борозды (SII). Установлена соматотопическая организация этой области, что удалось выявить при помощи проведения ПЭТ головного мозга во время воздействия теплового стимула на различные участки лица.
Благодаря исследованиям на животных обнаружили, что в SI имеются высоковозбудимые специфические ноцицептивные нейроны, рецепторное периферическое поле которых относительно невелико. Именно эти нейроны лучше всего отвечают на вопрос «Где и как сильно болит?».
На рисунках ниже изображены проекции к задней теменной коре и SII.
Понятно, что спиноталамическая система раннего оповещения отвечает за поворот глаз и головы в сторону источника боли. Спинопокрышечный путь направляется наверх вдоль спиноталамического пути и заканчивается в верхних холмиках. Он также организован соматотопически. Волокна этого пути обеспечивают работу зрительного рефлекса, который поворачивает глаза/туловище/конечности в сторону стимулируемой области. Помимо активации этого филогенетически древнего пути (он имеется уже у рептилий), зрительный путь, отвечающий на вопрос «Где?», также связан с волокнами, идущими к задней теменной коре от SI.
В SII число ноцицептивных нейронов меньше, однако они также могут получать зрительную информацию. Они связаны с островком, который получает импульсы непосредственно от таламуса. При стимуляции островка в организме возникают вегетативные реакции (повышение частоты сердечных сокращений, вазоконстрикция, потоотделение). Интересно, что при повреждении островка человек перестает воспринимать болевые стимулы как неприятные, но при этом он все еще может локализовать стимул и определять его интенсивность. Такое состояние называют асимболией боли.
д) Непрямой путь болевой чувствительности. Непрямой путь — полисинаптический, в составе спиноретикулярного и тройнично-ретикулярного путей он направляется к дорсальному медиальному ядру таламуса, проецируясь (в том числе) к передней поясной коре. Эта область отвечает за аффективный компонент боли. Доказательством этого служит тот факт, что у пациентов с хроническим болевым синдромом успешно выполняют хирургическое пересечение (цингулотомию) или удаление (цингулэктомию) поясной коры. Пациенты сообщают, что сила болевых ощущений не изменилась, но боль при этом не кажется им такой нестерпимой. Точно такой же эффект дают инъекции морфия, вероятно, потому, что в передней поясной коре сосредоточено наибольшее число опиоидных рецепторов.
После цингулэктомии часто возникает отек участка мозга, осуществляющий контроль за мочевым пузырем. В связи с этим в течение какого-то времени пациентов может беспокоить недержание мочи. Однако, что важнее, более чем у половины больных после операции развивается «аффективное уплощение» — люди перестают испытывать как положительные, так и отрицательные эмоции.
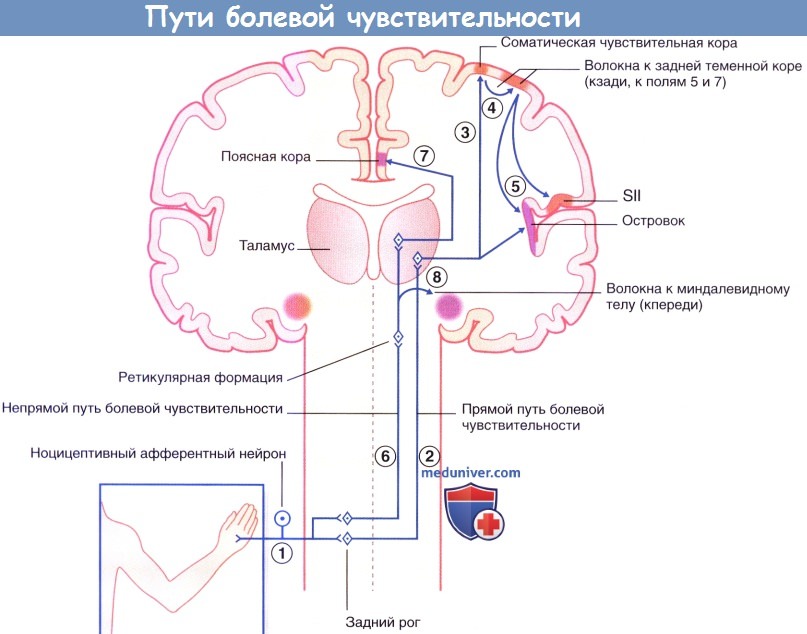
1. Периферические ноцицептивные нейроны, отдающие волокна к заднему рогу.
2. «Быстрые» центральные проецирующие боль нейроны (ЦПБН) отдают волокна непосредственно к противоположному заднебоковому таламусу и
3. Переключаются на соматическую чувствительную кору (SI). 4. Ассоциативные волокна соединяют SI с задней теменной корой, где происходит анализ тактильных ощущений («Где?» и «Как сильно»?), а также зрительное ориентирование («Откуда?»).
5. От задней теменной коры волокна идут к SII, где происходит интеграция тактильных и зрительных ощущений. Спереди происходит переключение на кору островка, куда могут также поступать импульсы от таламуса. Этот участок коры отвечает за вегетативные и эмоциональные реакции.
6. «Медленные» ЦПБН через ретикулярную формацию передают сигнал к медиальному таламусу. Волокна направляются также кпереди, в префронтальную кору (здесь не показана), где ощущения подвергаются комплексному анализу.
7. Волокна направляются вверх к поясной коре, где в норме возникает реакция эмоционального отвращения («избегание»),
8. Некоторые ЦПБН возбуждают нейроны ретикулярной формации, которые сообщаются с миндалевидным телом. Эти связи обеспечивают возникновение испуга.
е) Центральная боль. Центральная боль практически всегда возникает вследствие активации центральных проецирующих боль нейронов (ЦПБН) спиноталамического и спиноретикулярного путей. За эти процессы отвечают следующие три механизма.
• Длительная активация глутаматных NMDA-рецепторов стимулами от заднего корешка, которую наблюдают в течение нескольких недель или месяцев. В результате развивается долгосрочная потенциация ЦПБН.
• Порог возбудимости ЦПБН может еще больше снижаться путем запуска транскрипции определенных генов за счет появления дополнительных глутаматных рецепторов на их нейронах.
• Для третьего механизма лучше всего подходит определение «парадоксальный». Этот механизм уже описан в отдельной статье на сайте при обсуждении супраспинальной антиноцицептиеной системы, когда серотонинергические нейроны, проецирующиеся от большого ядра шва (БЯШ) среднего мозга, могут тормозить активность ЦПБН за счет активации энкефалинергических вставочных нейронов. Исследования на животных показали, что хотя для появления центральной боли может быть достаточно одного из первых двух механизмов, для ее поддержания необходимо, чтобы несеротонинергические нейроны БЯШ облегчили возбудимость ЦПБН. Действие этих нейронов обусловлено неизвестным возбуждающим нейромедиатором. Самый очевидный пример такой боли—фантомная боль, при которой сильные болевые ощущения возникают в дистальной части ампутированной конечности.
Один из видов центральной боли — таламическая боль, которая возникает при инсульте в области белого вещества около заднего вентрального ядра таламуса. Появление сильнейшей боли в противоположной половине тела может быть связано с нарушением нормальных тормозных влияний, которые поступают в задние отделы таламуса от близлежащих ретикулярных ядер.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Молекулярная биология боли
Они знают, что такое боль.
Автор
Редакторы
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?
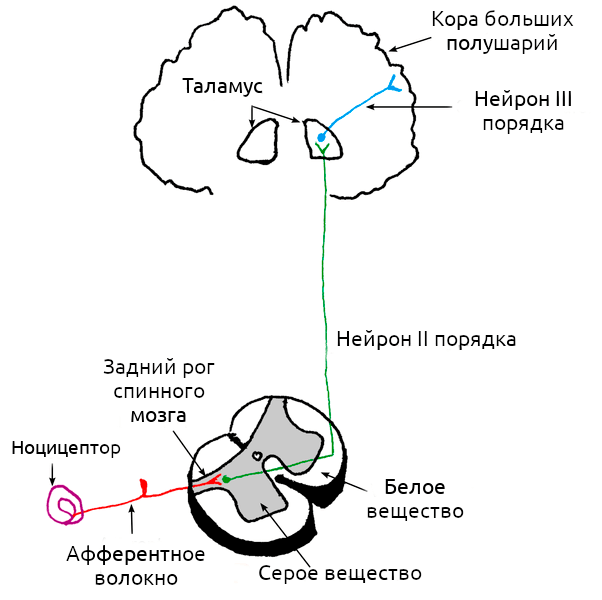
Ни для кого не секрет, что за ощущение боли отвечает нервная система. В общем виде работу этой системы можно представить так: рецепторы улавливают внешний сигнал и преобразуют его в нервный импульс (трансдукция), передают информацию по нерву (кондукция), а далее она обрабатывается в спинном мозге и «отсылается» в головной мозг (проекция) для генерации болезненных ощущений (восприятие) (рис. 1). Почти все помнят, что боль — это реакция на внешний раздражитель, но на самом деле это не всегда так: она может возникать и при поломке самой нервной системы.
Рисунок 1. Схема работы болевого импульса. В простейшем пути передачи сигнала участвуют три группы нейронов, чьи волокна обозначены на схеме разными цветами. За трансдукцию боли отвечает ноцицептор (обозначен на схеме фиолетовым), трансдукция происходит по нервным волокнам, обозначенным красным цветом, в спинном мозге происходит проекция боли на «зеленый» участок схемы, восприятие же боли начинается тогда, когда нейроны третьего порядка передадут нервный импульс от таламуса к коре больших полушарий.
Стоит отметить, что эволюционно боль появилась в качестве полезной адаптации, и на самом деле, до сих пор продолжает играть важную роль в нашей жизни. Задумайтесь, какой бы была жизнь без боли — мы не могли бы отдергивать руку, касаясь горячей поверхности, не замечали бы наносимых ран, а уж как осложнилась бы жизнь врачей, ставящих диагноз — сложно представить. Однако это не вся польза, которую приносит нам наша система восприятия боли. Рука об руку с ощущением боли идут ощущения давления, холода и тепла (то есть осязание) — и возможность организма в ответ на стимул из внешней среды изменить свои параметры. Существует ряд болезней (в основном генетически обусловленных), при которых восприятие боли нарушается. Их тяжесть варьирует в зависимости от того, какой именно рецептор или канал «поломан». Самые тяжелые формы (например, наследственная сенсорно-вегетативная невропатия IV типа) характеризуются полной потерей болевой чувствительности в конечностях и нарушением способности организма регулировать температуру тела. Но обо всем по порядку.
Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Поскольку мы решили остановиться на «нормальной» ноцицептивной боли, давайте разберемся поподробнее с каждым из этапов ее появления.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
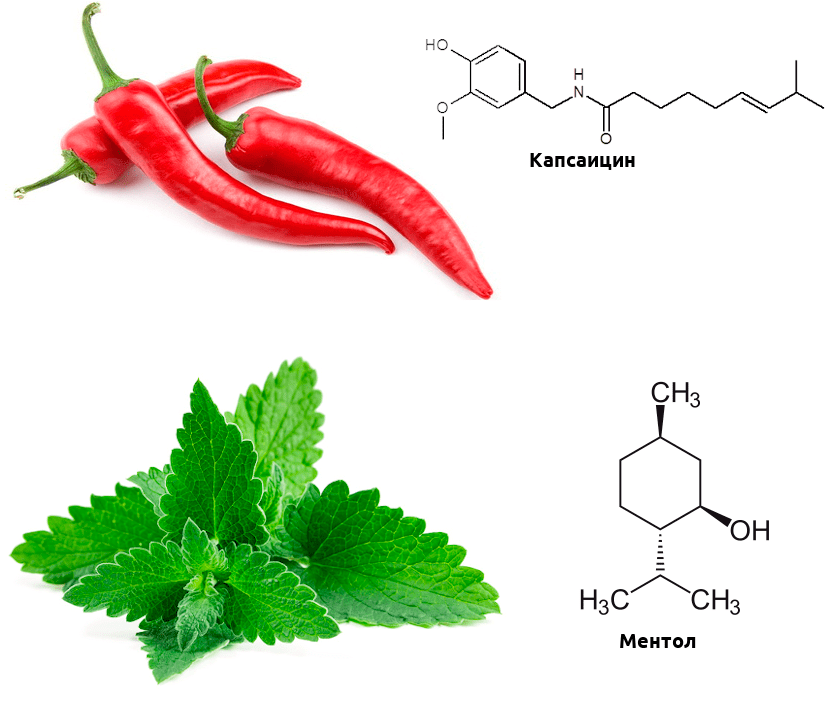
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].
Рисунок 2. Связывание рецепторами TRP капсаицина и ментола приводит к активации «температурной» ноцицепции. Интересно, что при определенных условиях капсаицин может не только вызывать боль, но и ослаблять ее — он десенсибилизирует (то есть делает менее чувствительными к стимулам) другие каналы семейства TRP, кроме того, провоцирует выброс эндорфинов, а вкупе с другими лекарственными средствами может оказаться. перспективным обезболивающим.
Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.
Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
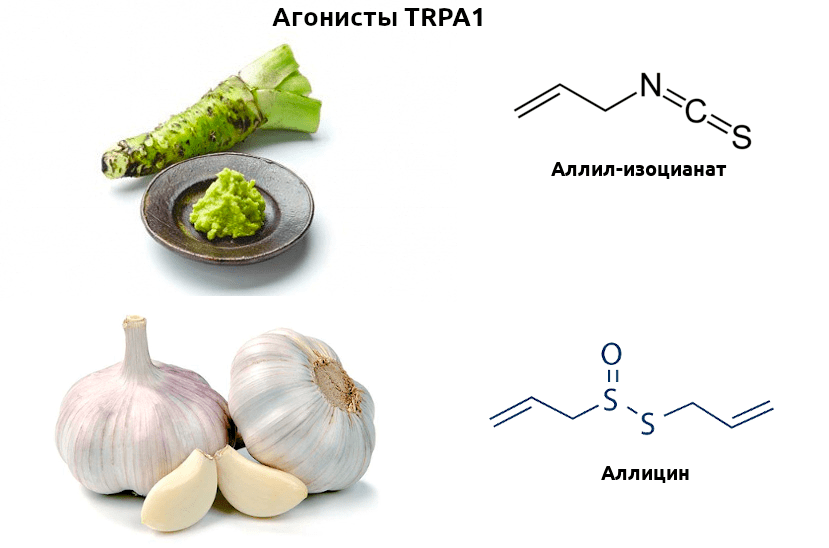
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).
Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
На примерах мы разобрались, как работают ноцицептивные рецепторы, но ведь они расположены «на переднем крае», близко к раздражителю, а приказ о болевых ощущениях отдается из мозга. Значит, необходимо донести сигнал до верховных инстанций. Для этого только что полученный потенциал действия рецептора активирует множество потенциал-управляемых ионных каналов. Натриевые и калиевые каналы необходимы для генерации потенциалов действия, которые передают ноцицепторные сигналы синапсам в дорсальном роге спинного мозга. Они — еще одна потенциальная терапевтическая мишень для новых групп анальгетиков. Кальциевые же каналы играют ключевую роль в высвобождении нейромедиаторов из центральных или периферических ноцицепторных синапсов, вызывая боль или воспаление соответственно.
В этом месте важно отметить, что нервные волокна, по которым ноцицепторный сигнал идет до спинного мозга, бывают трех типов — Aδ (а-дельта), Aβ (а-бета) и C. Эти волокна отличаются друг от друга по толщине, наличию или отсутствию «изолирующей» миелиновой оболочки и, как следствие, по скорости проведения нервного импульса и типу импульса, который по ним проводится.
Аδ-волокна проводят импульс быстро (10–30 м/с) и «специализируются» на сигналах о сильной механической боли и изменении температуры.
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Помимо «голубей», тормозящих проведение импульса, есть в спинном мозге и «ястребы», его усиливающие. Самый известный из них — глутамат [13]. В случае проведения ноцицептивного импульса, работа глутамата осуществляется через рецепторы NMDA и AMPA.
Глутамат действует хитро: связываясь с рецепторами АMPA, он вызывает в нейроне активацию уже знакомой нам протеинкиназы С, которая, в свою очередь, приводит к возрастанию уровня внутриклеточного кальция и поляризации мембраны. Помимо того, что это ускоряет проведение болевого импульса, это влияет на NMDA-рецепторы. В норме потенциал-зависимый канал закрыт магниевой «пробкой» и не открывается даже при связанном глутамате. Когда мембрана деполяризируется, магниевая пробка вылетает, и NMDA-рецептор запускает внутрь клетки катионы натрия и кальция, а наружу — калия, что способствует дальнейшей деполяризации мембраны. Самый известный антагонист NDMA-рецепторов — кетамин. Он нашел обширное применение в качестве операционного анестетика, но в последние годы из-за многочисленных нежелательных эффектов (в том числе наркотических), его применяют все реже. В ветеринарной же медицине кетамин, напротив, один из самых широко применяемых анестетиков.
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Сначала таламус и парабрахиальное ядро получают информацию от проекционных нейронов в различных пластинах, а затем передают эту сенсорную информацию в корковые и миндалевидные области, где информация расшифровывается как «болезненный стимул».
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Аффективно-мотивационный аспект боли опосредуется медиальным болевым путем, включающим внутриламинарные ядра таламуса, которые проецируются на соматосенсорные структуры коры и лимбической системы. Пластина V же передает ноцицептивные сообщения парабрахиальному внутреннему латеральному ядру. Нервные волокна этого ядра связаны с областями коры, отвечающими за когнитивные функции (например, поведенческую реакцию на боль) и агрессивное поведение [16].
Помимо «осознания боли» ответом часто является реакция «бей или беги», связанная с активацией норадреналинергических нейронов в голубом пятне. Кроме того, после «обработки» болевого сигнала соматосенсорной корой, информация о болевом сигнале передается в гиппокамп — чтобы затем отправиться в долговременную память.
На данный момент мы не можем с точностью сказать, какие молекулярные процессы, происходящие в мозге, отвечают за «субъективное восприятие» боли, поэтому вмешиваться с помощью лекарств на этом уровне восприятия боли никто не решается — слишком опасно.
Часть VI: Возвращение к наболевшему
С помощью одних и вопреки другим нейробиохимическим механизмам, болевой импульс дошел до мозга. На некоторое время организм ждут ощущения от неприятных до ужасающих. Сейчас кажется, что человечество овладело огромным количеством фармакологических методов для остановки боли — однако это лишь иллюзия, и как только противовоспалительные средства — ингибиторы циклооксигеназы — перестают снимать боль, врачам приходится применять «тяжелую артиллерию» опиоидных анальгетиков.
Как мы уже выяснили, сейчас выявлено очень много рецепторов, которые вовлечены в процесс передачи боли, но еще большее количество факторов пока ускользает от всевидящего взгляда ученых. Другой печальный факт заключается в том, что у многих из известных нам болевых рецепторов есть и другие физиологические функции, блокировка которых приведет к значительным побочным эффектам. Разработка антагонистов TRP, а также «опиоидов нового поколения», не вызывающих зависимость, может оказаться настоящим прорывом — но может и повлечь новые невзгоды. Сегодня нам ясно одно — в борьбе за повышение качества жизни боль рано или поздно должна быть взята под контроль, а для того чтобы оседлать этого страшного зверя, его нужно узнать.