онкофорум метастазы в головной мозг
Метастатическая меланома с поражением головного мозга
Метастатическая меланома представляет собой онкологическое заболевание, при котором вторичные опухоли распространяются по организму человека за небольшой промежуток времени.
Внутримозговые метастазы – это наиболее часто встречающиеся опухоли у взрослого населения, локализированные в области черепа. После выявления этого поражения статистика выживаемости следующая:
Обращаясь к статистике выживаемости больных с метастазами меланомы в головной мозг, то общая выживаемость составляет, порядка 4-5 месяцев (рис. 1).
Как часто происходит метастазирование меланомы в головной мозг?
При меланоме риск распространения метастазов в головной мозг самый высокий среди наиболее распространенных онкологических заболеваний. Данные появления метастазов в головном мозге среди заболевших:
Наиболее часто метастазы меланомы в головной мозг проявляются кровоизлиянием в опухоль, и клинически проявляется инсультоподобным состоянием. К особенностям внутримозговых метастазов меланомы относится их склонность к образованию множественных очагов, гематогенное метастазирование (рис. 2). Меланома является опухолью, которая слабо чувствительна к ионизирующему облучению.
Как лечить пациентов?
Для определения тактики лечения проводится диагностика состояния головного мозга. Пациенту проводится магнитно-резонансная томография головного мозга с контрастным усилением. Только так можно увидеть истинную распространенность процесса в головном мозге (рис.3).
Методы локального контроля:
— Хирургическое лечение. Показано при наличии перифокального отека с масс-эффектом, стремительного нарастания неврологической симптоматики, наличии кровоизлияния в опухоль, необходимости гистологической верификации и размерах очага более 3 см.
— Лучевая терапия и радиохирургия. Показано в случаях с множественного поражения головного мозга.
При этом, данные критерии не являются абсолютными и выбор тактики определяется в каждом клиническом случае отдельно. И всегда должен рассматриваться вопрос системной терапии.
В последние годы в практику лечения метастатической меланомы вошли новые классы препаратов – BRAF и MEK ингибиторы, группы таргетных препаратов, а также ингибиторы контрольных точек анти-CTLA-4 и анти-PD-1/PD-L1. Препараты направлены на активацию иммунной системы и собственных защитных сил организма больного. Непосредственной противоопухолевой активностью обладают активированные цитотоксические Т-лимфоциты, которые инфильтрируют опухолевую ткань и вызывают ее гибель.
Проведенные исследования демонстрируют, что применение современных таргетных препаратов позволяет достигнуть объективных ответов на терапию в лечении метастатической меланомы. Опыт из практики показывает, что пациенты с прогрессирующей меланомой в головной мозг, подлежат лечению, и их выживаемость измеряется годами при правильном подборе современной терапии.
Случай из практики
У пациентки, старше 60 лет, в 2006 году была выявлена меланома кожи спины IIА стадии, проведено хирургическое лечение и далее 1 год терапии интерфероном. Спустя 7 лет, у пациентки было отмечено прогрессирование заболевания – метастазы меланомы в кожу и лимфоузлы. Проведено их хирургическое удаление, спустя месяц появились новые метастазы и тогда была назначена таргетная терапия BRAF-ингибитором. Спустя 4 месяца все очаги метастазы исчезли. Это был 2015 год, тогда только входила в практику терапия BRAF-ингибиторами. И терапия была отменена, что по современным данным делать было категорически нельзя. Что привело к закономерному результату – прогрессированию заболевания спустя 4 месяца, которое проявилось метастазами в головной мозг. Было предложено нейрохирургическое и радиотерапевтическое лечение, от которого пациентка отказалась, далее пациентка вновь получала таргетную терапию BRAF-ингибитором до апреля 2016 года, удалось добиться частичного уменьшения размеров опухолей.
Дальнейший перерыв в 3 месяца привел к прогрессированию заболевания – продолженный рост метастазов в головном мозге и появление новых метастазов в магистральных сосудах между головой и сердцем. Было предложено нейрохирургическое лечение, от которого пациентка отказалась. Тогда её было повторно предложено проведение стереотаксической лучевой терапии.
Она была проведена в сентябре 2016 года и также была возобновлена таргетная терапия BRAF-ингибитором. На фоне лечения у пациентки отмечалась стабилизация заболевания до июля 2018 года. Тогда был отмечен продолженный рост метастазов в головном мозге, появление метастазов в лимфоузлах подмышечной области. Пациентке назначена иммунотерапия ингибитором анти-PD-1, которую она получает с июля 2018 года по настоящее время. За время лечения достигнуто уменьшение размеров опухолевых очагов, что подтверждено контрольными МРТ головного мозга с контрастным усилением и ПЭТ/КТ всего тела с 18-ФДГ, один из контролей приведен на рисунке 4.
Таким образом, не смотря на статистические данные, удалось достичь длительной выживаемости пациентки, поэтапным применением современных методов лечения.
Заключение
Выводы
Пациенты с метастазами в головной мозг – группа пациентов с плохим клиническим прогнозом и небольшой продолжительностью жизни. Внедрение в клиническую практику новых современных методов лечения может помочь улучшить выживаемость этих больных. Накопление клинического опыта будет способствовать оптимизации подходов в комбинированном лечении метастазов меланомы в головной мозг.
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ХИМИО- И ХИМИОЛУЧЕВАЯ ТЕРАПИЯ МЕТАСТАЗОВ НЕКОТОРЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ В ГОЛОВНОЙ МОЗГ
М.Б. Бычков, В.А. Горбунова, Д.Р. Насхлеташвили, З.П. Михина
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Метастазы в головной мозг – серьезное осложнение опухолевого процесса, которое отмечается у 12–20% онкологических больных. В структуре метастатического поражения головного мозга первое место занимает рак легкого (48%), далее следуют рак молочной железы (15%), меланома (9%), рак толстой кишки (5%), рак почки (4%). Метастазы в мозг сарком, семином и других опухолей бывают реже (Alfred Yung W.K., 2003 г.).
По числу больных, у которых выявлены метастазы в головной мозг, рак легкого (РЛ) у мужчин и рак молочной железы (РМЖ) у женщин занимают ведущее место (7, 17). Метастазы в головной мозг обнаруживаются на аутопсии у 25% больных, умерших от злокачественных новообразований. Прижизненно поражение головного мозга диагностируется примерно в 1,5–3 раза реже по сравнению с находками на вскрытии (7, 8, 23).
Обычно метастазы в мозг развиваются в течение от 6 месяцев до 2 лет после выявления первичной опухоли и ассоциируются с прогрессированием болезни. Метастазы в мозг могут проявляться в любое время заболевания раком, чаще возникают метахронно, но могут проявляться синхронно или даже до выявления первичной опухоли. Внутримозговые метастазы в 10–22% могут быть первым проявлением заболевания либо обнаруживаться во время лечения. Однако в наибольшей степени сроки их выявления зависят от биологических особенностей первичной опухоли. Так, при мелкоклеточном раке легкого (МРЛ) метастазы в головном мозге обнаруживаются в большинстве случаев (50–80%) в течение первого–второго года заболевания, а при РМЖ – в более отдаленные сроки – от 3–4 до 15 лет и более (8, 13, 19). По данным некоторых исследований неблагоприятным прогностическим фактором для больных раком молочной железы, указывающим на повышенный риск метастазирования в головной мозг, является гиперэкспрессия HER2/neu в первичной опухоли (11, 16, 17).
В последние годы отмечается рост числа больных с метастазами в головной мозг. При этом увеличение частоты клинически проявляемых метастазов связано как с совершенствованием диагностики за счет внедрения в клиническую практику рентгеновской компьютерной (РКТ) и магнитно-резонансной томографии (МРТ), так и с увеличением продолжительности ремиссий вследствие использования более эффективных современных программ лечения.
Метастазы в мозг всегда гематогенные, они продуцируют и секретируют ангиогенные субстанции, что делает их васкуляризируемыми и позволяет опухолевым клеткам легче проникать через гематоэнцефалический барьер (ГЭБ). Симптомы метастатического поражения головного мозга обычно развиваются в течение нескольких недель и зависят от размеров, числа и локализации метастазов.
Ранее считалось, что только жирорастворимые препараты могут проникать в головной мозг, однако в исследовании Vick с соавт. (1977 г.) было показано, что функция ГЭБ сильно различается при наличии поражения головного мозга по сравнению с нормальным, и он перестает выполнять «барьерную» функцию в присутствии опухоли.
Hasagawa с соавт. (1979 г.) отметили, что жирорастворимость не является обязательным условием проникновения препарата в ткани мозга и, что водорастворимые лекарственные вещества, такие как метотрексат, циклофосфан и цисплатин способны проникать в опухолевые клетки после их парентерального введения.
В настоящее время считается, что ГЭБ играет важную роль у больных с метастазами в мозг, но его защитные свойства ограничены нормальной тканью мозга, а не самим метастазом. Приводятся данные о том, что нарушение функции ГЭБ наступает уже при размерах метастаза около 1 мм (1, 21, 23).
На основании полученных результатов лечения метастатических опухолей головного мозга определены факторы, при которых лекарственное лечение может быть эффективным. Прежде всего это чувствительность первичной опухоли к системной химиотерапии (наилучшие результаты получены у больных МРЛ и РМЖ); супратенториальное расположение метастазов (лечение метастазов в задней черепной ямки оказалось менее эффективным по сравнению с другими областями мозга); множественные мелкоочаговые метастазы. Благоприятными признаками также являются отсутствие других отдаленных метастазов и длительный интервал между диагностикой первичной опухоли и метастазами в мозг (больные с более коротким интервалом имеют худший прогноз).
Выбор метода лечения (операция, лучевая терапия, химиотерапия) зависит от распространенности опухолевого процесса, морфологической характеристики опухоли, возраста больных и общего состояния.
По данным различных исследований, медиана продолжительности жизни больных с метастазами в мозг составляет без лечения 1-2 месяца, у получающих кортикостероиды – 2-3 месяца, у получавших лучевую терапию (ЛТ) – 3-6 месяцев, у подвергнутых оперативному лечению и последующему облучению мозга – 10-16 месяцев, у получающих химиотерапию (при чувствительных к химиотерапии нозологических формах) – 8-12 месяцев (Wen P.Y. et al., 2001 г.).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в течение длительного периода времени проводятся исследования по изучению эффективности различных схем химиотерапии у больных с метастатическим поражением головного мозга.
Схема AVP впервые разработана в отделении химиотерапии, где проводилось изучение её эффективности при метастазах в головной мозг МРЛ (2, 3, 4, 6, 10, 12).
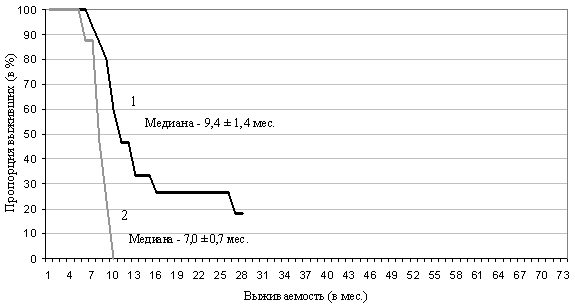
Медиана продолжительности жизни больных с объективным эффектом составила 9,4±1,4 месяцев по сравнению с 7,0±0,7 месяцев у пациентов со стабилизацией или прогрессированием метастазов в головном мозге. Около 40% больных прожили год и 27% – два года в группе AVP при достижении объективного эффекта со стороны внутримозговых метастазов; и все больные при отсутствии эффекта прожили менее 10 месяцев (рис. 1).
При сравнении AVP и других схем (CAV, AC и др.) отмечались достоверно лучшие показатели как по полным (52,0% и 12%), так и по объективным ответам в головном мозге (62,3% и 24%) при использовании AVP (p=0,0035 и 0,0067, соответственно).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в настоящее время проводится изучение других режимов химиотерапии при метастазах МРЛ в головной мозг.
Так, продолжается изучение комбинации ArDV (араноза + доксорубицин + винкристин) во 2-й линии лечения больных распространенным МРЛ. Лечение проводится по схеме: араноза 1000 мг в/в в 1 и 2 дни, доксорубицин 40 мг/м² в/в в 1-й день, винкристин 2 мг в/в в 1-й день 21-дневного цикла. При использовании данного режима химиотерапии у 10 больных МРЛ с метастазами в головной мозг, получавших ранее химиотерапию, у 3-х пациентов достигнута полная регрессия в мозге, у 1 – частичная регрессия.
Таблица 1.
Эффективность режима ArDV (араноза + доксорубицин + винкристин) во II линии химиотерапии больных МРЛ с метастазами в головной мозг (данные отделения химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Количество больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование |
|---|---|---|---|---|
| 10(100%) | 3(30%) | 1(10%) | 4(40%) | 2(20%) |
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России продолжается изучение комбинированной химиотерапии по схеме: кампто 60 мг/м² внутривенно в 1, 8 дни + цисплатин 80 мг/м² внутривенно в 1 день у больных распространенной формой МРЛ в качестве I линии лечения. При оценке эффекта химиотерапии метастазов в головной мозг (по данным РКТ головного мозга с внутривенным контрастированием) у 3 из 10 больных (30%) зарегистрирована частичная регрессия опухоли, у 2 (20%) – полная регрессия метастазов в мозг (9).
В последние годы в мире проводится ряд клинических исследований по изучению эффективности новых схем химиотерапии у больных немелкоклеточным раком легкого (НМРЛ) с метастатическим поражением головного мозга.
Quadvlieg V. c соавт. (2004 г.) показали высокую эффективность схемы химиотерапии: гемцитабин 1000 мг/м² внутривенно в 1 и 8 дни + цисплатин 50 мг/м² внутривенно в 1 и 8 дни (20). Курсы химиотерапии проводились каждые 3-4 недели. В целом, при лечении были достигнуты 9 полных регрессий в головном мозге (25%) и 14 частичных регрессий (39%). Таким образом, общий эффект составил 64% (23 из 36 больных). Медиана продолжительности эффекта составила 6,8 мес.
В настоящее время проводятся исследования по изучению эффективности темодала при метастазах в головной мозг в монохимиотерапии, в сочетании с лучевой терапией, а также в составе лекарственных комбинаций (15).
Таблица 2.
Темодал при метастазах злокачественных опухолей в мозг (данные отделения химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Количество больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование | |
|---|---|---|---|---|---|
| НМРЛ | 7 | — | — | 3 | 4 |
| РМЖ | 1 | — | — | — | 1 |
| Меланома | 3 | 1 | — | — | 2 |
| Всего | 11 (100%) | 1 (9%) | — | 3 (27%) | 7 (64%) |
Предварительные исследования показывают, что темодал в сочетании с ЛТ увеличивает эффективность лечения метастазов в головной мозг у больных с солидными опухолями на 20-30% в сравнении с одной ЛТ (5).Данные мультицентрового исследования выживаемости больных с метастазами НМРЛ в мозг, получавших лечение темодалом в комбинации с ЛТ по сравнению с одной ЛТ показаны в таблице 3.
Таблица 3.
Выживаемость больных с метастазами НМРЛ в мозг, получавших лечение темодалом в комбинации с лучевой ЛТ по сравнению с ЛТ в самостоятельном варианте.
| Число больных | Объективный ответ | Медиана продолжительности жизни | |
|---|---|---|---|
| Темодал + ЛТ | 52 | 48% (p=0.031) | 7,9 мес. (p=0.06) |
| ЛТ | 51 | 27,5% | 4,3 мес. |
| Всего: | 103 | — | — |
Таблица 4.
Темодал + лучевая терапия у больных с метастазами в головной мозг (данные ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Число больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование | |
|---|---|---|---|---|---|
| МРЛ | 2 | 1 | 1 | — | — |
| НМРЛ | 10 | 2 | 5 | 3 | — |
| РМЖ | 5 | 1 | 3 | 1 | — |
| Меланома | 4 | 1 | — | 2 | 1 |
| Всего | 21 (100%) | 5 (23,8%) | 9 (42,8%) | 6(28,6%) | 1 (4,8%) |
В настоящее время продолжаются исследования по изучению сочетания новых противоопухолевых препаратов (кампто, топотекан) с ЛТ при лечении больных с метастатическим поражением мозга.
В последние годы проводятся исследования по изучению эффективности таргетных препаратов у больных с метастазами в головной мозг. Как показали предклинические исследования, отмечается гиперэкспрессия рецепторов эпидермального фактора роста в опухолевой ткани при метастатическом поражении головного мозга и первичных опухолях мозга.
Основываясь на этих данных, Giovanni L.С. с соавт. (2004 г.) изучали эффективность препарата ZD1839 (иресса) у больных НМРЛ с метастазами в головной мозг. В исследование были включены 35 больных НМРЛ (26 мужчин и 9 женщин). 28 больных ранее получали цисплатин-содержащие схемы химиотерапии, 16 проводилась ЛТ на область головного мозга. Схема лечения: иресса 250 мг/сутки внутрь, до прогрессирования болезни. У 5 (17%) больных была достигнута частичная регрессия, у 7 – стабилизация (24%). Таким образом, контроль роста опухоли был отмечен у 12 (41%) пациентов. Результаты данного исследования показывают, что Иресса эффективна у больных с метастазами НМРЛ в головной мозг, получавших ранее лечение (химио- и лучевую терапию).
1. Бредбери М. Концепция гематоэнцефалического барьера. М., «Медицина», 1983, с. 480.
2. Бычков М.Б., Горбунова В.А., Орел Н.Ф., Егоров Г.Н., Насхлеташвили Д.Р. Лекарственная терапия метастазов в головной мозг. Вестник Московского Онкологического Общества, 2004 г., №1 (504).
4. Бычков М.Б., Орел Н.Ф., Насхлеташвили Д.Р. Современные возможности лекарственного лечения мелкоклеточного рака легкого. В кн.: Этюды химиотерапии. М., 2000, с. 70–74.
6. Горбунова В.А., Бычков М.Б., Михина З.П., Войнаревич А.О., Насхлеташвили Д.Р. Химиотерапия больных раком молочной железы с метастазами в головной мозг. Материалы III съезда онкологов и радиологов СНГ 25-28.05.2004 г., часть II, стр. 256-257.
7. Идрисова М.И. Поражение головного мозга при раке легкого. Дисс. канд. мед. наук, М., 1980, 212 стр.
8. Моисеенко В.М., Семиглазов В.Ф., Тюляндин С.А. Современное лекарственное лечение местно-распространенного и метастатического рака молочной железы. «Грифон», Санкт-Петербург, 1997, с. 254.
9. Насхлеташвили Д. Р. Кампто (Иринотекан) в лечении первичных и метастатических опухолей головного мозга. Журнал “Врач”, 2005 г., №12, стр. 67-69.
10. Орел Н.Ф. Новые производные нитрозомочевины. В книге.: Новые цитостатики в лечении злокачественных опухолей, М., 1998, с. 25–39.
11. Altaha R., Crowell E., Ducatman B., Higa G., Abraham J.; West Virginia University, Morgantown, WV. Risk of brain metastases in HER2/neu-positive breast cancer. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 682.
12. Bychkov M.B. Gorbounova V.A,. Marenich A.F, Voinarevich A.O. D.R. Naskhletashvili Combined chemotherapy with AVP (Nidran + Vepesid + Cisplatin) in patients with extensive lung cancer. – Lung cancer. Vol. 29, Supplement 1, 2000, p. 37-38.
13. Fisher B., Osborne C.K., Margolese R.G. Bloomer W.D. Neoplasms of the breast. In: Cancer medicine, vol. 2, 4th ed. Holland J.F., Bast R.C. Morton D.L., Frei III E., Kufe D.W., Weichselbaum R.R. Williams & Wilkins. Baltimore, Philadelphia, London, Paris, Bangkok, Buenos Aires, Hong Kong, Munich, Sydney, Tokyo, Wroclaw, 1997, p. 2349–2429.
14. French L.A., Galicich J.H. The use of steroid for control of cerebral edema. Clin. Neurosurg., 1964, 10, p. 212–223.
15. Gorbounova V.A., Bychkov M.B., Michina Z.P., Naskhletashvili D.R., Tеmozolomide in patients with brain metastases. 16th International Congress of Anti-Cancer Treatment (01-04/02/2005 г., Paris, France). Abstract book, p. 306.
16. Heimberger, et al. Cl. Cancer Res., 2002; 8: 3496-3502.
17. Herrero A., Grandez R., Puertolas T., Alonso Orduna V., Martinez Trufero J., Pazo Cid R., Artal A., Lao J., Ruiz de Lobera A., Anton Torres A.; Hospital Miguel Servet, Zaragoza, Spain. High incidence of brain metastases at the time of death in women with metastatic breast cancer treated with trastuzumab. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 765.
18. Lai R.K., Dang C., Thaler H., Malkin M.G. The incidence of brain metastases in HER2/neu+ stage IV breast cancer patients. ASCO, 2001, abstract 2014.
19. Nieder C., Niewald M., Hagen T. Brain metastases of bronchial and breast carcinoma. Differences in metastatic behavior and prognosis. Radiologie, 1995, 35, 11, p. 816–821.
20. V. Quadvlieg, L. Bosquee, M. Gustin, N. Barthelemy; CHU LIEGE, LIEGE, Belgium; CHR Citadelle LIEGE, LIEGE, Belgium. Frontline gemcitabine and cisplatin based chemotherapy in patients with NSCLC inoperable brain metastases. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 7117.
21. Qin D., Ma J., Xiao J., Tang Z. Effect of brain irradiation on blood-CSF barrier permeability of chemotherapeutic agents. Am. J. Clin. Oncol. Cancer Clin. Trials., 1997, 20, 3, p. 263–265.
22. Vecht C.J. Clinical management of brain metastasis. J. Neurol, 1998, 245, 3, p. 127–131.
Онкофорум метастазы в головной мозг
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Минздравсоцразвития России, Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава Россиии
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФБГУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Опыт лечения больной колоректальным раком с метастазом в головном мозге
Журнал: Онкология. Журнал им. П.А. Герцена. 2017;6(2): 51-55
Зайцев А. М., Кирсанова О. Н., Кобылецкая Т. М. Опыт лечения больной колоректальным раком с метастазом в головном мозге. Онкология. Журнал им. П.А. Герцена. 2017;6(2):51-55.
Zaĭtsev A M, Kirsanova O N, Kobyletskaya T M. Experience in treating a female patient with brain metastasis from colorectal cancer. P.A. Herzen Journal of Oncology. 2017;6(2):51-55.
https://doi.org/10.17116/onkolog20176251-55
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Минздравсоцразвития России, Москва
Представлен клинический пример длительной (35 мес) выживаемости пациентки с метастазами колоректального рака в головном мозге и легких. По данным литературы, головной мозг является редкой мишенью метастазирования колоректального рака. Метастатическое поражение головного мозга традиционно считается финальным проявлением заболевания и характеризуется крайне пессимистичным прогнозом. Наше наблюдение демонстрирует, что проведение комплексного лечения, включающего хирургическое, приводит к длительной выживаемости больных при удовлетворительном качестве жизни.
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Минздравсоцразвития России, Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава Россиии
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФБГУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Метастазирование опухолей в головной мозг является одной из важнейших проблем, стоящих перед современной онкологией, нейрохирургией и лучевой терапией. Известно, что у 20—40% онкологических больных метастазы в головном мозге развиваются на том или ином этапе болезни. Метастазы составляют 20—30% всех внутричерепных новообразований [1]. По данным МНИОИ им. Герцена, наиболее часто источником метастазирования является рак легкого (34%), рак молочной железы (26%), рак почки (11%), меланома кожи (9,3%), колоректальный рак (7,8%) [2]. Появление внутримозговых метастазов традиционно ассоциируется с плохим прогнозом. Так, медиана выживаемости больных без лечения составляет около 6 нед.
Колоректальный рак занимает 4-е место в структуре заболеваемости злокачественными новообразованиями и 5-е в структуре метастатического поражения головного мозга. В развитых странах он занимает 3-е место в структуре заболеваемости за счет некоторого снижения распространенности рака легкого. Метастазы в головном мозге развиваются на поздних стадиях заболевания. При этом большинство пациентов уже имеют другие вторичные очаги, что ограничивает подбор системной терапии. В целом пациенты с метастазами колоректального рака в головном мозге имеют плохой прогноз даже в общей группе больных с метастатическим поражением головного мозга. Медиана общей выживаемости, по данным ряда авторов, составляет 2,8—5,4 мес [3—6]. Раннее выявление и лечение метастазов головного мозга с применением новых, в том числе таргетных, препаратов может улучшить результаты лечения. Причиной гибели пациентов в подавляющем большинстве случаев становится генерализация процесса. Поэтому контроль системного заболевания имеет важное значение в долгосрочной выживаемости у пациентов с метастазами в головном мозге.
Приводим клинический пример длительной выживаемости пациентки с солитарным метастазом рака прямой кишки в головном мозге на фоне комплексного лечения, включавшего на первом этапе нейрохирургическое вмешательство, далее лучевую и химиотерапию с включением таргетных препаратов.
Пациентка М., 63 лет, обратилась в МНИОИ им. П.А. Герцена 26.07.10. Из анамнеза и представленной медицинской документации известно что в феврале 2008 г. выявлен рак прямой кишки III стадии CT3N1M0. С 26.02. по 29.02.08 проведена ДЛТ в СОД 20 Гр. 03.03.08 выполнена брюшно-промежностная экстирпация прямой кишки. Гистологическое исследование: аденокарцинома от высокой до умеренной степени дифференцировки прорастает всю стенку кишки, врастает в клетчатку. По линии резекции опухолевого роста нет. В одном лимфатическом узле метастаз умеренно дифференцированной аденокарциномы. Проведено 5 курсов ПХТ по схеме MAYO (фторурацил, лейковорин). С июня 2010 г. появились речевые нарушения по типу амнестической афазии, которые постепенно нарастали, затем присоединились головная боль и снижение памяти. При МРТ головного мозга с контрастным усилением (16.07.10) выявлен метастаз в левой височной доле. Обратилась в МНИОИ им. П.А. Герцена, где при дообследовании выявлены метастазы в правом легком. При фибробронхоскопии цитологически подтвержден метастаз аденокарциномы кишечного типа в верхней доле правого легкого с обтурацией бронха Д1. Тактика лечения была обсуждена на консилиуме, где выработан план комплексного лечения. Учитывая выраженную неврологическую симптоматику, пациентке на первом этапе запланировано нейрохирургическое вмешательство.
Состояние при поступлении относительно удовлетворительное, обусловлено внутричерепной гипертензией, купируемой 8 мг дексаметазона в сутки. Показатели витальных функций стабильны, компенсированы. Индекс по шкале Карновского 60 баллов.
Неврологически на фоне ясного сознания выявлялась общемозговая симптоматика, проявляющаяся головной болью, левополушарной симптоматикой в виде семантической афазии Вернике—Кожевникова, легкой пирамидной недостаточности, а также атаксией.
При МРТ головного мозга с контрастным усилением в левой височной области определялся очаг округлой формы, неоднородной структуры, накапливающий контраст, размером 29×38×33 мм, окруженный зоной перифокального отека, масс-эффектом (рис. 1).

При СКТ органов грудной полости верхняя доля правого легкого уменьшена в объеме, на фоне аталектаза верхушечного сегмента корня легкого определяется образование с неровными контурами, размером 4,7×3,4 см, просвет верхушечного сегмента не визуализируется. На этом уровне в паренхиме правого легкого определяется образование до 1,6 см. Субкапсулярно определяются два очага в SVI, SVIII до 0,5 см, в средней доле слабоинтенсивные очаги до 0,4 см. В базальном отделе нижней доли левого легкого по диафрагмальной плевре очаг уплотнения до 0,5 см.
04.08.10 выполнена операция с применением операционного микроскопа: удаление метастатической опухоли левой височной доли с интраоперационной флюоресцентной диагностикой и интраоперационной фотодинамической терапией.

При контрольной МРТ головного мозга с контрастным усилением (05.08.2010) ишемических и геморрагических осложнений нет, опухоль удалена радикально (рис. 3).

Послеоперационный период протекал без осложнений. Послеоперационная рана зажила первичным натяжением швы сняты на 8-е сутки после операции.
При выписке общее состояние удовлетворительное. Соматически стабильна. В неврологическом статусе регрессировала общемозговая симптоматика, менее выраженной стала левополушарная симптоматика и атаксия. Индекс по шкале Карновского 80 баллов.
При гистологическом исследовании в головном мозге выявлен метастаз умеренно дифференцированной аденокарциномы с очагами некроза. При молекулярно-генетическом исследовании выявлен немутантный (дикий) тип гена KRAS.
Клинический диагноз при выписке: рак прямой кишки III стадии у CT3N1M0, комплексное лечение в 2008 г. Прогрессирование (08.10): метастазы в головном мозге и легких. Состояние после хирургического лечения внутримозгового метастаза (04.08.10).
Таким образом, общая продолжительность жизни после выявления метастаза в головном мозге и множественных метастазов в легких составила 35 мес. Время между выявлением первичной опухоли и вторичным поражением головного мозга составила 29 мес.
Обсуждение
Метастазирование в головной мозг является относительно редкой мишенью для колоректального рака. Так, по данным L. Schouten и соавт. [7], кумулятивная частота метастазов в головном мозге колоректального рака составляет 1%. Хотя метастазы колоректального рака в головном мозге менее распространены, чем рака легких и молочной железы, их влияние на прогноз более серьезно. По данным зарубежных авторов, медиана выживаемости пациентов с метастазами колоректального рака колеблется от 4 до 6 мес. В работе K. Damiens и соавт. [8], включавшей ретроспективный анализ историй болезни 48 пациентов, медиана общей выживаемости после постановки диагноза составила около 4 мес. Большинство (90%) пациентов имели экстракраниальные метастазы, наиболее часто поражение легких (64%) и печени (50%). При этом 80% внутримозговых метастазов располагается супратенториально, 20% в мозжечке и стволе головного мозга. Первичная опухоль чаще локализуется в дистальном отделе толстой и прямой кишки (48%), сигмовидной (12%), в проксимальном отделе толстой кишки (40%). N. Morinaga и соавт. [9] подчеркивают, что 82% пациентов умерли от генерализации процесса, и только 18% — от рецидива либо продолженного роста очагов в головном мозге.
Выживаемость больных, получавших только симптоматическую терапию, составила 2 мес. При применении лучевой терапии медиана составила 3 мес, при выполнении хирургического лечения — 9 мес. Различия в выживаемости определяются как характером проведенного лечения, так и статусом пациентов, включенных в группы прежде всего хирургии и лучевой терапии. Кандидатами для комбинированного и комплексного лечения всегда являются больные с хорошим функциональным статусом, солитарным/единичным поражением головного мозга и перспективами дальнейшего лечения.
Лечение метастатического колоректального рака заметно изменилось с момента включения моноклональных антител (бевацизумаб, цетуксимаб, панитумумаб) в химиотерапевтические схемы. С одной стороны, большее число больных может дожить до проявления метастатического поражения головного мозга. С другой стороны, данные препараты позволяют контролировать экстракраниальный процесс при уже имеющихся данных о внутричерепных метастазах. Нет данных международных исследований по эффективности лекарственного лечения, включая использование моноклональных антител, у больных колоректальным раком с метастазами в головном мозге. Исходя из результатов собственных исследований, можно предложить использование стандартных режимов в лечении данной категории пациентов. Возможно использование режимов лечения с включением капецитабина (XelOx), иринотекана (FolfIri) и др. При наличии мутации K-ras возможно использование бевацизумаба (при отсутствии рентгенологических признаков кровоизлияния в ЦНС). При отсутствии мутации K-ras возможно использование как бевацизумаба, так и ингибиторов EGFR (цетуксимаб или панитумумаб). Ингибиторы EGFR предпочтительнее использовать в комбинации с иринотеканом и фторпиримидинами [11].
В зарубежных статьях признано экономически нецелесообразным выполнение методов нейровизуализации у пациентов с колоректальным раком с целью раннего выявления метастазов в головном мозге. В то же время при генерализованном колоректальном раке, с нашей точки зрения, такое исследование может выполняться. Также крайне важной является настороженность врачей неврологов и онкологов в отношении метастатического поражения у любого пациента с онкологическим заболеванием в анамнезе и появлением очаговой, менингеальной, пароксизмальной или общемозговой симптоматики.
Заключение
Метастатическое поражение головного мозга традиционно считается финальным проявлением заболевания и характеризуется крайне пессимистичным прогнозом. Несмотря на то что метастазы колоректального рака в головном мозге являются редким проявлением болезни, их влияние на выживаемость остается серьезным. Ранняя диагностика с последующим агрессивным терапевтическим и хирургическим подходом может быть лучшим вариантом для долгосрочного контроля заболевания. Наше наблюдение демонстрирует, что проведение комплексного лечения, включающего хирургическое, приводит к длительной выживаемости больных при удовлетворительном качестве жизни.
Авторы заявляют об отсутствии конфликта инте ресов.