изопроцессы в газах что такое
Уравнение состояния идеального газа. Изопроцессы в газах
Газовое состояние окружающей нас материи представляет собой одну из трех распространенных форм вещества. Указанное текучее агрегатное состояние в физике принято рассматривать в приближении идеального газа. Используя это приближение, опишем в статье возможные изопроцессы в газах.
Идеальный газ и универсальное уравнение для его описания
Идеальным называют такой газ, частицы которого не имеют размеров и не взаимодействуют друг с другом. Очевидно, что не существует ни одного газа, который бы точно удовлетворял этим условиям, поскольку даже самый маленький атом – водород, обладает определенными размерами. Более того, даже между нейтральными атомами благородных газов существует слабое ван-дер-ваальсовое взаимодействие. Тогда встает вопрос: в каких случаях можно пренебречь размерами газовых частиц и взаимодействием между ними? Ответом на этот вопрос будет соблюдение следующих физико-химических условий:

Если хотя бы одно из условий не соблюдается, то газ следует считать реальным и описывать его специальным уравнением Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона необходимо рассмотреть перед изучением изопроцессов. Уравнение идеального газа – его второе название. Оно имеет следующую форму записи:
То есть оно связывает три термодинамических параметра: давление P, температуру T и объем V, а также количество n вещества. Символом R здесь обозначена газовая постоянная величина, она равна 8,314 Дж / (К * моль).
Что такое изопроцессы в газах?
Под этими процессами понимают переходы между двумя разными состояниями газа (начальным и конечным), в результате которых сохраняются одни величины и изменяются другие. Выделяют три типа изопроцесса в газах:
Переход при постоянной температуре
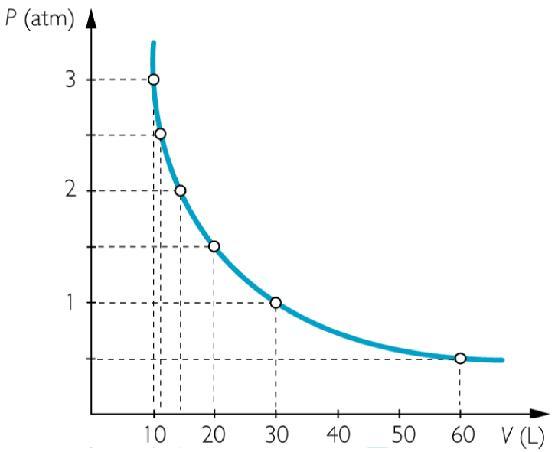
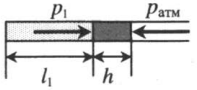
Он называется изотермическим процессом. Из уравнения состояния идеального газа следует, что при постоянной абсолютной температуре в закрытой системе должно оставаться постоянным произведение объема на давление, то есть:
Эту зависимость действительно наблюдали Роберт Бойль и Эдм Мариотт во второй половине XVII века, поэтому в настоящее время записанное равенство носит их фамилии.
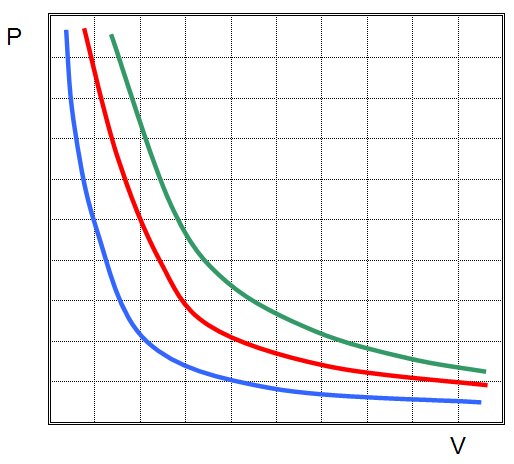
Функциональные зависимости P(V) или V(P), выраженные графически, имеют вид гипербол. Чем выше температура, при которой проводят изотермический эксперимент, тем больше произведение P*V.
При изотермическом процессе газ расширяется или сжимается, совершая работу и не изменяя своей внутренней энергии.
Переход при постоянном давлении
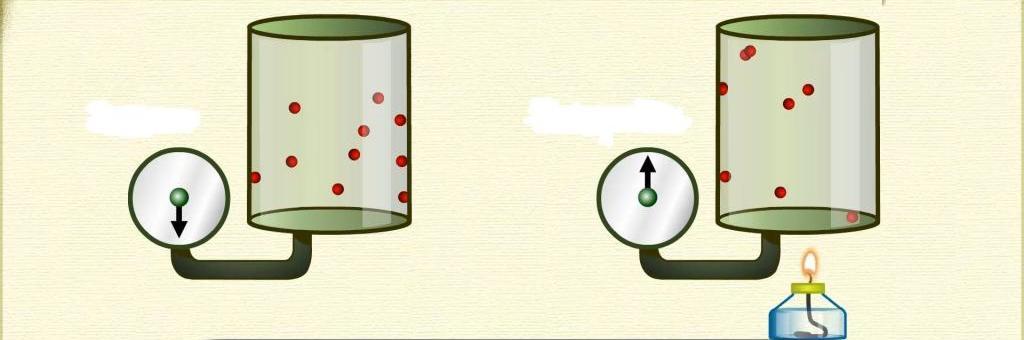
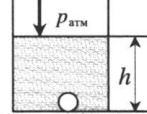
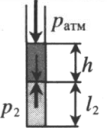
Теперь изучим изобарный процесс, во время которого давление поддерживается постоянным. Примером такого перехода является нагрев газа, находящегося под поршнем. В результате нагрева увеличивается кинетическая энергия частиц, они начинают чаще и с большей силой ударять по поршню, в результате чего газ расширяется. В процессе расширения газ выполняет некоторую работу, КПД которой составляет 40 % (для одноатомного газа).
Для этого изопроцесса уравнение состояния газа идеального говорит о том, что должно выполняться следующее соотношение:
Получить его легко, если постоянное давление перенести в правую часть уравнения Клапейрона, а температуру – в левую. Это равенство называется законом Шарля.
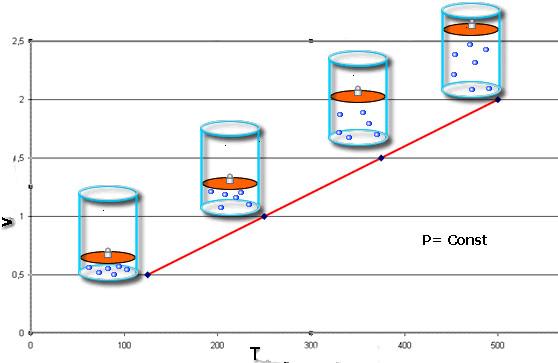
Равенство свидетельствует о том, что функции V(T) и T(V) имеют вид прямых линий на графиках. Наклон линии V(T) относительно оси абсцисс будет тем меньше, чем больше величина давления P.
Переход при неизменном объеме
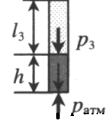
Последним изопроцессом в газах, который мы рассмотрим в статье, является изохорный переход. Используя универсальное уравнение Клапейрона, несложно получить следующее равенство для этого перехода:
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа
Знание определений в физике является ключевым фактором для успешного решения разных физических проблем. В статье рассмотрим, что понимают под процессами изобарным, изохорным, изотермическим и адиабатным для идеальной газовой системы.
Идеальный газ и его уравнение
Прежде чем переходить к описанию изобарного, изохорного и изотермического процессов, рассмотрим, что такое идеальный газ. Под этим определением в физике полагают систему, состоящую из огромного количества безразмерных и невзаимодействующих частиц, которые движутся с большими скоростями во всех направлениях. По сути, речь идет о газовом агрегатном состоянии вещества, в котором расстояния между атомами и молекулами намного превышают их размеры и в котором потенциальной энергией взаимодействия частиц пренебрегают ввиду ее малости, по сравнению с энергией кинетической.

Состоянием идеального газа называется совокупность его термодинамических параметров. Главными из них являются температура, объем и давление. Обозначим их буквами T, V и P, соответственно. В 30-е годы XIX века Клапейрон (французский ученый) впервые записал уравнение, которое объединяет указанные термодинамические параметры в рамках единого равенства. Оно имеет вид:
Что такое изопроцессы в газах?
Как многие заметили, изобарный, изохорный и изотермический процессы в своем названии используют одну и ту же приставку «изо». Она означает равенство одного термодинамического параметра во время прохождения всего процесса, при этом остальные параметры изменяются. Например, изотермический процесс говорит о том, что в его результате абсолютная температура системы поддерживается постоянной, а изохорный процесс свидетельствует о постоянстве объема.
Изопроцессы удобно изучать, поскольку фиксация одного из термодинамических параметров приводит к упрощению общего уравнения состояния газа. Важно отметить, что газовые законы для всех названных изопроцессов были открыты экспериментально. Их анализ позволил Клапейрону получить приведенное универсальное уравнение.
Изобарный, изохорный и изотермический процессы
Первым был открыт закон для изотермического процесса в идеальном газе. Сейчас он называется законом Бойля-Мариотта. Поскольку T не изменяется, то из уравнения состояния следует равенство:
Иными словами, любое изменение давления в системе приводит к обратно пропорциональному изменению ее объема, если поддерживать постоянной температуру газа. Графиком функции P(V) является гипербола.
Это равенство носит фамилию французского физика Жака Шарля, который получил его в конце XVIII века. Изобара (графическое изображение функции V(T)) выглядит как прямая линия. Чем больше давление в системе, тем быстрее возрастает эта линия.
Изобарный процесс легко осуществить, если под поршнем нагревать газ. Молекулы последнего увеличивают свою скорость (кинетическую энергию), создают более высокое давление на поршень, что приводит к расширению газа и поддержанию постоянной величины P.
Оно среди физиков известно как закон Гей-Люссака. Прямая пропорциональность между давлением и абсолютной температурой говорит о том, что график изохорного процесса, как и график изобарного, представляет собой прямую линию с положительным коэффициентом наклона.
Важно понимать, что все изопроцессы протекают в закрытых системах, то есть в их ходе величина n сохраняется.
Адиабатный процесс
Этот процесс не относится к категории «изо», поскольку при его прохождении изменяются все три термодинамических параметра. Адиабатным называют переход между двумя состояниями системы, при котором она не обменивается теплотой с окружающей средой. Так, расширение системы осуществляется за счет ее внутренних запасов энергии, что приводит к значительному падению давления и абсолютной температуры в ней.
Адиабатный процесс для идеального газа описывают уравнениями Пуассона. Одно из них приводится ниже:
График адиабаты отличается от графика изохорного процесса и от графика изобарного, однако он похож на гиперболу (изотерму). Адиабата в осях P-V ведет себя более резко, чем изотерма.
Изопроцессы в газах что такое
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа.
Всякое изменение состояния газа называется термодинамическим процессом.
Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами.
Изопроцессы являются идеализированной моделью реального процесса в газе.
Изопроцессы подчиняются газовым законам.
Газовые законы определяют количественные зависимости между двумя параметрами газа при неизменном значении третьего.
Газовые законы справедливы для любых газов и газовых смесей.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре.
Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта:
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Формулу закона можно записать иначе
где

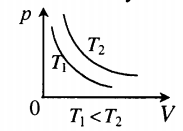
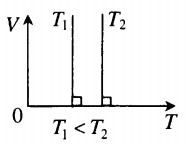
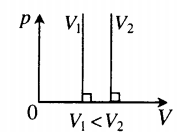
На графиках представлены изотермы для разных температур газа, где Т1
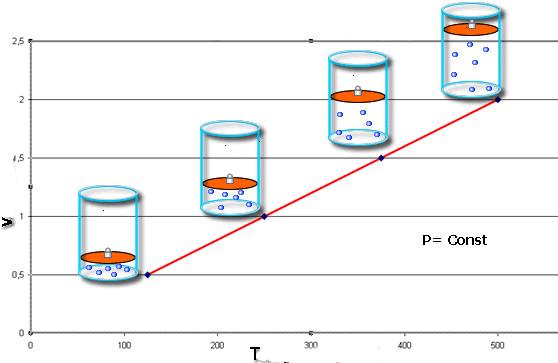
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется.
Формулу закона можно записать иначе
где

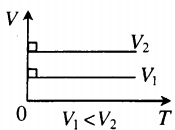
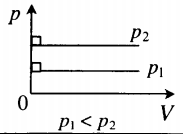
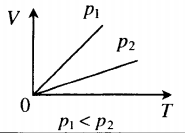
На графиках представлены изобары для разных давлений газа, где р1
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется.
Формулу закона можно записать иначе
где

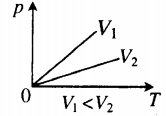
На графиках представлены изохоры для разных объемов газа, где V1 По следам «английских ученых»
Объединенный газовый закон и изопроцессы
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Объединенный газовый закон был открыт экспериментально. Он также является следствием основного уравнения состояния идеального газа. Согласно ему:
При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной:
Объединенный газовый закон применительно к изопроцессам
Объединенный газовый закон объединяет три независимых газовых закона: Бойля — Мариотта, Шарля и Гей-Люссака. Газовые законы действуют в частных случаях — изопроцессах.
Изопроцессы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным.
Изотермический процесс. Закон Бойля — Мариотта.
Изотермический процесс — термодинамический процесс, происходящий в системе при постоянной температуре и массе:
Для изотермического процесса действует закон Бойля — Мариотта:
Закон Бойля — Мариотта
Для газа данной массы произведение газа на его объем постоянно, если температура газа не меняется.
Изохорный процесс. Закон Шарля.
Изохорный процесс — термодинамический процесс, происходящий в системе при постоянном объеме и массе:
Для изохорного процесса действует закон Шарля:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Изобарный процесс. Закон Гей-Люссака.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и массе:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Пример №1. Идеальный газ изобарно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,6 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина.
Так как газ нагревают, то:
Запишем закон Шарля применительно к данному случаю:
Сделаем некоторые преобразования и вычислим начальную температуру:
Подсказки к задачам на газовые законы

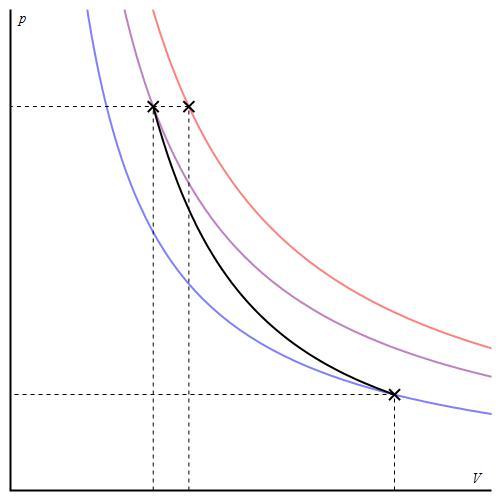









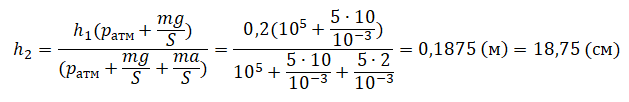

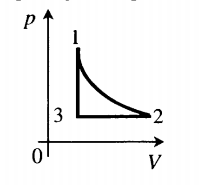
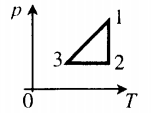
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.