иммунокомпрометированный ребенок что значит
Иммунокомпрометированный ребенок что значит
И.В. Нестерова (1), С.В. Ковалева (2), Г.А. Чудилова (2), Л.В. Ломтатидзе (2), О.Н. Шинкарева (2), В.В. Малиновская (3)
(1) ФГАОУ ВО «Российский университет дружбы народов», Минобрнауки РФ, Москва; (2) ГБОУ ВПО «КубГМУ» Минздрава России, Краснодар; (3) ФГБУ «НИИЭМ им. Н.Ф. Гамалеи» Минздрава России, Москва
Проблема реабилитации диспансерной группы часто и длительно болеющих (ЧДБ) детей не теряет своей актуальности и сегодня, несмотря на широкое освещение вопросов, связанных с оптимизацией используемых приемов и методов, которые в большинстве случаев позволяют добиваться позитивных клинических результатов. В то же время среди ЧДБ детей имеются пациенты, не отвечающие на традиционные методы реабилитации и, несмотря на кажущуюся адекватность проводимых лечебных мероприятий, продолжающие болеть респираторными инфекциями (вирусными, бактериальными или вирусно-бактериальными) с высокой степенью частоты. Такие пациенты, как правило, относятся к категории иммунокомпрометированных, при этом частота эпизодов ОРВИ может достигать 15–24 и более в год. Такая высокая частота возвратных респираторных инфекций является клиническим проявлением инфекционного синдрома, ассоциированного с нарушениями механизмов функционирования противовирусной и антибактериальной иммунной защиты, а также с дефектами системы интерферонов (ИФН). Кроме того, показано, что у детей возвратные ОРВИ часто ассоциированы с различными активными и/или латентными герпесвирусными инфекциями [1–5].
При контакте с вирусами должна происходить немедленная активация врожденного иммунитета – продукция ИФН I типа и провоспалительных цитокинов, которые инициируют последующее включение в активную работу механизмов адаптивного иммунитета. ИФН реализуют свои эффекты через когнитивные рецепторные комплексы (IFNAR и IFNGR) [6, 7]. При острой вирусной инфекции значительно повышаются уровни ИФН и более 70% клеток находятся в состоянии антивирусного статуса, т.е. защищены от внедрения вирусов, и способны активно их обезвреживать. В то же время тяжелые вирусные инфекции повреждают систему ИФН [8], могут приводить к ее истощению и как следствие – присоединению вторичной инфекции. Описаны врожденные генетические дефекты синтеза ИФНα/β и ИФНγ, дефекты рецепторов к ИФНα и ИФНγ (IFNAR и IFNGR), которые сопровождаются клиническими проявлениями тяжелой вирусной и/или микобактериальной инфекции. С другой стороны, многочисленными исследованиями убедительно показано, что вторичное приобретенное нарушение системы ИФН также влечет за собой снижение противовирусной резистентности. Вирусы используют различные контрмеры для борьбы с системой ИФН. Они могут не только ускользать от воздействия ИФН, но и ингибировать действие ИФН, нарушать их продукцию посредством разнообразных механизмов [9–12]. Описаны приобретенные дефекты в системе ИФН у лиц, страдающих повторными ОРВИ и различными герпесвирусными инфекциями (ГВИ). Кроме того, показана возможность длительной персистенции респираторных вирусов, в т.ч. и непосредственно в клетках иммунной системы (ИС) [2, 3, 6, 13].
Наиболее широко в комплексе иммунореабилитационных мероприятий для иммунокомпрометированных детей с повторными ОРВИ и ГВИ используются различные препараты рекомбинантного ИФНα2, что обусловлено универсальным противовирусным, антибактериальным и иммуномодулирующим характером действия ИФНα2 [1, 5, 13–15]. Многолетний опыт использования рекомбинантного ИФНα2 показал, что наряду с позитивными эффектами в ряде случаев при проведении интерферонотерапии у детей как в острый период, так и при повторных ОРВИ, рецидивирующей и/или активной различной ГВИ не удается достичь стойкой и длительной клинико-иммунологической ремиссии, элиминации вирусных патогенов [15]. Предложена и доказана целесообразность модификации интерферонотерапии, заключающейся в применении увеличенных доз и длительности курса терапии в острый период ОРВИ у детей с отягощенным преморбидным фоном [1, 14]. При повышенной восприимчивости к ОРВИ у детей, наличии иммунодефицита и интерферонодефицита обоснованно использование пролонгированной терапии (не менее 2,0–2,5 месяцев) рекомбинантным ИФНα с постепенным «шаг за шагом» снижением суточной дозы препарата каждые 2–4 недели. Однако даже при таком подходе у части иммунокомпрометированных детей при существенном увеличении длительности клинически благополучного периода не удается добиться желаемого клинического эффекта, восстановления нарушенных функций ИС и системы ИФН [13]. В то же время имеются пациенты, страдающие не только возвратными вирусными, но и бактериальными инфекциями респираторного тракта и лимфоглоточного кольца, у которых наряду с нарушениями в системе ИФН имеют место дефекты функционирования противобактериального иммунитета, манифестирующие частыми обострениями хронического тонзиллита, хронического синусита, хронического отита и т.д.
Исходя из изложенного, нами сделано предположение о возможности повышения клинической эффективности и улучшения результатов реабилитации иммунокомпрометированных детей с возвратными ОРВИ, с возвратными ОРВИ осложняющимися частыми обострениями хронической бактериальной инфекции лимфоглоточного кольца и респираторного тракта, ассоциированными с рецидивирующими и латентными ГВИ, за счет оптимизации сочетанной пролонгированной интерферонотерапии с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией.
Цель исследования: разработать эффективную программу интерферонотерапии в сочетании с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией для иммунокомпрометированных детей, страдающих возвратными вирусными или вирусно-бактериальными респираторными инфекциями, ассоциированными с рецидивирующими и/или латентными ГВИ.
Материал и методы
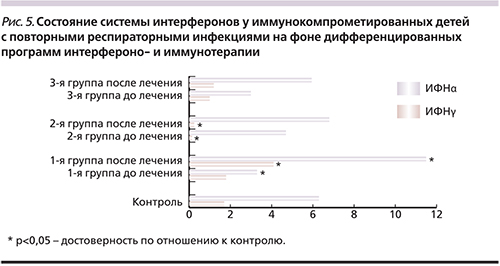
Под нашим наблюдением находились 47 детей в возрасте от 5 до 8 лет обоего пола: 1-я группа – 13 детей, страдавших повторными ОРВИ, ассоциированными с моноили микстГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 2-я группа – 14 детей, страдавших повторными ОРВИ, ассоциированными с моноили микст-ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 3-я группа – 20 детей с повторными ОРВИ, ассоциированными с хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) и хронической ЛОР-патологией. Контрольную группу составили 20 условно здоровых детей, сопоставимых по полу и возрасту. Тестирование состояния ИС и ИФН-статуса проводилось дважды – до и после проведения курсов интерферонои иммунотерапии вне периода острых клинических проявлений респираторных и герпетических инфекций, хронических заболеваний ЛОР-органов. Исследованы: а) субпопуляции Т-, В-лимфоцитов, естественных киллерных клеток (ЕКК) (Beckman Coulter, США); б) уровень сывороточных IgA, IgM, IgG (ИФА); в) фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ) с определением количества активно фагоцитирующих НГ (%ФАН, ФАНабс), оценкой процессов киллинговой активности (ФЧ и ФИ) и переваривания (%П, ИП, ИППА); г) NADPH-оксидазная активность НГ – NBT-тест спонтанный и стимулированный St. aureus (штамм 209): %ФПК, СЦИ и коэффициент мобилизации (КМ – %ФПКст/%ФПКсп.); д) ИФНстатус – уровень сывороточных ИФНα, ИФНγ (ИФА). Детекция герпесвирусов проводилась серологическими и ПЦР-методами. Для выявления типичной и атипичной бактериальной флоры использовались бактериологические посевы из носои ротоглотки, ПЦР и серодиагностика. Для оценки клинической эффективности комбинированной интерферонои иммунотерапии использовались клинические критерии: частота и длительность ОРВИ, длительность клинически благополучного периода. Статистическую обработку данных проводили в программном пакете StatSoft Statistica 6.0. Для сравнения групп использовали непараметрические критерии: U-критерий Манна–Уитни и критерий Вилкоксона. Различие групп полагали статистически значимым при р 0,05) (рис. 5). Значительный дефицит ИФНγ имел место во 2-й группе (0,11±0,07 против 1,78±0,53 пг/мл в контроле, р 0,05). В 3-й группе также выявлено дефектное функционирование системы ИФН. Так, на фоне персистенции респираторных вирусов и репликации герпесвирусов уровень сывороточного ИФНα и ИФНγ не возрастал в ответ на контакт с вирусами, а оставался в пределах контрольных значений (ИФНα – 5,07±0,25 против 6,42±1,05 пг/мл в контроле, р>0,05; ИФНγ – 1,05±0,11 против 1,78±0,53 пг/мл в контроле, р>0,05) (рис. 5). Таким образом, в 100% случаев у детей с повторными ОРВИ установлены дефекты системы ИФН в виде снижения уровня ИФНα и/или ИФНγ либо отсутствия адекватного ответа на вирусную нагрузку системы ИФН.
На основе выявленных нарушений функционирования иммунной и интерфероновой систем нами разработаны программы оптимизированной монотерапии рекомбинантным человеческим ИФНα2b (ИФНɑ2b) в комбинации с антиоксидантами (аскорбиновая кислота и α-токоферола ацетат) и комбинированной интерферонои иммуномодулирующей терапии, учитывающие дифференцированные подходы к реабилитации иммунокомпрометированных детей с повторными ОРВИ. Обследованные иммунокомпрометированные дети, рандомизированные на три группы в зависимости от клинико-иммунологического статуса, получали следующие программы интерферонои иммунотерапии (табл. 1).
В результате проведения базисной системной и локальной терапии ИФНα2b в виде моноили комбинированной интерферонои иммунотерапии продемонстрирована высокая клиническая эффективность разработанных программ лечения детей с повторными ОРВИ, ассоциированными с ГВИ без сопутствующей хронической ЛОР-патологии (группы 1 и 2) или сопровождающимися хроническими заболеваниями ЛОР-органов (группа 3) как после окончания курсового лечения, так и в катамнезе через 1 год (рис. 1). В рамках программного лечения регистрировались единичные, как правило неосложненные, ОРВИ. После окончания курсового лечения частота эпизодов ОРВИ сократилась в 12,6 раза в 1-й группе, в 16,8 – во 2-й, в 10,7 раза – в 3-й группе. Продолжительность клинически благополучного периода существенно возросла (в 3 раза; р1 0,05) и восстановился баланс между CD3+CD4+и CD3+CD8+-лимфоцитами (р>0,05). При этом абсолютное содержание СD16+CD56+-лимфоцитов осталось повышенным (р 0,05), а ИФНγ при тенденции к повышению оставался ниже контрольных значений (с 0,11±0,07 до 0,21±0,12 пг/мл против 1,78±0,53 пг/мл в контроле; р 0,05). Одновременно после курса терапии количество других клеток с цитотоксической направленностью действия – ЕКК – также снизилось незначительно и по-прежнему было достоверно повышенным (р 0,05) при одновременной нормализации поглотительных функций (ФИ – 2,16±0,16; р>0,05). Сохраняется некоторое снижение процессов киллинга и переваривания НГ (ИП – 1,37±0,13; р 0,05) и ИФНγ (с 1,05±0,11 до 1,21±0,86 пг/мл против 1,78±0,53 пг/мл в контроле; р>0,05) в пределах контрольных значений (рис. 5), что сопровождалось позитивными клиниколабораторными параллелями в виде уменьшения вирусной нагрузки: снижения частоты ОРВИ, репликации герпесвирусов.
Следует отметить, что дифференцированные подходы к выбору тактики интерферонои иммунотерапии иммунокомпрометированных детей с повторными ОРВИ демонстрируют различные позитивные модулирующие клинико-иммунологические эффекты во всех группах исследования, направленные на восстановление полноценности реагирования преимущественно врожденного иммунитета и не оказывающие негативного воздействия на имеющийся адекватный ответ адаптивного противовирусного и антибактериального иммунитета. При использовании пролонгированной в адекватных дозах моноинтерферонотерапии и комбинированной интерферонои иммуномодулирующей терапии побочных эффектов, в т.ч. характерных для парентеральных интерферонов, не зарегистрировано ни во время проведения лечения, ни через год наблюдения в катамнезе (табл. 2).
Заключение
Программы комбинированной интерферонои иммунотерапии, разработанные для лечения и реабилитации иммунокомпрометированных детей с повторными ОРВИ (от 8 до 24 и более эпизодов в год), хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) с сопутствующей хронической ЛОР-патологией или без таковой, показали высокую клиническую эффективность: значительное снижение частоты эпизодов повторных ОРВИ, при этом длительность клинически благополучного периода увеличилась с 6 до 11 месяцев в год. Одновременно значительно сократилось число детей с рецидивами орофациальной формы ВПГ I/II типов инфекции и случаи возникновения обострения ГВИ были единичными. Отмечено также уменьшение репликативной активности герпесвирусов (ВЭБ, ЦМВ, ВГЧ VI). Выявлена и позитивная иммунологическая эффективность: отмечен модулирующий характер влияний предложенных программ лечения на Т-клеточное и гуморальное звенья ИС, ЕКК, НГ, систему ИФН. Адекватные дозы монотерапии рекомбинантным ИФНα2 способствуют значимому повышению уровней ИФНα и ИФНγ у детей с ассоциированными повторными ОРВИ и различными ГВИ (1-я группа). Достигнутый эффект повышения уровней сывороточного ИФНα и ИФНγ необходим для элиминации или прекращения репликации респираторных или герпесвирусов. Такое повышение уровней сывороточного ИФНα и ИФНγ является признаком позитивной активации продукции ИФН и коррелирует с позитивной клинической динамикой. Использование интерферонотерпии в комбинации с глюкозоаминилмурамилдипептидом позволило скорректировать дефектное функционирование системы не только ИФН (восстановление преимущественно уровня ИФНα), но и НГ у детей с ассоциированными повторными респираторными и различными ГВИ (2-я группа). При наличии вирусно-бактериального процесса (3-я группа), ассоциированного с неадекватной работой системы ИФН в сочетании с дефектным функционированием НГ и гуморального звена, включение в программу лечения ИРС-19 на фоне пролонгированной терапии ИФНα2b демонстрирует весомые преимущества, связанные с эффективной коррекцией выявленных нарушений, преимущественно гуморального и лимфоцитарного звеньев. Таким образом, отмечена дифференцированность влияний различных программ интерферонои иммунотерапии на восстановление дефектных звеньев ИС и системы ИФН: при выявлении мононарушений в системе ИФН имеет место восстановление уровней сывороточного ИФНα в 100% случаев на фоне пролонгированной терапии ИФНα2b в адекватных дозах, в случаях выраженных дефектов функционирования НГ и нарушений системы ИФН выявлены преимущества комбинированной терапии ИФНα2b и глюкозоаминилмурамилдипептидом, при преобладании дефектов сывороточных иммуноглобулинов и нарушений системы ИФН продемонстрированы позитивные эффекты влияний ИФНα2b и ИРС-19. При этом следует особо подчеркнуть, что ни у одного иммунокомпрометированного ребенка во всех трех группах исследования проведение интерферонотерапии ИФНα2b не сопровождалось побочными эффектами, характерными для парентеральных интерферонов, – ни во время проведения лечения, ни через год наблюдения в катамнезе.
Литература
1. Захарова И.Н., Торжхоева Л.Б., Заплатников А.Л., Коровина Н.А., Малиновская В.В., Чеботарева Т.А., Глухарева Н.С., Курбано-ва Х.И., Короид Н.В., Выжлова Е.Н. Модифицированная интерферонотерапия острых респираторных инфекций у детей раннего возраста: патогенетическое обоснование и эффективность. Российский вестник перинатологии и педиатрии. 2011;3:49–54.
2. Нестерова И.В., Клещенко Е.И., Ковалева С.В., Алексеева О.Н., Чудилова Г.А., Ломтатидзе Л.В. Проблемы лечения вирусно-бактериальных инфекций у часто и длительно болеющих иммунокомпрометированных детей. Российский аллергологический журнал. 2011;2:86–93.
3. Нестерова И.В., Кокова Л.Н., Ломтатидзе Л.В. Значимость коррекции интерферонового статуса в комплексной терапии хронического упорно-рецидивирующего орофасциального герпеса. Цитокины и воспаление. 2010;9(2):67–72.
4. Нестерова И.В., Ковалева С.В., Клещенко Е.И., Шинкарева О.Н., Малиновская В.В., Выжлова Е.Н. Ретроспективный анализ клинической эффективности коротких курсов интерферонов в лечении ОРВИ у иммунокомпрометированных ЧДБ детей. Педиатрия. 2014;93(2):62–67.
5. Маркова Т.П. Часто болеющие дети: взгляд иммунолога. М., 2014. 192 с.
6. Alsharifi M., Regner M., Blanden R., Lobigs M., Lee E., Koskinen A., Mullbacher A. Exhaustion of type I interferon response following an acute viral infection. J. Immunol. 2006;177:3235–41.
7. Malmgaard L. Induction and regulation of IFNs during viral infections. J. Interferon Cytokine Res. 2004;24(8):439–54.
8. Kitagawa Y., Yamaguchi M., Zhou M., Komatsu T., Nishio M., Sugiyama T., Takeuchi K., Itoh M., Gotoh B. A tryptophan-rich motif in the human parainfluenza virus type 2 V protein is critical for the blockade of toll-like receptor 7 (TLR7) – and TLR9-dependent signaling. J. Virol. 2011;85:4606–11.
9. Ren J., Liu T., Pang L., Li K, Garofalo RP, Casola A, Bao X. A novel mechanism for the inhibition of interferon regulatory factor-3-dependent gene expression by human respiratory syncytial virus NS1 protein. J. Gen Virol. 2011;92(9):2153–59.
10. Haller O., Weber F. The interferon response circuit in antiviral host defense. Verh. K Acad. Geneeskd. Belg. 2009;71(1–2):73–86.
11. Shi L., Ramaswamy M., Manzel L.J., Look D.C. Inhibition of Jak1-dependent signal transduction in airway epithelial cells infected with adenovirus. Am. J. Respir. Cell Mol. Biol. 2007;37:720–28.
12. Randall R.E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures. J. Gen.Virol. 2008;89:1–47.
13. Нестерова И.В., Малиновская А.В., Тарака-нов В.А., Ковалева С.В. Интерфероно- и иммунотерапия в практике лечения часто и длительно болеющих детей и взрослых. Capricorn Publishing Inc., 2004. 160 с.
14. Учайкин В.Ф. Информационное письмо. Усовершенствованный способ лечения острых респираторных вирусных инфекций, в том числе гриппа у детей, имеющих функциональные и морфофункциональные отклонения в состоянии здоровья (относящихся к II–IV группам здоровья). Информационное письмо. М., 2012.
15. Нестерова И.В., Ковалева С.В. Клещенко Е.И, Чудилова Г.А., Ломтатидзе Л.В., Шинкарева О.Н., Парфенов В.В., Кольцов В.Д. Оптимизация тактики интерфероно- и иммунотерапии в реабилитации иммунокомпрометированных детей с повторными респираторными и герпетическими вирусными инфекциями. Педиатрия. 2014;93(3):66–72.
Иммунокомпрометированные пациенты в многопрофильном лечебном учреждении
Полный текст:
Аннотация
Ключевые слова
Об авторах
Список литературы
1. Rich R.R., Fleisher T.A., Shearer W.T. et al. Clinical Immunology: Principles and Practice. 4th Ed. Elsevier; 2013.
2. Chear C.T., Ripen A.M., Mohamed S.A., Dhaliwal J.S. A novel BTK gene mutation creates a de-novo splice site in an X-linked agammaglobulinemia patient. Gene. 2015; 560 (2): 245–253. DOI: 10.1016/j.gene.2015.02.019.
3. Hacein-Bey-Abina S., Hauer J., Lim A. et al. Efficacy of gene therapy for X-linked severe combined immunodeficiency. N. Engl. J. Med. 2010; 363 (4): 355–419. DOI: 10.1056/NEJMoa1000164.
4. Audemard-Verger A., Descloux E., Ponard D. et al. Infections Revealing complement deficiency in adults: A french nationwide study enrolling 41 patients. Medicine (Baltimore). 2016; 95 (19): 1–4. DOI: 10.1097/MD.0000000000003548.
5. Gokengin D., Oprea C., Uysal S., Begovac J. The growing HIV epidemic in Central Europe: a neglected issue? J. Virus Erad. 2016; 2 (3): 156–217.
6. Pruetpongpun N., Khawcharoenporn T., Damronglerd P. et al. Disseminated talaromyces marneffei and Mycobacterium abscessus in a patient with anti-interferon-#g autoantibodies. Open Forum Infect Dis. 2016; 3 (2): 1–4. DOI: 10.1093/ofid/ofw093.
7. Готье С.В., Мойсюк Я.Г., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2014 году. VII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2015; 17 (2): 7–22. DOI:10.15825/1995-1191-2015-2-7-22.
8. Готье С.В., Хомяков С.М. Оценка потребности населения в трансплантации органов, донорского ресурса и планирование эффективной сети медицинских организаций (центров трансплантации). Вестник трансплантологии и искусственных органов. 2013; (3): 11–24.
9. Burroughs M., Moscona A. Immunization of pediatric solid organ transplant candidates and recipients. Clin. Infect. Dis. 2000; 30 (6): 857–869. DOI: 10.1086/313823.
10. Rubin L.G., Levin M.J., Ljungman P. et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis. 2014: 58 (3): 309–318. DOI: 10.1093/cid/cit816.
11. Heijstek M.W., Ott de Bruin L.M., Bijl M. et al. EULAR recommendations for vaccination in paediatric patients with rheumatic diseases. Ann. Rheum. Dis. 2011; 70 (10): 1704–1712. DOI: 10.1136/ard.2011.150193.
12. Harpaz R., Ortega-Sanchez I.R., Seward J.F. Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2008; 57 (RR-5): 1–30.
13. Островский Ю.П., Рачок Л.В., Гребенюк И.А. и др. Инфекционные осложнения у пациентов, перенесших ортотопическую трансплантацию сердца. Вестник трансплантологии и искусственных органов. 2011; (4): 24–31.
14. Биличенко Т.Н., Аргунова А.Н., Антонова О.А. и др. Частота пневмококковой пневмонии у взрослых больных терапевтических стационаров на трех территориях Российской Федерации. Пульмонология. 2013; (4): 30–36.
15. Позиция ВОЗ по полисахаридной пневмококковой вакцине. Еженедельный эпидемиологический бюллетень. 2008; 83 (42): 373–384.
16. Moberley S., Holden J., Tatham D.P., Andrews R.M. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst. Rev. 2008; (1): CD000422.
17. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23 valent pneumococcal polysaccharide vaccine (PPSV23). Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2010; 59 (34): 1102–1106.
18. Каракина М.Л. Регистр взрослых пациентов с первичными иммунодефицитами Свердловской области. Общественное здоровье и здравоохранение. 2016; (1); 57–63.
19. Виноградов А.В., Бельтюков Е.К., Каракина М.Л. и др. Опыт организации оказания персонализированной медицинской помощи больным первичными иммунодефицитами в медицинских организациях Свердловской области. Уральский медицинский журнал. 2014; 6 (120): 31–34.
20. Бельтюков Е.К., Виноградов А.В., Тузанкина И.А., Каракина М.Л. Об организации специализированной медицинской помощи взрослому населению Свердловской области по профилю «Аллегология и иммунология». Российский иммунологический журнал. 2014; (3): 482–483.
21. Виноградов А.В., Бельтюков Е.К., Каракина М.Л., Чадова Е.А. Организация оказания медицинской помощи взрослым больным первичными иммунодефицитами с дефектами антителопродукции в Свердловской области. Уральский медицинский журнал, 2015; 9 (132): 57–60.
22. Shearer W.T., Fleisher A., Buckley R.H. et al. Recommendations for live viral and bacterial vaccines in immunodeficient patients and their close contacts. J. Allergy Clin. Immunol. 2014; 133 (4): 961–966. DOI: 10.1016/j.jaci.2013.11.043.
23. Aguilar C., Malphettes M., Donadieu J. et al. Prevention of infections during primary immune deficiencies. Immunocompromised Hosts. Clinical Infectious Diseases Advance Access published September 28, 2014. Available at: http://cid.oxfordjournals.org
24. Снегова Н.Ф., Харит С.М., Лянко Л.М. Основные подходы к иммунизации детей с первичными иммунодефицитами. Бюллетень «Вакцинация. Новости вакцинопрофилактики». Иммунодефициты. 2003; 6 (30): 32–35.
25. International Diabetes Federation Diabetes Atlas, 5th ed. Brussels; 2011. Available at: http://www.idf.org/diabetesatlas
26. Kornum J.B., Thomsen R.W., Riis A. et al. Type 2 diabetes and pneumonia outcomes: A population-based cohort study. Diabetes Care. 2007; 30 (9): 2251–2257. DOI: 10.2337/dc06-2417.
27. Smith S.A., Poland G.A. Use of influenza and pneumococcal vaccines in people with diabetes. Diabetes Care. 2000; 23 (1): 95–108.
28. Fiore A.E., Shay D.K., Broder K. et al. Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2008; 57 (RR-7): 1–60.
29. American Diabetes Association. Standards of Medical Care in Diabetes – 2012. Diabetes Care. 2012; 35 (Suppl. 1): S11–S63. DOI: 10.2337/dc12-s011.
30. Ощепков А.В., Цаур Г.А., Есева С.С. и др. Эпидемиологические аспекты болезни Крона в Свердловской области. Вестник уральской медицинской академической науки. 2015; (3): 36–38.
Проблемы лечения вирусно-бактериальных респираторных инфекций у «часто и длительно болеющих» иммунокомпрометированных детей
Высокая частота заболеваемости детей повторными острыми респираторными инфекциями вирусного и/или бактериального происхождения всегда являлась весьма серьезной проблемой. Таких пациентов принято называть «часто и длительно болеющими» (ЧДБ). ЧД
Высокая частота заболеваемости детей повторными острыми респираторными инфекциями вирусного и/или бактериального происхождения всегда являлась весьма серьезной проблемой. Таких пациентов принято называть «часто и длительно болеющими» (ЧДБ). ЧДБ — это не нозологическая форма. Использование в педиатрии этой терминологии призвано акцентировать внимание клиницистов различных специальностей, в первую очередь, педиатров, оториноларингологов, пульмонологов, на проблемах детей, имеющих излишне частые (повторные) острые респираторные вирусно-бактериальные инфекции (ОРЗ, ОРВИ) различной этиологии. Многочисленными авторами показано сохранение неуклонного роста числа детей, принадлежащих к группе ЧДБ, составляющих 20–65% детской популяции, при этом отмечается резистентность (неотвечаемость) данной категории больных к традиционным методам терапии. На ЧДБ детей приходится 50–60% всех регистрируемых заболеваний. Около 20% ЧДБ детей болеют ОРЗ практически ежемесячно. В 40% случаев к 7–8 годам у ЧДБ детей формируется хроническая патология, при этом риск хронизации прямо пропорционален увеличению кратности эпизодов ОРЗ в течение года.
ОРВИ у ЧДБ детей нередко характеризуются затяжным течением и присоединением осложнений в виде обострений хронических очагов бактериальной инфекции ЛОР-органов, респираторного и урогенитального тракта. В ряде случаев пациенты из группы ЧДБ нуждаются в помощи клинического иммунолога, поскольку имеют серьезные нарушения функционирования иммунной системы и интерферонового статуса. Таким пациентам, как правило, показана адекватная иммунодиагностика, исследование интерферонового статуса, микробиоценоза слизистых (ПЦР, бакпосевы) с последующим проведением интерфероно- и/или иммунотерапии, санации хронических очагов инфекции на фоне диагностического мониторинга.
Наиболее часто педиатрами для формирования групп детей ЧДБ используются возрастные критерии, предложенные Барановым А. А. и Альбицким В. Ю. (1986): на первом году жизни — 4 и более острых и обострений хронических заболеваний в год, на втором-третьем годах жизни — 6 и более ОРЗ в год, на четвертом году — 5 и более, на пятом-шестом годах — 4 и более, на седьмом году жизни и старше — 3 и более ОРЗ в течение года.
В то же время необходимо отметить, что по нашим данным к ЧДБ взрослым пациентам относятся лица, страдающие ОРЗ более 2–3 раз в году, и в ряде случаев длительность заболеваний может колебаться от 7 до 14 и более дней (Нестерова И. В., Малиновская В. В. и соавт., 2005). При этом нами отмечено, что более чем в 50% случаев взрослые субъекты из числа ЧДБ в детстве также относились к группе ЧДБ. Примерно половина из них имела ремиссию в течение 4–6 лет, в которую они выходили, как правило, в период полового созревания. В последующем возврат к частым ОРЗ происходил на фоне различных провоцирующих факторов: тяжелый психоэмоциональный и/или физический стресс, оперативные вмешательства, наркоз, травмы, тяжелый грипп, ветряная оспа, перенесенная в возрасте старше 18 лет, использование больших доз глюкокортикоидов, неспецифических противовоспалительных препаратов и т. д. Эти наблюдения, по всей видимости, свидетельствуют об имеющихся в ряде случаев генетически обусловленных дисфункциях иммунной системы и системы интерферонов у лиц ЧДБ. В то же время манифестацию повторных ОРЗ необходимо рассматривать как проявление «индикаторных инфекций» ассоциированных с недостаточностью функционирования системы интерферонов (ИФН) и иммунной системы — иммунодефицитов, первичного или вторичного характера. Как правило, у детей или взрослых субъектов, имеющих сочетание ряда факторов риска, возможность реализации генетической предрасположенности к частым заболеваниям возрастает. Формирование контингента ЧДБ, детей и взрослых, во многом определяется неадекватностью реагирования иммунной системы и системы интерферонов на различные неблагоприятные воздействия, приводящие к развитию вторичной иммунной недостаточности (Нестерова И. В., 2008).
Именно с персистенцией вирусных и бактериальных антигенов, возникающей на фоне нарушений иммунитета и в то же время их усугубляющей, в последние годы связывают рецидивирующее течение респираторных заболеваний. Причем у 40–60% детей ОРЗ имеют вирусную природу. Среди вирусов ведущее место занимают риносинцитиальные (РС) вирусы, аденовирусы, риновирусы, вирусы гриппа и парагриппа. При неосложненном течении ОРЗ главенствующая роль отводится, как правило, моновирусной инфекции. Элиминация вирусных антигенов значительно затрудняется при частых рецидивах ОРЗ, особенно при наличии вторичной иммунной недостаточности. Так, вирусы гриппа, парагриппа, РС-вирусы, риновирусы, аденовирусы удается идентифицировать в течение продолжительного времени после острого периода болезни — от 2 недель до нескольких месяцев. От 10% до 30% ОРЗ у детей имеют бактериальное происхождение. Из бактериальных возбудителей, вызывающих острые заболевания органов дыхания, доминирующая роль принадлежит пневмококкам, гемофильной палочке. Однако развитие бактериального процесса может быть обусловлено и такими условно-патогенными микроорганизмами, как золотистый стафилококк, клебсиелла, представителями семейства кишечных палочек.
Особую настороженность вызывает возросшая частота заболеваний дыхательных путей, вызванных хламидиями, микоплазмами, уреаплазмами. Эти внутриклеточные паразиты способны к длительной персистенции в клетках эпителия респираторного тракта, особенно у иммунокомпрометированных детей, что и служит причиной инициации бронхообструктивного синдрома, а в дальнейшем формирования хронических воспалительных заболеваний легких, в том числе бронхиальной астмы.
Этиологическая значимость вирусно-бактериальных ассоциаций установлена в 25–30% острых заболеваний респираторного тракта. Клинически смешанная инфекция обусловливает неосложненное и осложненное течение ОРЗ. В случаях развития у детей острого воспалительного процесса нижних дыхательных путей смешанной этиологии вирусный компонент обычно предшествует бактериальному. Наслоение микробной инфекции нередко связывают с агрессией аутофлоры. При повторных ОРЗ, наряду с инфицированием новыми микроорганизмами, происходит активация латентной, персистирующей инфекции вирусного и бактериального генеза, что утяжеляет течение болезни, способствует хронизации процесса.
Ведущими отличительными признаками в клинической картине у ЧДБ детей являются: 1) резистентность (неотвечаемость) к традиционной терапии ОРЗ вирусной или бактериальной этиологии в соответствии с российскими формулярами; 2) проводимое традиционное лечение не предотвращает упорного рецидивирования (повтора) респираторных инфекций; 3) частота повторных инфекций превышает допустимый возрастной уровень и колеблется от 4–6–10 до 12–24 и более в год; 4) длительность ОРЗ превышает 7 дней и может колебаться от 8 до 14 и более дней; 5) ОРЗ вирусной этиологии провоцируют обострение хронических очагов бактериальной инфекции: хронического тонзиллита, хронических риносинуситов, хронического фаринготрахеита, хронического обструктивного бронхита и т. д.; 6) ОРЗ вирусной этиологии осложняется повторными пневмониями, резистентными к традиционной терапии.
Иммунная система (ИС) обеспечивает контроль за поддержанием антигенного гомеостаза в течение всей жизни человека, т. е. контроль как за проникновением чужеродных микроорганизмов и вирусов, так и генетической однородностью клеточных популяций самого организма. Главная функция иммунной системы: иммунологический надзор — распознавание «своего» и «не своего» (чужого), сохранение «своего» и мгновенное уничтожение «чужого». Таким образом, реализуется важнейший феномен иммунитета — феномен защиты организма от проникновения и негативного влияния любых чужеродных субстанций. В реализации реакций иммунной системы принимают участие два важнейших механизма: врожденный иммунитет и адаптивный (приобретенный) иммунитет.
Респираторные вирусы — облигатные внутриклеточные паразиты. Они различаются по своему строению и способам размножения. Одни из них вызывают острые инфекции и достаточно быстро элиминируются из организма хозяина, другие способны к персистенции.
К основным механизмам противовирусной защиты респираторного тракта относят: локальный иммунитет слизистых респираторного тракта (секреторный IgA, ИФН альфа, ИФН бета, провоспалительные цитокины, секретируемые эпителиальными клетками респираторного тракта), систему ИФН (ИФН альфа, ИФН бета, ИФН гамма), естественные киллерные клетки (CD3 + CD16 + CD56 + ), Т-клеточное звено иммунитета (CD3 + CD8 + ; CD3 + CD56 + ; CD8 + CD25 + ; CD3 + CD4 + ; CD8 + HLA-DR; CD4 + CD25 + ), гуморальные механизмы (нейтрализующие противовирусные антитела класса IgG). В настоящее время известно три основных типа ИФН: ИФН альфа, ИФН бета, ИФН гамма. В инфицированных вирусами клетках респираторного эпителия возрастает продукция ИФН альфа и ИФН бета. Эффекты ИФН альфа и ИФН бета: 1) активация противовирусных механизмов в неинфицированных клетках респираторного эпителия — протективный эффект, клетки приобретают невосприимчивость к вирусной инфекции; 2) активация генов с прямой противовирусной активностью. Антивирусные эффекты ИФН альфа и ИФН бета развиваются через несколько часов и длятся 1–2 дня.
Формирование иммунной системы и становление противовирусного иммунитета является результатом реализации генетической программы онтогенеза, для полноценного завершения которой необходима внешняя и внутренняя антигенная стимуляция. В этом аспекте неизбежные инфекции респираторного тракта у детей раннего возраста должны вести к иммунному тренингу организма. Склонность детей, особенно первых лет жизни, к ОРЗ отчасти обусловлена возрастными особенностями развития их ИС, в том числе и местного иммунитета. В свою очередь, слишком частые ОРЗ не могут негативно не влиять на становление ИС растущего организма, так, постоянная вирусно-бактериальная стимуляция ИС у детей ЧДБ ведет к возникновению нарушений ее функционирования, что сопровождается формированием стойкой иммунной недостаточности — вторичного иммунодефицита (ВИД). ВИД может быть представлен нарушениями как общего, так и местного иммунитета и носить комбинированный или изолированный характер.
В таблице приведена частота встречаемости нарушений различных механизмов противовирусного иммунитета у ЧДБ детей.
С целью повышения функциональной активности ИС, системы ИФН и ускорения восстановления их нарушенных функций, направленных на элиминацию вирусных и бактериальных антигенов, необходимо проведение заместительной и/или модулирующей иммунотерапии, восстанавливающей и модулирующей силу иммунного ответа, что должно обеспечить адекватный иммунный ответ на присутствие инфекционного патогена с последующей его элиминацией.
Тактика иммунотропной терапии при ВИД с синдромом вирусных и вирусно-бактериальных инфекций отличается тем, что в основе восстановления системы интерферонов и иммунной системы лежит базисная терапия отечественным рекомбинантным ИФН альфа-2 — Вифероном. Далее проводится необходимая иммунотерапия заместительного или модулирующего характера. При этом тактика иммунотерапии и, в первую очередь, ее длительность зависят от вида ВИД — острого или хронического. У детей ЧДБ, как правило, имеет место хронический или персистирующий ВИД, т. е. нарушения функционирования системы ИФН и иммунной системы существуют достаточно длительное время — от 6 месяцев до нескольких лет. Безусловно, при такой ситуации, в отличие от острых ВИД, когда иммунотерапия может занимать от 10 до 14 дней, проведение иммунотерапии в рамках программы иммунореабилитации детей ЧДБ занимает от 2,5–4,5 месяцев, в редких случаях до 2–3 лет.
Разработанная нами программа иммунореабилитации (Нестерова И. В., 1992) включает следующие положения:
Иммунотерапия, заместительного и модулирующего характера, органично включается в программы иммунореабилитации. К лекарственным препаратам, используемым для заместительной иммунотерапии, относятся внутривенные иммуноглобулины IgG и IgM обогащенные (Интраглобин и Пентаглобин), специфические иммуноглобулины против цитомегаловирусной инфекции (Цитотект), интерфероны (комплексный препарат рекомбинантного ИФН альфа-2 с антиоксидантами — Виферон в различных дозировках), тимические факторы (Тимоген, Тактивин).
Иммуномодулирующая терапия — «золотой стандарт» иммунотерапии. Результатом ее влияний при ВИД с инфекционным синдромом является восстановление работы дефектных звеньев иммунной системы, нивелирование гиперэргических реакций, восстановление адекватности реагирования иммунной системы на имеющиеся воспалительные процессы различной этиологии.
Одним из обязательных условий проведения иммуномодулирующей терапии при ВИД с вирусно-бактериальным инфекционным синдромом является выполнение ее в рамках традиционного лечения. При этом на начальных этапах в зависимости от вида инфекционного синдрома иммуномодулирующая терапия должна обязательно сочетаться с антибактериальной, противовирусной и/или противогрибковой терапией (Нестерова И. В., 2008).
С нашей точки зрения иммуномодулирующая терапия, используемая в лечении ЧДБ детей, должна иметь направленный характер: точкой приложения используемого иммуномодулирующего препарата должно являться то или иное поврежденное звено иммунной системы. При этом используется преимущественная направленность влияния(ний) иммуномодулятора. Так, для восстановления Т-клеточного звена предпочтительным является применение Тактивина, Тимогена, Имунофана, для восстановления гуморального звена, ЕКК, НГ Ликопида и Полиоксидония. Для восстановления системы ИФН — Виферона, который при определенных условиях обладает и иммуномодулирующими свойствами, направленными на восстановление Т-клеточного звена, системы нейтрофильных гранулоцитов. Для иммунопрофилактики и иммунотерапии бактериальных инфекций у детей ЧДБ может проводиться пролонгированная (в течение 5–6 месяцев) терапия топическими иммуномодуляторами — низкоиммуногенными вакцинами (ИРС 19, Имудон, Рибомунил, Бронхо-мунал и т. д.).
Интерферонотерапия с использованием Виферона обладает не только интерферонкорригирующей, иммуномодулирующей, но и противовирусной активностью и в большинстве случаев при возникновении ОРВИ может использоваться локально и системно, без синтетических противовирусных препаратов. Синтетические противовирусные препараты (Арбидол, Ремантадин) лучше использовать в остром периоде ОРВИ при среднетяжелом или тяжелом течении. При необходимости синтетические противовирусные препараты хорошо сочетаются с Вифероном. Хорошо известным фактом является повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, что по данным В. В. Малиновской (1998) служит основной причиной снижения противовирусной активности интерферона. С целью восстановления взаимоотношений между антиокислительной активностью плазмы крови и перекисным окислением липидов в состав препарата Виферон введены токоферола ацетат и аскорбиновая кислота — антиоксиданты, являющиеся мембраностабилизирующими компонентами. В сочетании с ними противовирусная активность рекомбинантного ИФН альфа-2 возрастает в 10–14 раз, при этом отсутствуют побочные эффекты (повышение температуры тела, лихорадка, гриппоподобные явления, психогенная депрессия), возникающие при парентеральном введении препаратов других природных и рекомбинантных ИФН. Ректальное введение Виферона и комбинация с антиоксидантами, по-видимому, обеспечивают эти позитивные эффекты, также как и быструю высокую концентрацию и длительную циркуляцию в крови ИФН альфа-2. Следующим позитивным моментом является установленный факт: при применении Виферона в течение двух лет не выявлены антитела, нейтрализующие противовирусную активность рекомбинантного ИФН альфа-2. Особенности лекарственной формы Виферона — мазь, гель, ректальные суппозитории в различных дозах создают возможность проведения локальной и системной интерферонотерапии.
Нами разработаны основные принципы дифференцированной терапии Вифероном при вторичных ВИД с синдромом повторных ОРВИ, т. е. для детей ЧДБ (Нестерова И. В., 2003; 2005; 2007):
Ниже приведена разработанная нами ранее программа терапии Вифероном для детей ЧДБ с повторными ОРВИ:
Общая продолжительность курса 2,5–3,5 месяца.
NB! При необходимости (значительное снижение уровней индуцированного ИФН альфа!) начальная доза Виферона может увеличиваться в 1,5–2 раза, а курс лечения продлеваться до достижения позитивного клинического эффекта.
Использование описанных выше подходов в лечении детей ЧДБ позволяет получать позитивные результаты, которые можно видеть при оценке клинической эффективности лечения: значительно снижается количество ОРВИ с 10–18 в году до 2–3 в году, сокращается число бактериальных осложнений в 4–6 раз, ускоряется выход в клиническую ремиссию в 6–8 раз, длительность ремиссии увеличивается в 8–10 раз, с 7–10 дней до 100–150 дней, повышается качество жизни детей. Положительные клинические эффекты сопровождаются позитивной динамикой со стороны системы ИФН и иммунной системы.
Таким образом, дети из группы ЧДБ, страдающие повторными («упорно-рецидивирующими») ОРВИ, упорно-рецидивирующими вирусно-бактериальными инфекциями респираторного тракта и ЛОР-органов, в ряде случаев иммунокомпрометированы — имеют серьезные нарушения в иммунной системе по типу ВИД и в системе ИФН. Они нуждаются в проведении адекватной пролонгированной интерфероно- и позитивной направленной иммунотерапии, которые должны органично включаться в программы иммунореабилитации и сопровождаться обязательным мониторированием иммунного статуса и системы ИФН. Описанная выше тактика интерфероно- и иммунотерапии позволяет достигать положительных клинико-иммунологических эффектов: более легкого течения заболеваний в остром периоде, сокращения периода острых проявлений, значительного удлинения периода ремиссии, уменьшения количества бактериальных осложнений на фоне восстановления функционирования иммунной системы и системы ИФН.
И. В. Нестерова, доктор медицинских наук, профессор
Учебно-научный медицинский центр Управления делами Президента РФ, Москва
Таблица
Дефекты противовирусного иммунитета у ЧДБ детей (частота встречаемости в %)