иктеричность кожи что значит
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, врача общей практики со стажем в 14 лет.
Определение болезни. Причины заболевания
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
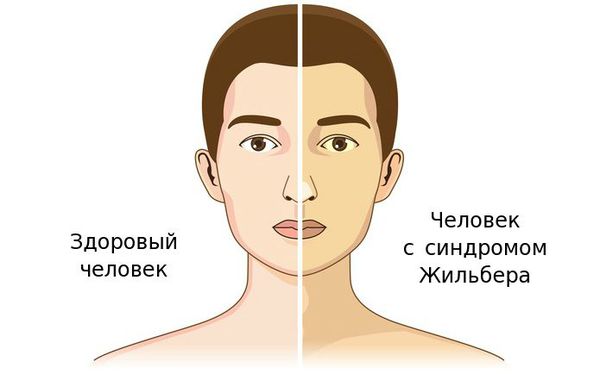
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
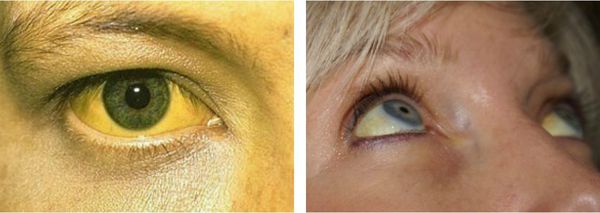
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
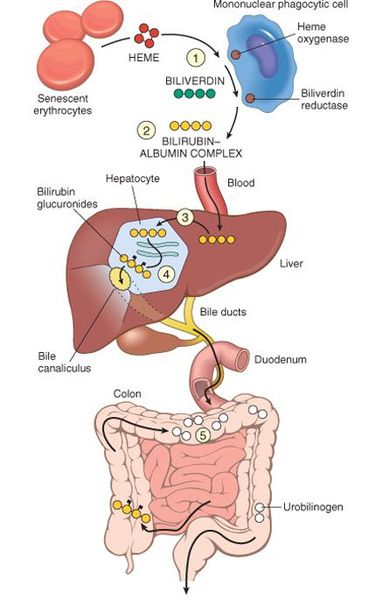
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами («жирами») клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
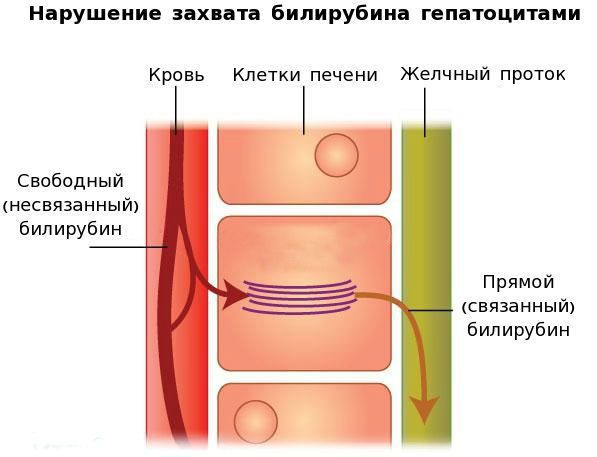
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Cемейные формы функциональных гипербилирубинемий в работе практического врача
Ребенок с синдромом Криглера — Найяра I типа Пациенты с функциональными гипербилирубинемическими состояниями длительное время (по нашим данным, от 6 месяцев до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами. Таблица
 |
| Ребенок с синдромом Криглера — Найяра I типа |
Пациенты с функциональными гипербилирубинемическими состояниями длительное время (по нашим данным, от 6 месяцев до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами.
Известно, что синдром желтух у детей представлен массой состояний. И если гемолитические, гепатитные и, реже встречающие в детском возрасте, механические (хирургические = подпеченочные) желтухи хорошо известны педиатрам и учитываются в дифференциальной диагностике, то так называемые семейные формы (функциональные гипербилирубинемические синдромы) чаще описываются в разделе казуистики [3, 4]. Но по мере изменения структуры заболеваемости на первый план выдвигаются наследственные синдромы. Пациенты с функциональными гипербилирубинемическими состояниями, прежде всего дети, длительное время (по нашим данным, от 6 мес. до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами (гепатиты и т. п.). Между тем вспомнить о заболевании — это значит на 50% его диагностировать.
В связи с этим мы решили обобщить данные литературы и результаты собственных наблюдений.
По времени манифестации и тяжести проявлений одно из первых мест занимает синдром Криглера — Найяра [1].
Синдром Криглера — Найяра тип I — врожденная семейная негемолитическая желтуха с ядерной желтухой в результате полного отсутствия уридин-дифосфат-глюкоронилтрансферазы (УДФГТ) при нормальных функциях печени и отсутствии признаков гемолиза или резус-конфликта.
Патогенез заболевания заключается в отсутствии или резком снижении активности УДФГТ [6], в результате чего значительно повышается сывороточный уровень неконъюгированного жирорастворимого билирубина. Он связывается с альбумином, диффундирует через плацентарный и гематоэнцефалический барьеры (последнее — только у новорожденных). Связывающая (своеобразная буферная, компенсаторная емкость) альбумина уменьшается и соответственно клиническое течение синдрома ухудшается при гипоальбуминемии, ацидозе, увеличении концентрации органических ионов, назначении гепарина, салицилатов, сульфаниламидов, употреблении свободных жирных кислот. Проникновение несвязанного, неконъюгированного билирубина в клетки и митохондрии ведет к блокаде окислительно-фосфорилирующих реакций, особенно в гипоталамусе, хвостатом ядре, подкорковых ядрах, мозжечке.
| По частоте среди врожденных функциональных билирубинемий на первом месте стоит синдром Жильбера. Наш опыт работы в многопрофильных педиатрической и терапевтической клиниках показал, что в каждой из них за год выявляется порядка 10—20 случаев синдрома. |
Дифференциальная диагностика (ДД) проводится с синдромами Жильбера — Мойленграхта, Дабина — Джонса, Ротора, Люси — Дрисколла, ядерной желтухой новорожденных любой другой этиологии, врожденными циррозами печени и гепатитами, атрезией желчных ходов или тонкого кишечника (см. табл.).
Значительно благоприятней протекает синдром Криглера — Найяра типа II. Определение его [7] почти в точности повторяет синдром Криглера — Найяра типа I (врожденная семейная негемолитическая желтуха с ядерной желтухой при нормальных функциях печени), с той лишь разницей, что УДФГТ присутствует, хотя активность фермента значительно снижена. Уровень неконъюгированного билирубина может колебаться в пределах 60— 250 мг/л, фекального уробилиногена — 200—800 мг/л. Эффект от применения фототерапии и индукторов микросомальных ферментов хороший. Желтуха редко достигает степени ядерной, больные доживают до 50 и более лет, но в отделенном периоде, особенно при запоздалом лечении, нередки случаи глухоты, хореоатетоза, нейромышечных и личностых отклонений, гипоплазии зубов.
По частоте среди врожденных семейных функциональных билирубинемий на 1-м месте стоит синдром Жильбера. Наш опыт работы в многопрофильных — педиатрической и терапевтической — клиниках показал, что в каждой из них за год выявляется порядка 10 — 20 случаев синдрома. Но истинная частота, видимо, выше, поскольку диагностика заболевания строится главным образом на данных клиники и функциональной пробы с голоданием, а «клиническая мягкость» не привлекает внимание врача. Так, С. Д. Подымова [5] считает, что синдром Жильбера имеют не менее 1— 5% населения. Наблюдая таких больных, мы пришли к заключению, что синдром ассоциируется с генерализованной дисплазией соединительной ткани (особенно часто по типу синдромов Марфана и Элерса — Данлоса).
Патогенез синдрома неоднозначный. Обнаруживается небольшое снижение активности УДФГТ (на 10 — 30% по сравнению с нормой), однако основное значение придается нарушению захвата билирубина гепатоцитами. Последнее связывают с аномалией проницаемости мембран и с дефектом белка внутриклеточного транспорта. Эта гетерогенность клиренса билирубина проявляется также вариабельностью таких тест-субстратов, как бромсульфталеин и индоцианин зеленый.
Клинически для синдрома характерна субиктеричность различной степени выраженности. Чаще это выражается в иктеричности склер, матовой желтушности кожи, особенно лица, иногда частичном пожелтении стоп и ладоней, подмышечных впадин и носогубного треугольника. Нередко больные жалуются на общую слабость, подавленность, плохой сон, трудность концентрации внимания. Влияние голода на повышение содержания билирубина в сыворотке известно и для здоровых, но значительно выражено при синдроме Жильбера. С целью его выявления проводят пробу с голоданием. В течении 48 часов больной получает питание энергетической ценностью 400 ккал/сутки. В день начала пробы утром натощак и спустя 2 суток определяют билирубин сыворотки крови. При подъеме его на 50 — 100% проба считается положительной.
В последнее время многие специалисты полностью идентифицируют его с синдромом Мойленграхта, рассматривая их как одно состояние — синдром Жильбера — Мойленграхта — и определяют его как доброкачественную семейную конституциональную гибербилирубинемию в результате аномалии ферментов печени [7]. Большое значение для диагноза имеет семейный анамнез (легкая желтушность у членов семьи больного). Клиническая картина проявляется интермиттирующей мало выраженной желтухой, никогда не сопровождающейся ядерной. Желтуха усиливается при голодании, о чем говорилось выше, физических перегрузках, оперативных вмешательствах, употреблении алкоголя, инфекционных заболеваниях. Больных беспокоят тошнота, чувство переполнения желудка, тяжесть в эпигастрии, боли в правом подреберье, запоры или диспепсии. Почти у половины больных обнаруживается скрытый гемолиз (группа риска по холелитиазу!). Наряду с уже упомянутыми неврологическими расстройствами в рамках общей дисплазии соединительной ткани, свойственной этим больным, описывают и такие проявления, как пылающие и пигментные невусы, пигментация век, брадикардия и артериальная гипотония. Применение индукторов микросомальных ферментов очень эффективно. Прогноз хороший. Диагноз строится на клиническом исследовании и лабораторно-функциональных пробах. Гистологические находки (см. табл.) неспецифичны и обнаруживаются далеко не всегда. Поэтому ввиду общего нетяжелого состояния пациентов пункционная биопсия печени вряд ли оправданна (напомним, что риск обследования не должен превышать риска неустановленного диагноза и что прежде больные погибали от болезни, позже от лечения, а сейчас — от обследования).
ДД проводится со всеми типами неконъюгированной билирубинемии, синдромом Криглера — Найяра типа II, гемолитическими анемиями, шунтовыми гипербилирубинемиями (неэффективный гемопоэз с интрамедуллярным образованием значительного количества билирубина = талассемия, пернициозная анемия), постгепатической персистирующей гипербилирубинемией.
Синдром Дабина — Джонса — семейное нарушение выведения конъюгированного билирубина в желчные ходы, сочетающееся с отложением пигмента в печеночных клетках и умеренным увеличением печени («шоколадная печень»). При нем отсутствует нарушение глюкоронирования. Патогенез заключается в недостаточности транспорта конъюгированного билирубина внутрь и из гепатоцита. Билирубин попадает в кровь, его уровень в крови повышается, затем он усиленно выводится через почки. Заболевание может дебютировать в любом возрасте (разная пенетрантность гена?), но нередко проявляется после приема гормональных противозачаточных препаратов или при беременности.
| Влияние голода на повышение содержания билирубина в сыворотке известно и для здоровых людей, но значительно выражено при синдроме Жильбера. С целью его выявления проводят пробу с голоданием. В течение 48 часов больной получает питание энергетической ценностью 400 ккал/сутки. В первый день пробы натощак и спустя двое суток определяют билирубин сыворотки крови. При подъеме его на 50 — 100% проба считается положительной. |
Клинически ВВ проявляется в рецидивирующих периодах желтухи разной степени выраженности, но, как правило, не сопровождается зудом; увеличение размеров печени, а затем и селезенки умеренное. Функциональные печеночные пробы не изменены или изменены незначительно, однако наблюдается замедленное выведение контраста в желчный пузырь, повышение уровня копропорфирина I и снижение уровня копропорфирина III в моче. Гистологически в рибосомах печени откладывается меланиноподобный пигмент от желто-коричневого до черного цвета. Купферовские клетки остаются свободными, а соединительная ткань не разрастается.
ДД проводится со всеми формами конъюгированной и неконъюгированной гипербилирубинемии с желтухой: синдромы Жильбера — Мойленграхта, Ротора, Кароли (кистозное расширение внутрипеченочных желчных ходов), гепатиты, первичный билиарный цирроз, холестаз, синдром (симптомокомплекс) Циве. Синдром Циве — симптомокомплекс с гемолитической анемией, гиперлипидемией и желтухой, развивающийся у пациентов с неумеренным потреблением алкоголя. Он обусловлен увеличенным содержанием С16- и С18-жирных кислот в оболочке эритроцитов при уменьшении содержания длинноцепочечных ненасыщенных кислот. Провоцирующим фактором разрушения эритроцитов чаще является употребление алкоголя, после чего развиваются гемолиз и гиперлипидемия. Клинически синдром проявляется в основном после алкогольных эксцессов и сопровождается усиливающимися болями в правом подреберье и/или эпигастрии, лихорадкой, тошнотой, рвотой, потерей аппетита, увеличением размеров печени, а нередко и селезенки. При лабораторных исследованиях — повышение активности трансаминаз, щелочной фосфатазы, гамма-глютамилтрансферазы, анемия с манифестным или скрытым гемолизом, гиперхолестеринемия и/или гипертриглицеридемия. Гистологически — алкогольная жировая дистрофия печени с циррозом или без.
Формой синдрома Дабина — Джонса (или самостоятельной нозологической единицей?) является синдром Бюрка. При этом также обнаруживается липохромный гепатоз, но БЕЗ желтухи, хотя и СО ЗНАЧИТЕЛЬНОЙ гепатоспленомегалией.
Синдром Ротора — идиопатическая семейная доброкачественная гипербилирубинемия с адекватным повышением конъюгированного и неконъюгированного билирубина.
Патогенез заключается в нарушенном захвате неконъюгированного билирубина гепатоцитами, изменении его глюкоронирования и выведении с последующим рефлюксом билирубина в кровь.
Клинически синдром проявляется хронической желтухой (или субиктеричностью) кожи и слизистых. При этом ее интенсивность флюктуирует, увеличения размеров печени и селезенки не наблюдается. Гистологическая картина печени при световой микроскопии не изменена, при электронной микроскопии — митохондрии различных размеров, в фаголизосомах — пигментные тельца в виде решетчатообразных включений [8].
Диагнозы постгепатической доброкачественной гипербилирубинемии и физиологической желтухи новорожденных, постпрандиальных желтух (длительное употребление большого количества тугоплавких жиров), как прогностически благоприятные, строятся на принципе исключения более тяжелых вариантов гипербилирубинемий. Можно предположить, что подобные состояния связаны с маломанифестными ферментными аномалиями или аномалиями развития желчного пузыря (перетяжки, перегибы, особенно — в области сифона, сужения холедоха, приводящие к повышению давления в желчных ходах и избыточной нагрузке на гепатоцит).
| Синдром Дабина — Джонса может дебютировать в любом возрасте (разная пенетрантность гена?), но нередко проявляется после приема гормональных противозачаточных препаратов и при беременности. |
Семейный доброкачественный возвратный холестаз = синдром Аагенеса = Саммерскилла-Тигструппа = норвежский холестаз = холестаз с лимфедемами. Само обилие синонимов говорит о редкости синдрома: каждый вновь описываемый случай представляется авторам как открытие. Поскольку он редко встречается в литературе, определить истинную его распространенность весьма сложно. В основном он известен из описаний скандинавских авторов. Вероятно, патогенез заключается в гипоплазии лимфатических сосудов печени и других органов.
Клинически синдром проявляется как холестаз (наиболее чувствительный и специфический фермент холестаза — лейцин-аминопептидаза) уже в неонатальном периоде. Затем холестаз самостоятельно уменьшается, рецидивируя у взрослых. Медленно развиваются лимфатические отеки. Типичны гепатомегалия и нарушение функций печени. Гистологически он выражен внутрипеченочным холестазом с гигантоклеточной трансформацией.
Хронический холестаз сопровождается дефицитом жирорастворимых витаминов. Дефицит витамина Е приводит к прогрессирующей мозжечково-спинальной дегенерации (синдром Пермуттера).
ДД синдрома Аагенеса проводится со всеми синдромами холестаза и врожденных лимфатических отеков (синдромы Милроя, Вевера — Смита).
Злокачественный семейный холестаз (болезнь Байлера = синдром Клейтон — Юберга). В подавляющем большинстве случаев проявляется на 1-м году жизни [1]. Вначале холестаз (желтуха) самостоятельно разрешается через несколько недель или месяцев. Затем интенсивность желтухи нарастает, присоединяется мучительный зуд. Печень и селезенка существенно увеличиваются. В результате поражения паренхимы печени возникает геморрагический синдром. Эхографически печень выглядит плотной, напоминает цирротическую, в просвете желчного пузыря наблюдается густой застой. Прогноз плохой.
ДД проводят со всеми синдромами холестаза и синдромом Алажиль.
Синдром Люси — Дрисколл — аутосомно-рециссивно наследуемое редкое состояние, проявляющееся массивной гипербилирубинемией, развивающейся у всех детей, рожденных от одной матери страдающей этим заболеванием, в первые четыре дня их жизни.
Патогенез заключается в наличии фактора — ингибитора конъюгации билирубина в крови и моче матери и постнатально в крови и моче детей. Сыворотка таких матерей ингибирует in vitro конъюгацию билирубина в 5 — 7 раз сильнее, чем сыворотка женщин, не являющихся кондукторами данного синдрома. Вероятно, подобный фактор представлен стероидом, но он до сих пор не идентифицирован. Клиническая картина соответствует тяжелой гипербилирубинемии вплоть до ядерной желтухи.
ДД проводится с синдромами Криглера — Найяра типов I и II, новобиоциновой желтухой, эстрогеновой (транзиторная желтуха детей, вскармливаемых грудным молоком) и окситоциновой желтухой.
Лечение семейных функциональных гипербилирубинемий проводится по следующим принципам:
Литература
1. Алажиль Д., Одъевр М. Заболевания печени и желчных путей у детей. М.: Медицина, 1982. — 486 с.
2. Асоян А. В. Применение гипербарической оксигенации в комплексном лечении гипербилирубинемии у новорожденных с гемолитической болезнью. Автореф. дис. к. м. н. М., 1985. — 24 с.
3. Гасан Абу-Джабаль. Хронический гастродуоденит у детей на фоне дисплазии соединительной ткани. Автореф. дис. к. м. н. М., 1997. — 24 с.
4. Имамбаев С.Е. Эхография в диагностике заболеваний желчевыводящей системы у детей. Автореф. дис. к. м. н. М., 1986. — 24 с.
5. Подымова С. Д. Болезни печени. М.: Медицина, 1993. — 544 с.
6. Emery A., Rimoin D. (Ed.) Principles and practice of medical Genetics. London, Vv. 1, 2. — 1983.
7. Leiber B. Die klinischen Syndrome. Muenchen. — 1990.
8. Moelbert E., Marx R. Elektronenmikroskopiesche Untersuchungen am Lebergewebe beim Rotor-Syndrom. Acta hepato-splenoloy, 1966. — 13. — ss. 160 — 175.
Оценка функций печени и желтуха. Печеночная недостаточность
Желтуха
Определение. Желтая пигментация кожи в результате повышения содержания билирубина в сыворотке крови (иктеричность); часто легче различима на склерах. Желтуха и иктеричность склер заметны клинически при уровне сывороточного билирубина 34-43 мкмоль/л (20-25 мг/л) — примерно в 2 раза выше нормы; желтая окраска кожи также отмечается при повышении содержания каротина сыворотки, но не сопровождается пигментацией склер.
Метаболизм билирубина. Билирубин — основной продукт распада гемоглобина, высвобождающегося из стареющих эритроцитов. Первоначально он связывается с альбумином, переносится в печень, конъюгирует с помощью глюкуронилтрансферазы, превращаясь в водорастворимую форму (глюкуронид), экскретируется желчью и превращается в уробилиноген в кишечнике. Уробилиноген в основном выделяется с калом; небольшая его часть реабсорбируется и выводится через почки. Билирубин фильтруется почками только в конъюгированной форме («прямой» билирубин); таким образом, повышение уровня прямого билирубина в сыворотке крови связано с билирубинурией. Повышенные продукция и экскреция билирубина (даже без гипербилирубинемии, например, при гемолизе) ведут к повышению в моче содержания уробилиногена.
Этиология. Гипербилирубинемия возникает в результате:
Нарушение траспорта билирубина в печени часто сопровождается зудом, возможно, в результате уменьшения желчной экскреции и увеличения отложения солей в коже; перечисленное включает все причины конъюгационной гипербилирубинемии за исключением синдрома Дабина-Джонсона, Ротора и доброкачественного семейного холестаза, когда нарушена только экскреция билирубина.
Диагностика. Важно определить, чем обусловлена Гипербилирубинемия: конъюгированным или неконъюгированным билирубином (см. табл. 221). Гипербилирубинемия за счет конъюгированного (прямого) билирубина обычно результат поражения печеночных клеток (паренхимы), холестаза (внутрипеченочной обструкции) или внепеченочной обструкции. Клиническое обследование включает анамнез (обратить внимание на длительность желтухи, зуд, сопутствующие боли, лихорадку, похудание, факторы риска парентерального заражения, медикаменты, алкоголь, сведения о путешествиях, операциях, беременности), физикальное исследование (увеличение печени, болезненность при пальпации, пальпируемый желчный пузырь, спленомегалия, гинекомастия, атрофия яичек), результаты биохимических печеночных проб (см. ниже), клинический анализ крови. Если печеночные пробы говорят
Таблице 221 Причины гипербилирубинемии
Преимущественно неконъюгированный (непрямой) билирубин
Преимущественно конъюгированный (прямой) билирубин
Гепатомегалия
Определение. Если размер печени по 1. medioclavicularis dextra превышает 12 сд или пальпируется левая доля в эпигастральной области, говорят об увеличении пе чени. Важно исключить опущение печени (например, при ХОБЛ или вздутии пра вого легкого) или расположение в правом верхнем квадранте других тканей (уве лишенный желчный пузырь, опухоль почки или кишки). Размеры печени лучше он Ределить посредством КТ или У ЗИ. Важно оценить контуры и рисунок ткани орган; Увеличение тех или иных участков ткани; «каменистая» консистенция предполагает наличие опухоли; боль при пальпации говорит о воспалении (гепатит) или быстром увеличении размеров органа (недостаточность правого сердца, болезнь Бадда — Киари, жировая инфильтрация).
Печень при циррозе обычно плотна и узловата, часто увеличена (за исключением финала болезни). Пульсация нередко вызвана трикуспидальной регургитацией. При аускультации печени артериальный шум или шум трения указывают на опухоль. Портальная гипертензия иногда сопровождается длительным венозным шумом (табл. 222).
Таблица 222 Важнейшие причины гепатомегалии
Биохимические функциональные печеночные пробы
Используются для оценки функционального состояния печени и дифференциальной диагностики ее поражения (воспалительное, инфильтративное, метаболическое, сосудистое, гепатобилиарное) (табл. 223).
Билирубин. Позволяет судить о поглотительной, метаболической (конъюгация) и экскреторной функциях печени; конъюгированную фракцию (прямую) отличают от неконъюгированной с помощью биохимического исследования (см. табл. 221).
Аминотрансферазы. Аспартатаминотрансфераза (АсАТ) и аланинаминотрансфераза (АлАТ) * — чувствительные индикаторы целости клеток печени, их наибольший подъем происходит при некрозе клеток печени (вирусный гепатит, токсическое поражение печени, циркуляторный коллапс, острая обструкция печеночных вен), иногда при внезапной обструкции желчных путей (камень); активность аминотрансфераз слабо коррелирует с тяжестью болезни; меньшие отклонения отмечены при холестатическом, цирротическом и инфильтративном процессах; АлАТ более специфична для поражения печени, в то время как АсАТ обнаруживается и в скелетной мускулатуре; алкогольное поражение печени ведет к умеренному повышению АсАТ в большей степени, чем АлАТ.
Лактатдегидрогеназа (ЛДГ). ** Менее специфичный показатель целости печеночных клеток, мало ценен для диагностики поражений печени.
Щелочная фосфатаза (ЩФ). *** Чувствительный показатель холестаза, обструкции желчных путей (повышается быстрее, чем билирубин сыворотки) и инфильтрации печени; специфичность невысока изза широкого распространения в других тканях; активность ЩФ в крови также высока у детей, при беременности и поражении костей; специфические тканевые изоферменты можно дифференцировать по различию в термостабильности (печеночные ферменты устойчивы в тех условиях, когда активность ферментов костной ткани резко падает).
Таблица 223 Нарушения печеночных проб
Инструментальные методы исследования гепатобилиарной системы
Ультразвуковое исследование (УЗИ). Быстрый, неинвазивный метод исследования органов брюшной полости; относительно недорог, оборудование портативное; интерпретация данных зависит от опыта эксперта; метод особенно ценен для выявления расширения желчных протоков и камней в желчном пузыре (> 95 %); менее чувствителен для камней в желчных протоках (примерно 40 %); максимально чувствителен в выявлении асцита; умеренно — в исследовании внутрипеченочных образований, дает отличные результаты при дифференциальной диагностике плотных и кистозных образований; полезен при проведении чрескожной пункционной биопсии неясного поражения печени; допплерультрасонография позволяет определить наличие и объем кровотока в воротной, печеночных венах и портосистемных шунтах; визуализация улучшается при асците и ухудшается при наличии кишечного газа; эндоскопическая ультрасонография менее зависит от кишечного газа и позволяет определить глубину прорастания опухолью кишечной стенки.
Компьютерная томография (КТ). Особенно эффективна в определении, дифференциации и проведении чрескожной пункционной биопсии тканей в брюшной полости, кист, участков лимфаденопатии; изображение улучшается при внутривенном или внутрикишечном контрастировании и ухудшается в присутствии кишечного газа; метод менее чувствителен, чем УЗИ, для выявления камней в желчном пузыре при холедохолитиазе; может быть применен при некоторых диффузных поражениях печени (жировая инфильтрация, перегрузка железом).
Магнитнорезонансная томография (МРТ) наиболее чувствительна в диагностике поражения печеночной ткани и кист; позволяет отличать гемангиомы от опухолей печени; очень точный неинвазивный метод оценки проходимости печеночных И воротной вен, сосудистых нарушений при росте опухоли; полезен для мониторирования отложений железа и меди в печени (гемохроматоз, болезнь Вильсона).
Радионуклидное сканирование. Некоторые методики сканирования позволяют с высокой чувствительностью оценить экскрецию желчи (HID A, PIPIDA, DISIDA), изменения в паренхиме печени (технеций серный коллоидный для сканирования печени или селезенки), воспалительные и опухолевые процессы (сканирование с галлием); методика HIDA и др. эффективна в оценке билиарной проходимости и исключения острого холецистита; сканирование с коллоидом, КТ и МРТ одинаково чувствительны в выявлении опухолей и метастазов печени; коллоидное сканирование позволяет точно определить размеры селезенки и достаточно точно определить признаки цирроза и портальной гипертензии; метод комбинированного сканирования с коллоидом печени и легкого чувствителен для оценки поддиафрагмального (надпеченочного) абсцесса.
Холангиография. Наиболее чувствительный метод выявления камней, опухолей в желчных ходах, склерозирующего холангита, кист общего желчного протока, свищей и других поражений желчевыводящих путей. Холангиография может быть выполнена эндоскопически или чрескожно (через ткань печени), позволяет получить пробы желчи и эпителия желчных ходов для цитологического и культурального исследования; дает возможность ввести катетер для дренирования желчи, расширить стриктуры, растворить желчные камни; эндоскопический метод дает возможность провести манометрию сфинктера Одди, сфинктеротомию, удалить камень.
Ангиография. Наиболее точный метод определения портального давления, оценки наличия и направления кровотока в воротной и печеночных венах; высоко чувствителен для выявления небольших сосудистых поражений и опухолей печени (особенно первичной карциномы); является «золотым стандартом» для дифференцирования плотных опухолей от гемангиом; наиболее точный метод для изучения сосудистой анатомии при подготовке к сложной гепатобилиарной операции (портосистемное шунтирование, реконструкция желчных ходов) и для определения возможности резекции опухолей, исходящих из гепатобилиарной системы и поджелудочной железы.