Гипохлорит кальция что это такое
Гипохлорит кальция
Гипохлорит кальция, как правило, применяется в виде порошка или порошка с небольшими комками в составе белесого либо коричневатого оттенка. Вещество также характеризуется наличием резкого запаха хлора и отличной растворимостью в воде.
Химический состав гипохлорита кальция включает в себя:
Для анализа химических реакций и написания уравнений используется следующая формула: Са(СlО)2.
Основная характеристика вещества
Свободный хлор в составе гипохлорита кальция находится в минимальном содержании, что составляет порядка 68%. Помимо этого определены такие параметры, как:
Стоит отметить, что при упаковке, транспортировке и хранении вещества категорически запрещается использование тары из нелегированной и низколегированной стали, так как вследствие воздействия материалов упаковки вещество подлежит процессу разложения. Также не рекомендованы к взаимодействию с Са(СlО)2 медь, чугун, бронза.
Методики производства
Процессы получения гипохлорита кальция зачастую основаны на реакции известкового молока и хлора. Приготовление Са(СlО)2 основано на использовании только очищенного известкового молока, поступающего в емкости – резервуары, с постоянным перемешиванием смеси с целью исключения нежелательного расслаивания полученной суспензии.
Хлорирование известкового молока, протекающее с задействованием гипохлорита кальция, можно представить в виде химической реакции: 2Са (ОН)2 + 2С12 = Са (С10)2 + Са12 + 2Н20 + 52, 6 ккал
Сравнительный анализ гипохлорита кальция и гипохлорита натрия
Отличительной чертой гипохлорита натрия является то, что на практике применения его расход практически в два раза превышает норму расхода гипохлорита кальция. Все дело в том, что гипохлориту натрия свойственно повышенное количество солей в составе.
Очевидны различия веществ и по содержанию хлора: если речь идет о гипохлорите кальция, то свободный хлор находится в пределах показателей от 68% до 75%. В то время как реализация гипохлорита натрия осуществляется в жидком состоянии вещества, в котором часть свободного хлора составляет порядка 10 – 14%.
К преимуществам Са(СlО)2 относятся:
Области применения растворов гипохлорита кальция
Гипохлоритом кальция в состоянии любого из возможных растворов зачастую принято заменять хлорную известь. Как и хлорная известь, гипохлорит кальция широко применяется на всех этапах дезинфекции, включая профилактическую, текущую и заключительную процедуру.
Обработка гипохлоритом кальция гарантирует отличное обеззараживание любых поверхностей, предметов, объектов, включая источники, по сути, представляющие собой очаги возникновения заболеваний инфекционного характера. Способы проведения обработки существуют в нескольких вариантах:
Использование гипохлорита кальция в бытовой сфере
Наибольший спрос на вещество отмечается в бытовой сфере жизни человека. Основываясь на информацию, содержащуюся на упаковке или в инструкции по применению каждого конкретного производителя, определена специфика использования Са(СlО)2:
Востребованный вид готовой продукции
В настоящее время наиболее востребован гипохлорит кальция, состав которого отличается наличием хлора активного в величине 45%. Токсичность Са(СlО)2 определена по ГOCТ 12. 1. 007 – 76. Гипохлориту кальция присвоен 3 класс опасности (умеренно – опасные), с условием попадания вещества в желудочно-кишечный тракт и 4 класс опасности (малоопасные) при воздействии на кожные покровы человека.
Основные поставщики химической продукции
На сегодняшний день рынок химической продукции заполнен как представителями отечественных производителей, так и зарубежных конкурентов. Основными отечественными поставщиками Са (СlО)2 являются:
Особым спросом пользуется нейтральный гипохлорит кальция, представляющий собой смесь Ca(OCl)2 (гипохлорит кальция) с NaCl (хлорид натрия) с присутствием примеси Ca(OH)2 (гидроокись кальция).
Достаточно внушительный сегмент рынка представлен товарами китайских заводов – изготовителей, поставляющих продукцию достаточно высокого качества, но по сравнительно низкой цене, составляющей порядка 4 300 рублей за 50 – килограммовую упаковку при оптовой закупке.
Фасовка и стоимость продукции
Готовый порошкообразный гипохлорит кальция фасуется в специальную тару, среди которой:
Долгосрочная транспортировка зачастую осуществляется посредством использования железнодорожных контейнеров.
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
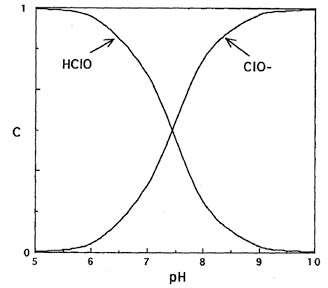
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
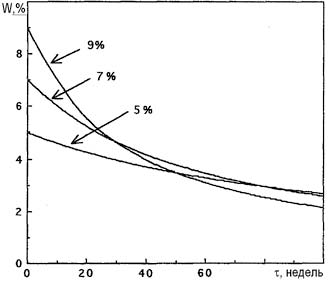
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
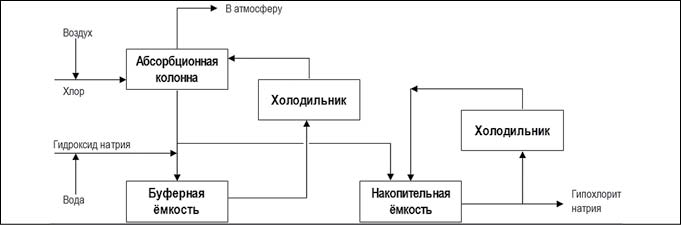
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
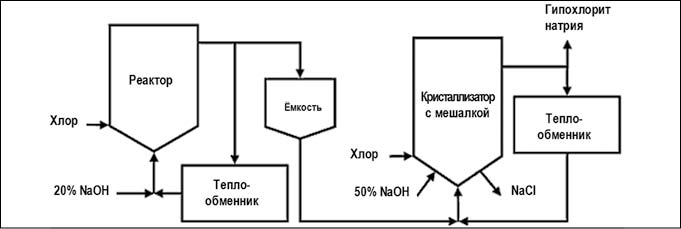
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
Инструкция по применению гипохлорита кальция для дезинфекции
Хлор на протяжении многих лет является эффективным дезинфекционным средством. Его применяли (и сейчас используют) для обеззараживания:
«Гипохлорит кальция [Ca(OCl)2] Твердый (65 или 68%)»
Но положительный эффект и тогда и сейчас во многом зависит от профессионализма тех, кто применяет гипохлорит кальция для дезинфекции и от того используют ли они инструкцию по применению гипохлорита кальция для дезинфекции.
Что такое гипохлорит кальция
Порошок белого цвета, со слабым запахом хлорки – это и есть кальция гипохлорит нейтральный
При определении данного средства используют аббревиатуру КГН.
Содержание хлора в данном средстве не больше 60%, но не меньше 45%. Храниться оно должно строго в герметичной упаковке (именно так его хранят на предприятиях-производителей). Температура при хранении не должна превышать +30 градусов.
Из данного порошка готовят специальный раствор. Он мутный, чуть беловатого оттенка. Храниться может не более трех суток. На дне раствора остается осадок из нерастворимых кальционных солей.
Общее применение
Средство используют при обеззараживании:
Такое средство как гипохлорит кальция 45 применяется при обеззараживании питьевой воды и воды в плавательных бассейнах.
Для дезинфекции одежды данный раствор не применяют, она почти сразу приходит в негодность.
Если раствор попадет в глаза или на незащищенную кожу, может возникнуть покраснение и начаться жжение. Необходимо промыть глаза и кожу большим количеством чистой воды
При попадании в желудок раствор может вызвать воспаление ЖКТ. Это умеренно опасное средство. Лечение при попадании вещества в организм человека должен назначить врач.
Применение гипохлорита кальция должно строго контролироваться специалистами.
Как правильно приготовить раствор
Для дезинфекции КГН используют:
Не осветленный раствор изготовляют из 200 грамм порошка КГН и одного литра воды.
Светлый раствор готовят из не осветленного раствора.
Для получения активированного раствора в светлый раствор подсыпают соли аммония в пропорциях один к двум. Данного типа раствор изготовляют прямо перед применением.
В любом случае только специалисты имеют право изготавливать препараты и проводить их проверку.
Читайте также — Насколько эффективен карбид кальция против кротов
Применение разного типа растворов и порошка
Вопрос о том, где применяют раствор гипохлорита кальция важен. Здесь акценты расставлены очень точно.
Не осветленный раствор применяют для обработки:
Осветленный раствор используют при обеззараживании:
Активированный раствор используют при вспышках вирусных и инфекционных заболеваний (600 мл на квадратный метр).
Порошком обрабатывают выделения больных, остатки пищи, питьевую воду. Порошок используют в больших количествах или в пропорциях один к одному.
Правила работы со средством
Техника безопасности при работе должна обязательно соблюдаться.
Категорически запрещено работать со средством:
Правила оказания помощи при отравлении КГН
В некоторых случаях возникает отравление КГЛ (если не соблюдается техника безопасности или случается авария на производстве). Симптомы отравления:
При появлении первых симптом необходимо:
Если вещество попало в желудок, то нужно вызвать рвоту, а потом выпить молока или воду с нашатырным спиртом (несколько капель на стакан).
При использовании КГН надо руководствоваться инструкцией, которая была специально издана для производителей средства и для тех, кто использует его для дезинфекции.
Наш специалист уточняет информацию, подбирает оптимальное решение Вашей проблемы и договаривается с Вами об удобном для Вас времени выезда мастера.
Полный осмотр помещения, обнаружение зон обитания грибка, грызунов или насекомых и уничтожение заражений. По окончанию обработки Вы получаете бесплатную консультацию, во избежание повторения заражения.
Мы следим за санитарно-техническим состоянием объекта в течение всего срока гарантии.