Гиперсимпатикотония с асимпатикотонической вегетативной реактивностью что это
Основные представления о синдроме вегетативной дистонии у детей и принципах лечения
Опубликовано в журнале:
РАКТИКА ПЕДИАТРА. Март, 2008
Е.В. Неудахин, профессор кафедры детских болезней № 2 ГОУ ВПО «Российский государственный медицинский университет» Росздрава, д-р мед. наук
Для синдрома вегетативной дистонии (СВД) характерно сочетание психоэмоциональных и вегетативных нарушений, вовлечение в патологический процесс практически всех органов и систем организма. На фоне полисистемных нарушений (общих соматоформных расстройств) могут доминировать проявления повреждений отдельных органов, что позволяет специалистам выделять различные клинические синдромы.
До настоящего времени нет общепринятой классификации СВД. Ее разработка на современном этапе является достаточно сложной проблемой, так как отсутствуют ясные концептуальные представления об этом синдроме.
С практической точки зрения целесообразно классифицировать СВД в зависимости от формы, вегетативных типов, фаз развития, клинических синдромов, характера течения. В основу модифицированной нами классификации положена рабочая классификация, представленная в 1987 году группой авторов [Белоконь Н.А., Осокина Г.Г., Шварков С.Б. и др.]. По сравнению с предшествующей, в предлагаемой нами классификации отсутствует раздел, указывающий на ведущий этиологический фактор, так как последний в какой-то степени отражается в форме СВД. Мы предлагаем расширить перечень клинических синдромов СВД, включить в классификацию раздел, характеризующий фазы вегетативных расстройств, при этом учитывается альтернативное взаимодействие симпатического и парасимпатического отделов вегетативной нервной системы (табл. 1).
Таблица 1
Классификация СВД Формы
1. Первичная
2. Вторичная (на фоне заболеваний)
Вегетативные типы
1. Симпатикотонический
2. Ваготонический
3. Смешанный
Фазы
1. Напряженной адаптации
2. Относительной компенсации (альтернативной астении)
3. Декомпенсации (альтернативной депрессии)
Клинические синдромы (изолированные или в сочетаниях)
1. Синдром артериальной гипертензии
2. Синдром артериальной гипотензии
3. Нейрогенные обмороки
4. Цефалгический синдром
5. Вестибулопатический синдром
6. Нейрогенная гипертермия (термоневроз)
7. Функциональная кардиопатия
8. Гипервентиляционный синдром (дыхательный невроз)
9. Дискинезия верхних отделов ЖКТ
10. Дискинезия нижних отделов ЖКТ (синдром раздраженной толстой кишки)
11. Ангиотрофоневроз
12. Нейрогенный мочевой пузырь
13. Функциональная легочная гипертензия
14. Гипергидроз
15. Нейроэндокринный синдром
16. Вегетативные кризы (панические атаки):
— симпатико-адреналовые
— ваго-инсулярные
Характер течения
1. Перманентное
2. Пароксизмальное
3. Перманентно-пароксизмальное
ДИАГНОСТИКА
Для постановки диагноза СВД необходимо комплексное обследование детей.
При оценке вегетативного гомеостаза следует установить следующие функциональные характеристики [Вейн А.М. и соавт., 1981]:
Научная электронная библиотека
Алферова О П, Осин А Я,
3.1. Исходный вегетативный тонус и вегетативная реактивность у подростков
Вегетативная регуляция оценивалась у подростков, проживающих в г. Спасске-Дальнем по исходному вегетативному тонусу (ИВТ) и вегетативной реактивности (ВР). Под наблюдением находилось 124 подростка I группы здоровья в возрасте от 15 до 18 лет (в среднем 15,5 ± 3,5 лет). Из них число юношей составило 60 (48,40 ± 4,51 %), девушек – 64 (51,60 ± 4,51 %) без достоверных различий по полу (р > 0,5). ИВТ изучался методом кардиоинтервалографии (КИГ) в горизонтальном положении. Основные показатели включали моду (Мо), амплитуду моды (АМо), вариационный размах (ΔХ), индекс напряжения (ИН1). ВР исследовалась при записи КИГ в вертикальном положении (Р.М. Баевский, 1984). При этом были рассчитаны Мо, АМо, ΔХ, ИН2. Оценка ВР осуществлялась по отношению ИН в ортоположении (ИН2) к ИН в клиноположении (ИН1). Для этого применялся компьютерный электрокардиограф «Поли-Спектр-12/Е» 2008 года выпуска фирмы «Нейрософт» г. Иваново.
Для изучения исходного вегетативного тонуса у подростков был проведен анализ результатов КИГ. При этом определяли средние величины, их индивидуальные колебания и доверительные интервалы средних величин (табл. 3.1). Показатели Мо в среднем равнялись 0,84 ± 0,01 с
с индивидуальными колебаниями от 0,56 до 1,32 с, АМо – 33,07 ± 1,02 % (от 11,0 до 68,0 %), ΔХ – 0,31 ± 0,02 с (от 0,08 до 1,08 с), ИН1 – 104,94 ± 9,82 у.е. (от 6,80 до 555,60 у.е.). По результатам КИГ определялось четыре типа вегетативного тонуса, включающих состояния эйтонии, ваготонии, симпатикотонии и гиперсимпатикотонии. Состояние эйтонии было установлено у 58 (46,77 ± 4,51 %) подростков, ваготонии – у 21 (16,93 ± 3,42 %), симпатикотонии – у 19 (15,32 ± 3,23 %), гиперсимпатикотонии – у 26 (20,98 ± 3,74 %) обследованных. Отсюда следует, что почти у 1/2 подростков определялось состояние эйтонии, а состояние ваготонии – в 2,8 раза реже (р Подростки ( n = 124 )
(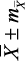
(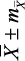
(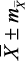
КИГ в горизонтальном положении :
КИГ в вертикальном положении :
Примечание: 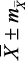
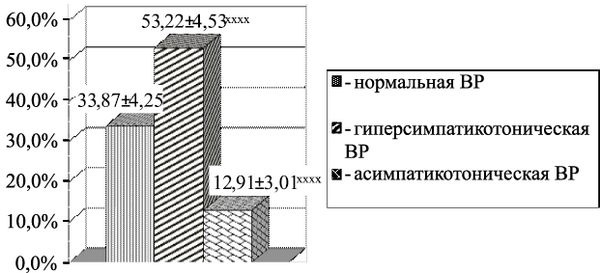
Рис. 3.2. Типы вегетативной реактивности (ВР) у здоровых подростков (%).
Примечание: р – степень достоверности различий между показателями нормальной ВР и других типов ВР (xxxx – р 0,1). Состояние симпатикотонии у юношей встречалось в 2,5 раза реже (р 0,2).
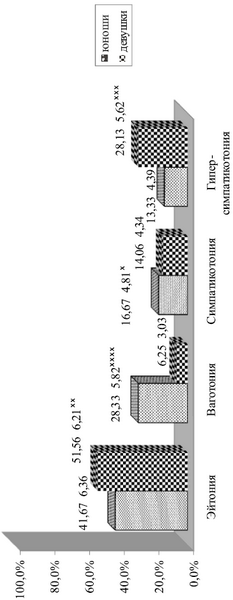
Рис. 3.3. Типы исходного вегетативного тонуса у юношей и девушек (%).
Примечание: р – степень достоверности различий показателей у юношей и девушек (х – р 0,5). Асимпатикотоническая ВР у девушек встречалась в 4,1 раза реже, чем нормальная ВР (р 0,1, р > 0,2, р > 0,1, р > 0,2, р > 0,2, р > 0,2).
Показатели исходного вегетативного тонуса у подростков были изучены по данным кардиоинтервалограмм (табл. 3.2). По сравнению с эйтонией ваготония характеризовалась более высокими величинами Мо в 1,2 раза (р Группы обследованных подростков ( n = 124)
Кардиоинтервало-графия в горизонтальном положении (ИВТ):
Примечание : р1-2 – степень достоверности различий между показателями состояния эйтонии и ваготонии, р1-3 – степень достоверности различий между показателями состояния эйтонии и симпатикотонии, р1-4 – степень достоверности различий между показателями состояния эйтонии и гиперсимпатикотонии.
При оценке результатов КИГ в горизонтальном положении состояние эйтонии определялось чаще и составило почти 1/2 часть от общего числа подростков. Состояние ваготонии определялось в 2,8 раза реже, симпатикотонии – в 3,0 раза реже и гиперсимпатикотонии – в 2,2 раза реже, чем состояние эйтонии. При анализе КИГ в вертикальном положении нормальная ВР определялась почти у 1/3 подростков. Гиперсимпатикотоническая ВР регистрировалась в 1,6 раза чаще, а асимпатикотоническая ВР – в 2,6 раза реже, чем нормальная ВР.
Показатели КИГ, записанной в горизонтальном и вертикальном положении изменялись в зависимости от пола обследованных. Состояние эйтонии и симпатикотонии определялись с одинаковой частотой без достоверных различий у юношей и у девушек. У юношей при оценке показателей КИГ состояние ваготонии определялось в 4,5 раза достоверно чаще, а гиперсимпатикотонии – в 2,1 раза достоверно реже, чем у девушек. У юношей нормальная вегетативная реактивность определялась в 2,1 раза достоверно реже, а гиперсимпатикотоническая ВР – в 1,4 раза достоверно чаще, чем у девушек. Асимпатикотоническая ВР устанавливалась с близкой частотой без достоверных различий у юношей и у девушек.
Определённые различия были выявлены у подростков при исследовании кардиоинтервалограмм в зависимости от ИВТ. В отличие от эйтонии ваготония характеризовалась более высокими величинами Мо в 1,2 раза (на 15,7 %), ΔХ в 1,6 раза (на 38,9 %) и более низкими значениями АМо в 1,4 раза (на 41,1 %), ИН1 в 2,6 раза (на 62,2 %). При сравнении с эйтонией симпатикотония отличалась более высокими величинами АМо в 1,4 раза (на 30,6 %), ИН1 в 2,3 раза (на 57,2 %) и более низкими значениями Мо в 1,1 раза (на 8,1 %), ΔХ в 1,6 раза (на 36,4 %). В отличие от эйтонии при гиперсимпатикотонии регистрировались более высокие величины АМо в 1,9 раза (на 46,5 %), ИН1 в 5,6 раза и более низкие значения Мо в 1,2 раза (на 19,8 %), ΔХ в 2,4 раза (на 57,6 %).
Гиперсимпатикотония с асимпатикотонической вегетативной реактивностью что это
Несмотря на всеобщие усилия, артериальная гипертензия остается одной из самых распространенных заболеваний и наиболее значимых медико-социальных проблем. Последнее обстоятельство связано как с широким распространением этого заболевания, так и с тем, что повышенное давление способствует развитию важнейших сердечно – сосудистых патологий, приводящих к высокой смертности. За последнее десятилетие отмечается рост этого заболевания среди населения молодого возраста. Поэтому так важно начинать своевременную и адекватную терапию [3, 5]. Одними из механизмов, регулирующих артериальное давление(АД), являются нейрогенные механизмы центрального и вегетативного звена. Особенно активно симпатическая нервная система проявляет себя на ранних стадиях АГ у молодых людей. Это проявляется гиперкатехоламинемией (норадреналинемией), повышением тонуса гладкой мускулатуры сосудов, частоты сердечных сокращений, сердечного выброса [1, 7, 8].
В настоящее время пока еще невозможно сделать прогноз, у кого из подростков в будущем может развиться гипертензия. В связи с этим, если у подростков случайно обнаруживается протеинурия, необходимо провести не только общее обследование для исключения серьезной нефропатии, но даже если она не подтвердится, авторы рекомендуют вести длительное наблюдение за артериальным давлением [2, 4, 6].
Изучить показатели вегетативного обеспечения организма у подростков студенческого контингента с артериальной гипертензией и определить тактику их ведения при профилактике с помощью медикаментозной терапии.
Материалы и методы исследования
Под нашим наблюдением находились 4108 студентов, в возрасте от 16 до 21 года, которым проводилось помимо анкетирования-опросника, антропометрические исследования с расчетом индекса массы тела. Проведен анализ распределения вариационных интервалограмм по типу вегетативного тонуса и реактивности для выделения подгрупп с различными функциональными типами вегетативной нервной системы. К лабораторным исследованиям входили определение с помощью высокочувствительных тест-полосок (COMBUR-TEST): плотности мочи, рН, белка, лейкоцитов, эритроцитов, глюкозы, нитритов (бактерий), гемоглобинурии. Обследуемым студентам, кроме измерения АД, проводилось суточное мониторирование артериального давления(СМАД). Также определяли уровень креатинина и холестерина в сыворотке крови. Часть студентов получала грандаксин, основанием выбора которого послужила цель профилактики стресс-индуцированной артериальной гипертензии у лиц студенческого контингента во время планового стресса. Контрольную группу составили 80 студентов, сопоставимых по возрасту и полу, которые как обычно, сдавали тестирование без предварительного приема медикаментов.
Результаты исследования и их обсуждение
Анализ результатов исследования показал, что симптом повышения АД свыше 135/90 мм рт ст выявлен у 312(7,6 %) студентов. Из них: у 148 (3,6 %) в анамнезе хронический пиелонефрит, что составило 47,9 % из студентов с выявленным повышением АД; избыточный вес у 151(3,7 %), что составило 48,4 % из студентов с выявленным повышением АД, сахарный диабет у 4(0,09 %), что составило 1,28 % из студентов с повышенным АД, тиреотоксикоз у 7(0,17 %), что составило 2,2 % из студентов с повышенным АД. Информацию о наличии АГ у подростков 12,2 %, а гипотензивную терапию никто из подростков не получал.
При выявлении эпизодического повышения артериального давления (АД) во время медосмотра или указании на повышение АД в анамнезе студенту проводили суточное мониторирование АД. По результатам суточного мониторирования артериального давления (СМАД) у студентов с выявленной при трехкратном измерении на приеме у врача диагноз артериальная гипертензия был подтвержден у 61 % подростков, гипертония белого халата (ГБХ) установлена в 24,8 % подростков. Мы рассмотрели полученные при СМАД данные с точки зрения гипертонической нагрузки, т.е. в зависимости от количества измерений АД, превышающих 135/85 мм рт. ст., в течение суток. В терапевтической практике считается, что у здоровых людей этот показатель не должен превышать 25 %, при лабильном повышении АД процент превышения составляет от 25 до 50 %, а при стабильном повышении АД – 50 % и более в дневное и ночное время.
По данным СМАД впервые стабильное повышение АД была установлено у 62 студентов, лабильное повышение АД (индекс времени повышенного АД от 25–50 %) у 74, стресс-индуцированная АГ (включая гипертонию белого халата и «маскированную» АГ) – у 176 подростков. Обнаружена протеинурия у 24,4 %, причем экскреция белка с мочой не превышала 0,3 г/л.
У подростков с высоким риском АГ – наличие повышенного веса, курение, потребление кофе более 5 чашек в день и наследственной отягощенности (наличие АГ у близких родственников), но с нормальным АД во время визита к врачу также был проведен СМАД. При этом АГ была установлена в 26 % случаях, маскированная АГ (при визите к врачу АД в норме, а во время СМАД суточный индекс повышенного систолического АД или диастолического АД превышает 30 %) у 21 % подростков. Выявленные отклонения могут свидетельствовать о повышении сосудистого тонуса у подростков, а также о наличии у них нарушений, ассоциируемых с развитием сердечно-сосудистых осложнений во взрослом состоянии. Указанные отклонения отмечены не только у подростков с подтвержденной АГ, но и в группе пациентов, не отвечающих критериям АГ по результатам СМАД.
Проведенный анализ распределение вариационных интервалограмм по типу вегетативного тонуса (состояние покоя) и реактивности позволило выделить ряд подгрупп обследованных с различными функциональными типами вегетативной нервной системы. Выделились 4 наиболее многочисленных подгруппы: с эйтонией и повышенной вегетативной реактивностью (34), эйтонией и нормальной вегетативной реактивностью (61), симпатикотонией и повышенной вегетативной реактивностью (n = 108), ваготонией и сниженной вегетативной реактивностью (n = 31). Достоверная разница была выявлена у лиц с избыточным вегетативным обеспечением по интегрированным показателям, характеризующим баланс механизмов симпатического и парасимпатического отделов (АМо/ВР и индексу напряжения), у лиц с недостаточным – только по индексу напряжения.
Соответственно, при разработке методов профилактики и коррекции планового стресса следует учитывать особенности вегетативной нервной системы у обследуемых лиц. В связи с чем, было проведено исследование терапевтической эффективности вегетокорректора нового поколения – грандаксина (у студентов с наблюдаемой стресс-индуцированной артериальной гипертензией с целью коррекции вегетативных нарушений, который назначался за 45–60 минут до тестирования (планового стресса) в дозе от 50 до 150 мг. Дневной транквилизатор тофизопам– анксиолитик, обладающий умеренной психостимулирующей активностью и выраженным вегетокорригирующим влиянием, с отсутствием седативного и миорелаксирующего эффекта при хорошей переносимости препарата пациентами, не вызывает привыкания при курсовом применении. Грандаксин не вызывает расстройств внимания и концентрации, поэтому после контрольного периода применения и оценки индивидуальной реакции пациенту разрешено управлять транспортным средством. К тому же грандаксин обладает слабым психостимулирующим эффектом, в связи с чем препарат не рекомендуют применять в вечерние часы, чтобы не вызвать нарушение сна. Все эти свойства грандаксина и послужили основанием выбора грандаксина для профилактики стресс-индуцированной АГ у лиц студенческого контингента во время планового стресса.
Контрольную группу составили 80 студентов, сопоставимых по возрасту и полу, которые как обычно, сдавали тестирование без предварительного приема медикаментов. Перед началом медикаментозного лечения мы получили информированное согласие студента.
Результаты исследования показали, что у студентов со стресс-индуцированной АГ, вызванной плановым стрессом (тестированием) состояние исходного вегетативного тонуса в большинстве случаев было представлено выраженной симпатикотонией, которая ответственна за многие клинические проявления данного заболевания, возникновение осложнений, частые гипертензивные кризы. Применение Грандаксина при стресс-индуцированной АГ позволило провести эффективную профилактику гипертензивного криза на 68 % меньше, чем в группе контроля, снизить уровень тревожности и волнения у 98 %, что на 82 % больше чем в контрольной группе. Использование Грандаксин существенным образом отражается на улучшении субъективного и объективного статуса студентов во время сдачи экзаменов. В группе студентов со стресс-индуцированной артериальной гипертензией во время планового стресса и после в течение 24 часов на наблюдалось повышенного АД и частоты сердечных сокращений(ЧСС) более 85 в минуту. Достоверные показатели были получены по снижению уровня АД и ЧСС во время планового стресса на фоне приема грандаксина. В день приема грандаксина эпизодов гипертонических кризов во время сдачи экзаменов не наблюдалось в группе подростков, у которых ранее во время сдачи экзаменов было зафиксировано повышение АД и ЧСС выше нормативных величин.
При этом использование аппаратов для СМАД – обязательно и для постановки диагноза, и для назначения гипотензивной терапии (при обнаружении гипертонии белого халата ее не назначают, а при « маскированной» АГ риск развития осложнений такой же, как и при эссенциальной АГ), и для контроля антигипертензивного эффекта терапии, а также определения продолжительности терапии.
Как дополнительный метод обследования у молодых людей с артериальной гипертензией СМАД может оказаться полезным в плане оценки тяжести заболевания, а также позволит выделить группы с различными видами и формами нарушений в регуляции АД. Сопоставление результатов, полученных при проведении СМАД, с данными анамнеза, состоянием здоровья на момент обследования и данными других инструментальных исследований будет способствовать формированию дифференцированного подхода к лечению и диспансерному наблюдению пациентов с повышенным уровнем артериального давления.
Наличие стресс-индуцированной артериальной гипертензии с выраженной симпатикотонией у подростков, не получающих антигипертензивную терапию, высокий процент выявления маскированной артериальной гипертензии при наличии изменений в моче – свидетельствуют о том, что необходимо активно выявлять студентов с артериальной гипертензией. Применение вегетокорректора грандаксина для профилактики стресс – индуцированной АГ достоверно безопасно и оправдано у лиц студенческого контингента во время планового стресса (сдачи экзаменов). А уменьшение частоты эпизодов повышенного артериального давления снижает гемодинамическую нагрузку на органы – мишени при АГ, что в конечном итоге приведет к профилактике их поражения и более позднему становлению артериальной гипертензии.
Гастроинтестинальные проявления у лиц с дисплазией соединительной ткани, ассоциированные с синдромом вегетативной дисфункции
Вегетативная дистония — состояние, определяемое нарушением вегетативной регуляции сердца, сосудов, внутренних органов, желез внутренней секреции, связанное с отклонениями в структуре и функции центральной и периферической нервных систем [1].
Вегетативная дистония — состояние, определяемое нарушением вегетативной регуляции сердца, сосудов, внутренних органов, желез внутренней секреции, связанное с отклонениями в структуре и функции центральной и периферической нервных систем [1]. Термин «vegetativus» означает «оживляю, возбуждаю, расту», соответствует физиологическому значению вегетативной нервной системы в регуляции функции всех органов и систем.
Среди пациентов имеются лица как с преобладанием тонуса парасимпатического, так и с преобладанием тонуса симпатического отдела вегетативной нервной системы, однако большинство исследователей считают именно симпатикотонию «облигатным» признаком ДСТ [3, 9]. Детально изучены кардиальные проявления вегетативной дистонии на фоне ДСТ, коррелирующие с количеством фенотипических признаков «слабости» соединительной ткани, выраженностью морфологических изменений соединительнотканной недостаточности и определенными клиническими симптомами. Повышенная симпатическая активность ассоциирована с наличием мигрени, артериальной гипертензии, болях в левой половине грудной клетки, пароксизмальной наджелудочковой тахикардии, парасимпатическая — с синкопальными состояниями, экстрасистолией [3, 9].
Доказана высокая частота психопатологических расстройств у лиц с вегетативной дистонией в анамнезе. По мнению многих авторов, именно психопатологические расстройства у лиц с вегетативной дистонией являются первичными. Косвенно в пользу данной теории свидетельствует эффект от лечения бета-блокаторами, применение которых позволяет ликвидировать объективные признаки гиперсимпатикотонии (например, удается снизить частоту сердечных сокращений), но другие проявления вегетативной дистонии сохраняются. Напротив, лечение противотревожными препаратами приводит не только к коррекции психопатологических расстройств, значительному улучшению самочувствия пациентов, но и к исчезновению проявлений гиперсимпатикотонии (снижается частота сердечных сокращений, нормализуется уровень артериального давления, уменьшается количество или исчезают суправентрикулярные экстрасистолы, пароксизмы наджелудочковой тахикардии) [9].
Гастроэнтерологические проявления вегетативной дисфункции при ДСТ изучены не так полно, как кардиологические, психические и другие.
На сегодняшний день доказана высокая частота разнообразных моторно-тонических расстройств органов пищеварения на фоне вегетативной дистонии. Преобладание активности парасимпатического отдела сопровождается гипермоторными и гиперкинетическими, симпатического — гипотоническими, гипокинетическими нарушениями [6].
Расстройства вегетативной нервной системы представлены также разнообразными метаболическими, секреторными, гемодинамическими нарушениями [4, 5, 8]. Усиление кислотообразования и протеолитической активности желудочного сока, снижение гликопротеидов желудочной слизи имеет место при ваготонии. У лиц с поверхностными и очаговыми атрофическими изменениями слизистой оболочки желудка, кишечника преобладает ваготония и недостаточное вегетативное обеспечение деятельности.
Преобладание тонуса симпатического отдела вегетативной нервной системы сопровождается недостаточностью функции сфинктерного аппарата, с развитием разнообразных рефлюксов [7].
При оценке исходного вегетативного тонуса у пациентов с симптомами функциональной диспепсии на фоне ДСТ (в исследование включено 46 пациентов с ДСТ, 14 мужчин и 29 женщин, средний возраст 23,0 ± 1,68 года, группа контроля — 30 пациентов без ДСТ, сопоставимые по полу и возрасту) нарушения вегетативного тонуса зарегистрированы у 65% пациентов с ДСТ и у 63% обследованных из группы контроля (р > 0,05) (табл. 1).
На фоне ДСТ чаще регистрировалась симпатикотония, в группе контроля — активность парасимпатического отдела вегетативной нервной системы. При проведении клиноортостатической пробы у лиц с ваготонией и симпатикотонией в 82% случаев зарегистрированы явления десинхроноза. У всех исследуемых отмечалось значительное увеличение мощности низкочастотных волн (VLF) и их доминирование в общем спектре кардиоинтервалографии. Таким образом, результаты анализов вариативности ритма у молодых больных с ДСТ свидетельствуют о напряжении функционального резерва системы регуляции со стороны вегетативной нервной системы и могут рассматриваться в качестве предикторов напряжения адаптационных возможностей организма.
В настоящее время доказана роль вегетативной нервной системы в возникновении гастродуоденальных эрозий и язв. Механизмы ульцерогенеза при вегетативной дисфункции различны: активация парасимпатической нервной системы сопровождается гиперсекрецией соляной кислоты и пепсина, повышение активности симпатической нервной системы — выбросом в кровь катехоламинов, с последующим спазмом сосудов и нарушением трофики тканей [4, 5].
В проспективном когортном исследовании нами проведена оценка основных характеристик язвенной болезни двенадцатиперстной кишки у пациентов с ДСТ (n = 62) по сравнению с пациентами без ДСТ (n = 32). Выявлено, что у пациентов с ДСТ как в дебюте, так и при обострении заболевания в 80% случаев отсутствовала типичная клиническая симптоматика язвенной болезни, доминировали симптомы диспепсии и внеабдоминальные проявления заболевания (снижение аппетита, похудание) (табл. 2).
У всех пациентов в период обострения наблюдались разнообразные проявления вегетативной дисфункции: астенический синдром, кардиалгии, аритмии, головные боли, головокружения, чувство нехватки воздуха, в 2/3 случаев отмечена полисимптомность проявлений, выраженность которых доминировала в клинической картине болезни (табл. 3).
Приведенные данные свидетельствуют о значимости и генерализованном характере нарушений вегетативой регуляции у пациентов с кислотозависимыми заболеваниями на фоне ДСТ. Нарушения вегетативного статуса оказывают существенное влияние на характер течения язвенной болезни двенадцатиперстной кишки у пациентов с ДСТ. Обострение патологического процесса, по-видимому, способствует развертыванию, усложнению соматогенных вегетативных расстройств.
Лечение вегетативной дисфункции
Немедикаментозная терапия включает [1, 2]:
Терапию следует начинать с нормализации режима дня: очень важно, чтобы ночной сон составлял не менее 8-10 ч, обязательно пребывание на свежем воздухе. Необходимо устранить гиподинамию, ограничить просмотр телевизионных передач до 1 ч в день, работу за компьютером. Целесообразно чередовать физические и умственные нагрузки.
Физические нагрузки. Физические нагрузки, водные процедуры рекомендуются на этапе снятия клинической симптоматики сначала на фоне поддерживающей медикаментозной терапии, а впоследствии и без нее.
Физические нагрузки, независимо от исходного вегетативного тонуса (ваго- или симпатикотония), рекомендуются не менее 40 мин в день в зоне интенсивности пульса, не превышающей 120 ударов в минуту, — пешие прогулки, беговая дорожка, велотренажер и т. д., в среднеинтенсивном режиме. Постепенно интенсивность можно наращивать, но не превышая зону пульса 140-150. На этапе декомпенсации физическая нагрузка не рекомендуется, т. к. это часто приводит к синкопальным срывам. Пациентам, ведущим активный образ жизни и отказывающимся от прерывания физической нагрузки, на этапе лечения рекомендуется смена привычных занятий в сторону седативно-расслабляющих (пилатес, йога) либо лечебная физкультура под контролем специалиста. Благоприятное влияние на пациентов оказывают плавание, катание на лыжах, коньках, дозированная ходьба, игра в настольный теннис, бадминтон. Не рекомендуются занятия групповыми видами спорта (футбол, баскетбол, волейбол), а также боксом, борьбой, кикбоксингом. Если отмечаются выраженные проявления вегетативной дисфункции, особенно протекающие с вегетативными кризами, определяется фаза декомпенсации, то занятия спортом не рекомендуются. В то же время недопустима и гиподинамия, которая способствует усилению вегетативных расстройств.
Питание. Необходимо полноценное питание с достаточным количеством минеральных веществ и витаминов. При симпатикотонии показаны продукты, содержащие калий, магний, витамины А и Е, полиненасыщенные жирные кислоты (сухофрукты, печеный картофель, морковь, бананы, кабачки, зелень, растительное масло и др.), ограничиваются продукты с повышенным содержанием натрия (соленья, маринады, сыры, колбасы и т. д.), а также возбуждающие напитки (крепкий чай, кофе), шоколад. При ваготонии рекомендуется увеличение кратности приема пищи из-за высокого риска развития гипогликемии, показаны продукты, содержащие натрий, кальций (творог, кефир, гречневая каша и т. д.), ограничиваются продукты, усиливающие секрецию пищеварительных желез, а также продукты, вызывающие метеоризм (острые блюда, лук, чеснок, маринады, чипсы, ржаной хлеб, бобовые и др.). Ограничивается потребление жирной пищи. У пациентов, страдающих избыточным весом, хороший эффект достигается на фоне снижения веса пациента. На этапе лечения рекомендуется полный отказ от алкоголя, при стабилизации состояния — ограничение приема, эквивалентное 20 г этанола.
Водные процедуры. Рекомендуются следующие водные процедуры: плавание, циркулярный душ, сауна. Водные процедуры также назначаются на этапе стабилизации соматического состояния.
Бальнеотерапия должна проводиться в зависимости от особенностей вегетативных нарушений. Пациентам с повышенной симпатической активностью показаны ванны с добавлением седативных трав, кислородные. Веерный, циркулярный, пылевой и дождевой душ при ваготонии, солевые, хвойные, нарзанные, родоновые ванны, обливания, растирания холодной водой, жемчужные ванны, применяются циркулярный, игольчатый, струевой, контрастный душ, подводный душ-массаж. Начинать необходимо с процедур малой интенсивности, постепенно увеличивая время пребывания при высокой и низких температурах.
Массаж. Физиотерапевтическое лечение. Выбор методик проводится с учетом направленности исходного вегетативного тонуса и отсутствия противопоказаний (нарушения ритма сердца и т. д.).
Рефлексотерапия применяется как самостоятельно, так и в комплексной терапии.
Цель — нормализация тонуса вегетативной нервной системы. Проводится строго индивидуально с учетом следующих факторов:
Рефлексотерапия повышает уровень метэнкефалинов, которые высвобождаются из надпочечников, что способствует накоплению местных обезболивающих веществ в центральной нервной системе.
Психотерапия достаточно эффективна у пациентов этой группы. Могут быть рекомендованы суггестивные методы воздействия (аутотренинг, гипноз), когнитивно-поведенческая, рациональная психотерапия, арт-терапия.
Психофармакологическая терапия пациентов с вегетативными нарушениями.
Курсы медикаментозного лечения вегетативных расстройств, независимо от превалирующей формы симпатикотонии или ваготонии, обосновано начинать с препаратов, влияющих на метаболические процессы, повышающие активность стресс-лимитирующих систем, оказывающих ГАМК-миметическое и нейротрофическое действие, способствующих восстановлению процессов нейрональной пластичности и не вызывающих седативного, миорелаксантного, холинолитического действия (Тенотен), в сочетании с ноотропными и витаминными препаратами, однако в зависимости от типа вегетативных нарушений. Так, при симпатикотонии возможно использование препаратов Пантогам, Фенибут, Глицин, Кортексин и витаминов А и Е, при ваготонии обосновано использование ноотропных препаратов пирацетамных групп (Пирацетам, Ноотропил, Луцетам, Фенотропил) в комбинации с витаминами группы В.
В дополнение к базовой терапии возможно назначение седативных растительных средств, предпочтительно в форме настоев или отваров. Так, при симпатикотонии возможно назначение в течение дня настоев валерианы, пустырника, пиона, обладающих успокаивающим и спазмолитическим действием. А при ваготонии назначение предпочтительно в первой половине дня, настоек женьшеня, элеутерококка, экстракта радиолы, обладающих мягким тонизирующим действием.
При отсутствии положительного эффекта в течение 2-4 недель терапии необходим переход на этап специализированного психофармакологического лечения, которое должен назначать врач-психиатр.
На начальных этапах независимо от формы вегетативных нарушений обосновано назначение небензодиазепиновых транквилизаторов (Адаптол, Афабазол) в рекомендуемых возрастных дозировках как препаратов, обладающих мягким противотревожным в сочетании с вегетостабилизирующем, ноотропным и стресс-протекторным действием. Отсутствие положительной клинической динамики в течение двух недель предполагает назначение комплексной терапии с использованием бензодиазепиновых транквилизаторов, оказывающим антиксиолитическое, стресс-протекторное, снотворное, седативное, противосудорожное, миорелаксантное и антидепрессивное действие. Нейрохимический механизм действия связан с взаимодействием с ГАМК-рецепторами постсинаптических мембран ГАМГергических нейронов головного мозга, что потенцирует тормозные эффекты гамма-аминомаслянной кислоты.
Антидепрессанты предпочтительны из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) в связи с избирательным влиянием на обратный захват серотонина при минимальном действии на этот процесс норадренолина, а также на гистаминовые, дофаминовые и мускариновые рецепторы. Отличительной особенностью СИОЗС является сочетание в их психотропном действии свойств, присущих как большим, так и малым антидепрессантам с седативно-анксиолитическим и стимулирующим эффектами, что позволяет им оказывать особое, своего рода «сбалансированное», действие. Нейролептики предпочтительны из производных фенотиазина (Сонапакс, Этаперазин), тиоксантана (хлорпротиксен), замещенных бензамидов (сульпирид); транквилизаторы — производных бензодиазепина (Фенозепам, Седуксен, Мезапам) или различных химических групп (Грандаксин, Атаракс).
При симпатикотинии возможно сочетание малых доз нейролептиков (Сонапакс, Этаперазин) в сочетании с транквилизаторами (Фенозепам, Седуксен, Атаракс) и антидепрессантов сбалансированного и седативного действия (пипофезин, пароксетин, флувоксамин, циталопрам, тианептин).
При ваготонии рекомендуются нейролептики без седативного действия (сульпирид, хлорпротиксен), стимулирующих или сбалансированных транквилизаторов (Грандаксин, Мезапам) и антидепрессантов (циталопрам, сертралин, флуоксетин).
Выбор антидепрессанта, кроме формы вегетативных нарушений, должен определяться синдромами дефицита моноаминов, определяемых клинической картиной. Сидром дефицита дофамина определяется сочетанием ангедонии, апатии, эмоциональной отгороженности и нарушением плавности и содержательности мышления. Синдром дефицита серотонина — сниженным настроением, тревогой, различными болями и нарушением пищевого поведения. Синдром дефицита норадреналина — утомляемостью, моторной заторможенностью, трудностью концентрации внимания, соматическими болями. При сочетании дефицита норадреналина, серотонина и дофамина необходимо назначение имипрамина, венлафаксина, пирлиндола; при дефиците серотонина и дофамина — дулоксетин (Симбалта), милнаципран (Иксел), агомелатин (Вальдоксан); при дефиците норадреналина и дофамина — Вальдоксан; при дефиците серотонина — флуоксетин (Прозак), пароксетин (Паксил), сертралин, эсциталопрам; при дефиците норадреналина — мапротилин (Людиомил), миансерин (Леривон); при дефиците дофамина — тианептин (Коаксил).
Литература
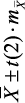

.gif)