Гиперемия плаценты что это
Плацентарная недостаточность
Большинство женщин знают, что плацента связывает маму и малыша во время беременности и при помощи нее к малышу поступают питательные вещества и кислород.
Бывают ли такие ситуации, когда плацента перестает правильно и полноценно выполнять свою функцию? Можно ли как то предотвратить это?
Какую функцию выполняет плацента
Внутри ворсин течет кровь малыша, а снаружи они омываются кровью матери. Между кровотоком мамы и малыша расположен всего один слой клеток, который и играет роль барьера между организмом матери и ребенка. Благодаря этой мембране кровь матери и плода не смешивается.
Однако в последние годы стало известно, что клетки крови плода все-таки проникают через плацентарный барьер в кровоток матери и благодаря этому стало возможным проведение генетических анализов и определение хромосомных аномалий, резуса фактора и пола плода по крови беременной женщины (неинвазивный пренатальный тест).
В плаценте происходит постоянный обмен веществ между мамой и ребенком. Из материнской крови к плоду поступает кислород и питательные вещества, от плода обратно к матери углекислый газ и продукты обмена, подлежащие выведению из организма.
Важной функцией плаценты является выработка гормонов и биологически активных веществ. В первую очередь это гормоны, важные для успешного вынашивания беременности, например хорионический гонадотропин, плацентарный лактоген, эстрогены и др.
К сожалению, не всегда все складывается вполне благополучно. В силу самых различных причин на разных сроках беременности могут происходить отклонения в развитии и функционировании плаценты. Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Если плацента перестает выполнять свои функции в полной мере, развивается так называемая плацентарная недостаточность. По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
Виды и причины плацентарной недостаточности
Врачи различают острую и хроническую плацентарную недостаточность:
Острая плацентарная недостаточность
Это состояние, требующее экстренного вмешательства врачей. Она характеризуется стремительным ухудшением плацентарного кровотока. Острая плацентарная недостаточность возникает в основном в результате отслойки плаценты или гибели отдельных участков ткани плаценты например при образовании тромбов в сосудах. Причиной отслойки может послужить травма живота, антифосфолипидный синдром.
Фосфолипиды – это сложные жиры, которые входят в состав оболочек всех клеток организма. В ряде случаев иммунная система организма вырабатывает большое количество антител к некоторым собственным фосфолипидам и белкам, связывающим эти липиды. Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Антифосфолипидный синдром является самой частой причиной тромботических осложнений при беременности, в том числе причиной отслойки плаценты и острой плацентаной недостаточности.
Вызвать отслойку плаценты может также тяжелое течение гестоза – грозного осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Острая плацентарная недостаточность развивается при отслойке более 2/3 поверхности плаценты.
В случае развития острой плацентарной недостаточности необходимо максимально быстро провести операцию кесарева сечения для сохранения жизни малыша и мамы.
Хроническая плацентарная недостаточность
Значительно чаще у беременных женщин встречается хроническая плацентарная недостаточность. В этом случае происходит нарушение формирования и созревания плаценты, уменьшается маточно-плацентарный и плодово-плацентарный кровотоки, ограничивается газообмен и обмен веществ в плаценте, снижается синтез плацентарных гормонов. Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Причинами плацентарной недостаточности чаще всего являются перенесенные аборты, особенно хирургический аборт при первой беременности, курение, при этом количество и крепость выкуриваемых сигарет значения не имеют, поскольку на формировании неполноценных сосудов плаценты негативное действие оказывает табачный дым, а не никотин.
В группу риска по развитию плацентарной недостаточности входят также женщины с хроническими заболеваниями, такими как артериальная гипертензия, железодефицитная анемия, пиелонефрит, сахарный диабет, заболевания щитовидной железы.
В последние годы наблюдается значительный рост плацентарной недостаточности, вызванной бактериями, вирусами, грибами. Причиной этого может быть как острая инфекция, перенесенная будущей мамой во время беременности, так и активация хронического инфекционного процесса в организме беременной женщины.
Немаловажное значение в формировании хронической плацентарной недостаточности играет патология матки: эндометриоз, пороки развития матки (седловидная, двурогая). Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
В некоторых случаях плацентарная недостаточность может быть обусловлена наличием хромосомных нарушений у плода, в частности при синдромах Дауна (наличие дополнительной 21 хромосомы у плода) или синдроме Эдвардса (дополнительная 18 хромосома у плода) уже в ранние сроки беременности диагностируется нарушение функции плаценты.
Следует отметить, что среди осложнений беременности, наиболее часто приводящих к развитию хронической плацентарной недостаточности, существенным фактором является преэклампсия (или поздний гестоз) – это осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Независимо от факторов, способствующих развитию плацентарной недостаточности, в основе ее лежат нарушения кровообращения в маточно-плацентарном комплексе, приводящие к нарушению всех функций плаценты. Следовательно, симптомы хронической плацентарной недостаточности будут обусловлены недостатком поступления кислорода и питательных веществ к плоду.
Это прежде всего, задержка внутриутробного развития плода – отставание размеров плода и замедление темпов его роста. Часто имеют место изменение двигательной активности плода. Сначала может быть некоторое усиление движений, а затем уменьшение. Нарушение защитной функции плаценты приводит к внутриутробному инфицированию плода под действием проникающих через плаценту патогенных (болезнетворных) микроорганизмов. Плод, развитие которого происходит в условиях плацентарной недостаточности, в значительно большей степени подвержен риску травматизации в родах, у них отмечается нарушение адаптации к внеутробной жизни, повышенная заболеваемость в первый год жизни.
По времени возникновения врачи разделяют плацентарную недостаточность на раннюю и позднюю.
Ранняя (или первичная) плацентарная недостаточность
Развивается до 16 недель беременности. Она возникает уже на этапе формирования плаценты и связана с заболеваниями беременной женщины, имеющимися до беременности, к примеру с патологией матки, хронической артериальной гипертензией, эндокринологическими заболеваниями. При этом происходит формированием неполноценных сосудов в плаценте.
Поздняя (или вторичная) плацентарная недостаточность
Возникает после 16 недель беременности и чаще всего связана с заболеваниями, возникшими уже во время беременности. Чаще всего это железодефицитная анемия (то есть снижение концентрации гемоглобина и железа в крови), гестационный сахарный диабет (то есть нарушение усвоения организмом глюкозы, возникшее на фоне беременности), перенесенные вирусные и бактериальные инфекции.
Важным является подразделение плацентарной недостаточности на компенсированную и декомпенсированные формы.
Компенсированная плацентарная недостаточность
Развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции.
Декомпенсированная плацентарная недостаточность
Вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Диагностика плацентарной недостаточности
Лечить уже развившуюся плацентарную недостаточность практически невозможно, поэтому врачи активно стремятся выявлять беременных женщин, угрожаемых в отношении формирования нарушений функции плаценты. Если плацентарная недостаточность выявляется в 3 триместре беременности, эффективного лечения, к сожалению, не существует. Поэтому очень активно в настоящее время применяются все способы выявления в ранние сроки беременности тех женщин, в формировании плаценты которых произошли нарушения.
В первую очередь, при постановке на учет по беременности выявляют максимально значимые факторы риска – курение, перенесенные аборты, отягощенную наследственность (низкий вес при рождении, склонность к тромбозам), наличие хронических заболеваний сердца, сосудов, сахарного диабета.
Профилактические мероприятия против развития плацентарной недостаточности особенно актуальны и необходимы до 16-17 недель беременности, когда происходит формирование структур плаценты.
Значимую помощь в оценке риска развития плацентарной недостаточности оказывает пренатальный скрининг, который проводится в 11-14 недель беременности. Он проводится для выявления синдромов Дауна, Эдвардса и др. хромосомных болезней у плода. В настоящее время самым актуальным является проведение комплексного ранний скрининг беременной на прогнозирование риска развития плацентарной недостаточности, преэклампсии и внутриутробной задержки развития плода. Поскольку данный вид диагностики относится к самым современным и передовым, к сожалению, он пока не включен в перечень услуг, предоставляемых в женской консультации в рамках ОМС, но доступен всем желающим в центрах пренатальной диагностики.
Определение белков, вырабатываемых плацентой
В первую очередь проводят определение белка РАРР-А, он является также маркером хромосомных аномалий плода. Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Второй гормон плаценты, который помогает в оценке рисков плацентарной недостаточности – PIGF (плацентарный фактор роста). Его концентрация в крови снижается задолго до первых проявлений плацентарной недостаточности. Его определение применяют не настолько широко, как PAPP-A, но тем не менее многие лаборатории уже включили данный белок в пренатальный скрининг 1 триместра. Крайне важное значение при проведении скрининга 1 триместра имеет измерение кровотоков в сосудах матки. Однозначно доказано, что сужение сосудов матки, определяемое при исследовании, свидетельствует о неполноценности формирования плаценты, которое будет ухудшаться с увеличением срока беременности и приведет к снижению питания малыша и снабжения его кислородов, то есть к развитию плацентарной недостаточности и задержки развития плода. При нормальных размерах маточных сосудов в 11-14 недель беременности риск тяжелой плацентарной недостаточности ничтожно мал.
Следующее обязательное скрининговое ультразвуковое исследование проводится в 20-21 неделю беременности. При этом обязательно проводят измерения плода, чтобы оценить, нет ли отставания в росте. Ведь при кислородном голодании замедляются темпы роста плода и размеры его начинают отставать от нормы для каждого срока беременности. Кроме того врач обязательно оценивает состояние и зрелость плаценты. Во время УЗИ проводится также допплерометрия сосудов матки для выявления ранних изменений, предшествующих клиническим проявлениям плацентарной недостаточности.
У пациенток, относящихся к группе высокого риска кроме УЗИ и допплерометрии проводят также суточное мониторирование колебаний артериального давления, определение количества белка в анализе мочи, собранном за сутки, оценивают показатели системы свертывания крови.
Третье УЗИ проводится всем будущим мамам в 30–34 недели беременности. Врач измеряет окружность головы и живота крохи, длину костей его ручек и ножек, и вычисляет предполагаемый вес плода. Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Допплерометрия
Допплерометрия сосудов плаценты и пуповины (метод исследования скоростей кровотоков в этих сосудах) так же позволяет оценить самочувствие малыша. Доктор исследует кровоток в артериях матки, пуповины, сердца и мозга ребенка. Это исследование позволяет определить, хорошо ли работает плацента, нет ли признаков нехватки кислорода у малыша, или развития гестоза у мамы. При снижении скорости кровотока в каком-либо сосуде можно говорить о нарушениях питания плода различной степени тяжести.
Вовремя проведенное обследование позволяет выявить начальные стадии дефицита кровоснабжения. В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
Кардиотокография
Это важный метод оценки состояния плода. Проводится КТГ при сроке беременности 33 недели и более, поскольку только на этом этапе внутриутробного развития малыша устанавливается полноценная регуляция деятельности сердечно-сосудистой системы плода центрами спинного и головного мозга. Запись сердцебиений плода проводят в течение 20–40 минут, а при необходимости исследование может быть продлено до 1,5 часов.
Аппарат регистрирует и записывает частоту сердцебиений малыша. Врач акушер-гинеколог оценивает кривую записи сердцебиений, эпизоды урежения и резкого учащения частоты сердечных сокращений плода и на основании этих данных делает заключение о том, насколько комфортно малыш чувствует себя в животе у мамы. К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
Лечение плацентарной недостаточности
Специфических способов лечения плацентарной недостаточности в настоящее время не существует, поскольку нет лекарственных препаратов, которые избирательно улучшают маточно-плацентарный кровоток. Именно поэтому все меры борьбы с плацентарной недостаточностью направлены на профилактику. Если пациентка относится к группе высокого риска по развитию плацентарной недостаточности, с раннего срока беременности ей назначают лекарственные препараты, эффективность которых хорошо доказана и которые предупреждают раннее развитие выраженных нарушений функции плаценты.
Если во время проведения дополнительных методов оценки состояния плода выявляются начальные нарушения поступления кислорода к малышу, проводится медикаментозное лечение, направленное на увеличение притока крови и кислорода через плаценту и обязательные контрольные обследования на фоне проводимой терапии. Если изменения серьезные и малыш испытывает выраженный дефицит кислорода и питательных веществ, состояние его страдает, то в таких случаях проводится экстренное родоразрешение.
Гиперемия плаценты что это
Плацента – важный орган, основное предназначение которого – снабжение кислородом и питательными веществами развивающийся плод во время беременности. При физиологическом течении беременности плацента также обеспечивает иммунологическую толерантность организма матери по отношению к плоду, предотвращая развитие аутоиммунных реакций, являясь своеобразной «подушкой безопасности», а также выполняет эндокринную функцию, синтезируя те гормоны, которые эндокринная система плода не способна синтезировать [1, 2]. Для иммунной системы матери во время беременности баланс между реактивностью и иммуносупрессией склоняется в сторону реактивности. Однако не менее важна барьерная роль плаценты в защите плода от различных микроорганизмов. Локальные иммунные реакции могут потенциально активировать материнский иммунный ответ, что также способствует проникновению патогенных микроорганизмов в амниотическую жидкость, ткань плаценты, проникновение их в ткани, ииммунокомпетентные органы плода. Иммунная система плода ещё незрелая, не готова адекватно распознать болезнетворные бактерии и их эллиминировать. В качестве антигенов могут выступать как микроорганизмы, так и аллоантигены плода, антигены плаценты, аутоантигены матери, которые становятся мишенью для материнского организма. Независимо от их этиологии, в результате сбоя иммунной системы эти факторы могут привести к неблагоприятным результатам, таким как внутриутробная гибель плода, преждевременная роды, задержка роста плода, нарушение развития и дифференцировки внутренних органов.
Одно из первых мест в структуре акушерской патологии занимают инфекционные и воспалительные заболевания беременной, часто скрыто протекающие, достигающие 15–30 % всех преждевременных родов (ПР). Хориоамнионит (ХА) встречается примерно у 15 % беременных [3]. Распространенность ХО составляет в 3–5 % плацент доношенного срока геcтации из которых в 94 % проявляется на 21–24 неделе беременности [4]. В соответствии с современной международной морфологической классификацией повреждений плаценты, разработанной Амстердамской рабочей группой (Amsterdam Placenta Working Group) (2014) [5], воспалительные изменения плаценты делятся на изменения, обусловленные инфекционными агентами и связанные с асептическим воспалением, опосредованные иммунными процессами. В свою очередь воспаление, вызванное инфекционными факторами, бывает с преобладанием воспалительного ответа со стороны матери (преимущественно острым (например, воспаление амниотических оболочек – острый хориамнионит, или со стороны плода (васкулиты сосудов пуповины – фунизит), поражения ворсин плаценты и межворсинчатого пространства – виллиты и интервиллиты), а также децидуальной пластинки, граничащей с полостью матки – децидуит. Воспаление, обусловленное иммунопатологическими процессами, чаще бывает хроническим и представлено хроническим виллитом и хроническим ХА, хроническим децидуитом с инфильтрацией лимфоцитами и плазмоцитами, а также к хроническому воспалению относятся Т-клеточный эозинофильный фетальный васкулит, хронический гистиоцитарный интервиллузит.
Взаимосвязь инфекции влагалища и цервикального канала с ХА, разрывами плодных оболочек и преждевременными родами показано рядом авторов [6]. Однако соответствие гистологических критериев, клинических признаков воспаления и выявление возбудителя (выявленного посредством ПЦР) происходит менее чем в половине случаев [7].
Как и все органы, плацента и плацентарная площадка содержат популяции резидентных воспалительных клеток, которые, как считается, играют решающую роль в развитии и функционировании плаценты. К наиболее важным относятся популяции больших зернистых (гранулярных) лимфоцитов в децидуализированном эндометрии и клетки Гофбауэра стромы ворсин. Первые состоят преимущественно из натуральных киллеров и играют роль в трансформации и ремоделировании спиральных артерий [8], имеют тенденцию к образованию кластеров около желёз эндометрия, и материнских сосудов, но это не сопровождается повреждением тканей. Клетки Гофбауэра представляют собой тканевые макрофаги и, как полагают, принимают участие в васкуляризации ворсин плаценты и защите плода от патогенов и других потенциально опасных медиаторов, которые могут нарушить гемоплацентарный барьер [9], а также играют роль в ангиогенезе, который проявляется на этапе незрелых промежуточных ворсин, когда присутствуют клетки стромы, формирующие пространство будущего кровеносного сосуда с образованием так называемых стромальных каналов, в просвете которых циркулируют макрофаги [10], что особенно важно на ранних сроках гестации. Клетки Гофбауэра обычно по внешнему виду выглядят одинаковыми и, как правило, равномерно распределены в строме ворсин и больше представлены в плаценте на ранних сроках. Выявление в ткани плаценты и матки нейтрофилов, эозинофилов, В- и Т-лимфоцитов, а особенно плазмоцитов составляет основу для патологического воспаления ткани плаценты. Острый воспалительный ответ с преобладанием нейтрофилов наблюдается преимущественно в амниотических оболочках, при ХА, и выявляется примерно в 20 % всех плацент [11]. Хронический хориоамнионит (ХХА) воспаление с преобладанием лимфоцитов встречается в 5–15 % плацент нередко связано инфекцией, но может быть опосредовано аутоиммунными заболеваниями или аллоиммунными реакциями против последствий предыдущих инфекций или инфекций, вызванных еще нераспознанными патогенами, хотя этот вопрос требует дальнейшего изучения.
Хориамниониты являются отражением большого количества факторов риска, при котором гистологические критерии не всегда полно отражают клиническую картину. ХА часто сочетаются с воспалением других частей плацентарного диска (децидуальной оболочки (децидуит), ворсин плаценты (виллит), пупочного канатика (фунизит).
Гистологически острый хориоамнионит (ОХА) определяется как материнская нейтрофильная реакция на бактериальную инфекцию с или без сопутствующего ответа со стороны плода. ХА традиционно имеет место две основных классификации: гистологическую базирующуюся на воспалительной инфильтрации плодных оболочек (нейтрофилами, макрофагами и Т-лимфоцитами). Вторая основана на клинической манифестации локального и системного воспаления:
1) температура более 37,5 °С;
2) наличие болезненности при пальпации матки;
3) боли внизу живота;
4) неприятный запах при влагалищном исследовании;
5) тахикардия у беременной (более 100 ударов в минуту);
6) тахикардия у плода (более 160 ударов в минуту);
7) повышение лейкоцитов крови матери более 15 000 тыс/мм3) [7, 12].
Кроме того, повышение температуры тела может быть ассоциировано также с эпидуральной анальгезией, что затрудняет дифференциальную диагностику [7].
Наибольшим фактором риска в развитии острого ОХА являются микроорганизмы, присутствующие в цервико-влагалищном тракте, нарушение нормальной микрофлоры влагалища, истмико-цервикальная недостаточность, преждевременное раскрытие шейки матки и разрыв плодных оболочек, а также длительный безводный период [7]. Менее распространенными путями заражения, которые нередко не учитываются, но которые не являются менее важными, являются гематогенный путь распространения, например инфекция периодонта, а также патогенная микрофлора органов малого таза (например, инфекция мочевого пузыря, фаллопиевых труб, прямой кишки) может привести к ОХА, после проникновения микроорганизмов в ткань плаценты.
При гистологически подтвержденном ОХА анаэробные бактерии при микробиологическом исследовании выделяются примерно в 50 % случаев. В меньшем проценте наблюдений ОХА ассоциированы с более высокопатогенными организмами, представляющими угрозу жизни и здоровья плода (например, стрептококки, грамотрицательные бациллы и стафилококки), обладающие повышенной способностью к проникновению в организм плода. При ХО, обусловленных этими микрорганизмами, имеет место повышенный риск к развитию внутриутробной инфекции, а также заболеваниям неинфекционной природы, например образование очагов ишемического повреждения головного мозга, которые бывают вызваны Escherichia coli [13]. Распространенность ХО с подтверждёнными гистологическими признаками снижается в зависимости от гестационного возраста: выявляется до 70 % в плаценте от младенцев, рожденных на сроке до 30 недель гестации и приблизительно в 10 % у доношенных новорожденных [11]. Считается, что 25 % всех преждевременных родов обусловлены ХО [14], из которых ХО, ассоциированные с интактными плодными оболочками (без их разрыва) до 45 %, из них только 14–21 % случаев с гистологически подтверждённым ХО. Случаи с преждевременным разрывом плодных оболочек) (ПРО) [14] составляют 30 % наблюдений, из них только от 26 % до 50 % случаев гистологически подтверждённого ХО. Менее 5 % случаев хориоамнионита протекают наиболее тяжело, имеют угрозу для здоровья матери и плода.
Наряду с этим обнаружены микроорганизмы в ткани плаценты, которые могут не вызывать воспалительную реакцию (асимптоматическое течение ХО, однако нередко приводящие к ПРО и преждевременным родам [15]. В исследовании Hillier (1988) до 65 % наблюдений с гистологически подтверждённым ХО из плацент была выделена Ureaplasma urealyticum. Более того, данный микроорганизм был ассоциирован с другими микробными агентами и определялся более, чем в половине наблюдений [16]. Подтверждением этому служит колонизация U. urealyticum дыхательных путей плода, связанная с увеличением хронических заболеваний легких у недоношенных детей [17].
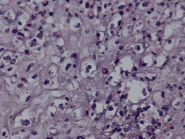
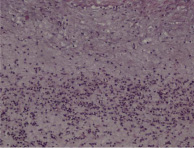
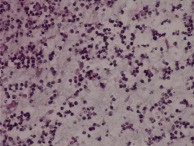
Гистологические критерии острого хориоамнионита. Классификация. Согласно Амстердамской классификации поражений плаценты выделяют материнский и фетальный воспалительный ответ. К материнскому воспалительному ответу относятся поражения плодных оболочек, к фетальному ответу – поражения сосудов пуповины, сосудов стволовых ворсин, васкулиты хориальной пластинки (рис. 1, А–Е).
Рис. 1. Воспалительные изменения хориальной пластинки и плодных оболочек (окраска гем и эоз). А–Б – Инфильтрация хориальной пластинки ПЯЛ, присутствуют лимфоциты, макрофаги и единичные плазмоциты. А – х100, Б – х200. В–Е – Острый хориоамнионит 2–3 стадии, 2 степени В – х100, Г – х200, Д – х100. Е – х400
В материнском воспалительном ответе выделяют стадии, отражающие прогрессию заболевания.
Стадия 1. (острый субхориоамнионит/ранний острый хориоамнионит) = очаговое и диффузное скопление полиморфно-ядерных лейкоцитов (ПЯЛ) в и под хориальной пластинкой и/или в и под амниотической базальной мембраной (отмечаются несколько разбросанных ПЯЛ в менее чем в половине толщины хориальной пластинки и / или в соединительной ткани мембранозной части хориальной пластинки). Воспалительная инфильтрация отмечается лишь под хориальной пластинкой, в последующем нейтрофилы инфильтрируют также как плодный фибриноид под хориальной пластинкой, так и границу децидуальной и хориальной пластинок (острый субхорионит), а затем вовлекаются децидуальные посткапиллярные венулы (острый хорионит). Эта стадия длится обычно менее 12 часов.
Стадия 2. Острый хориоамнионит. Количество нейтрофилов увеличено в хориальной пластинке и / или мембранозной части хориальной пластинке оболочках амниона. Стадия длится в течение 12–24 часов
Стадия 3. Некротический хориоамнионит. Отмечается распад ПЯЛ (кариорексис), утолщение амниотической базальной мембраны, которая становится эозинофильной, присутствует также дистрофия и слущивание амниотического эпителия. После длительной экспозиции инфекции (>48 часов) нейтрофилы подвергаются кариорексису, слущенные амниотические эпителиальные клетки проникают в амниотическую жидкость, что является следствием появления ярко-красной полосы фибриноида на базальной мембране амниона. Это обнаруживается в 50 % случаев и является признаком некротического хориоамнионита.
Спустя несколько дней или недель острые воспалительные инфильтраты стихают и смешанная нейтрофильно-гистиоцитарная инфильтрация сохраняется только в верхних слоях хориона. Этот вариант ХО был назван подострым ХО, который коррелирует с увеличением заболеваемости хроническими заболеваниями легких новорожденных [18]. Важно, что наличие субхориальных микроабсцессов на любой стадии инфекции является проявлением повышенного риска развития тяжелых осложнений, включая сепсис [19].
Степень хориоамнионита (отражает выраженность воспалительных реакций)
Степень 1 (умеренно выраженная): присутствуют единичные или мелкие скопления материнских ПЯЛ, диффузно инфильтрирующих амниотические оболочки, хориальную пластинку и/или расположенный под хориальной пластинкой плодный фибриноид.
Степень 2 (тяжёлая): присутствие трех или более микроабсцессов в хориальной пластинке (не менее 10–20 ПЯЛ), а также между хориальной и децидуальной пластинками в экстраплацентарных оболочках и / или под хориальной пластинкой плацентарного диска. Поражение может иметь вид непрерывной линии из более 10 ПЯЛ, занимающую более половины плодного фибриноида, расположенного под хориальной пластинкой или один оборот в «ролле» плодных оболочек. Хронический (или подострый) ХО диагностируется на основании более выраженной инфильтрации мононуклеарами (обычно макрофагами), в хориальной пластинке (чаще под амнионом). В ряде случаев макрофаги присутствуют как реакция на отложение экзогенных пигментов (например, мекония или гемосидерина).
Фетальный воспалительный ответ
Стадии, отражающие прогрессию заболевания.
Стадия 1 (васкулит хориальных сосудов / флебит пупочной вены): выявление ПЯЛ в стенке сосудов хориальной пластинки или стенке пупочной вены. Проникновение ПЯЛ в вартонов студень допустимо при этой стадии, но пока отсутствуют микроабсцессы и концентрические полосы, окружающие пупочную вену.
Фетальный воспалительный ответ, обусловленной инфильтрацией ПЯЛ на бактериальную инфекцию при беременности, может развиться с 15 недели гестации, но значительно чаще имеет место при доношенных сроках беременности [20]. Фетальный воспалительный ответ начинается с сосудов хориона или пупочной вены, практически всегда сопровождается материнским ответом в виде острого (подострого) хориоамнионита. Острый васкулит фетальных сосудов как изолированное состояние является дискутабельным вопросом.
Стадия 2 (васкулит пупочных сосудов): нейтрофилы присутствуют в стенке одной или обеих пупочных артерий и в пупочной вене. Наличие ПЯЛ в вартоновом студне допустимо при отсутствии микроабсцессов, и концентрических полос, окружающих пупочные сосуды. Фетальные воспалительные реакции в стенке пупочных артерий (пупочный артериит) возникают позже, их развитие коррелирует с повышенным уровнем циркулирующих цитокинов в пупочной крови).
Впоследствии ПЯЛ могут мигрировать в вартонов студень пуповины, где они образуют полоску, выявляемую при гистологическом исследовании, окружающие фетальные сосуды (стадия 3).
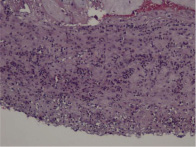
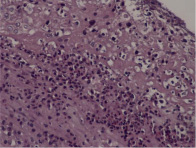
Стадия 3 (некротический фунизит или концентрический периваскулит пупочных сосудов): диагностируют на основании присутствия ПЯЛ, клеточного детрита, эозинофильных преципитатов, и/ или отложений солей кальция, которые визуализируются в виде полоски или ободка, окружающих один или все пупочные сосуды (в большинстве случаев наиболее тяжёлые изменения присутствуют на участках близким к периферии пуповины). Полосу или ободок, который образуют ПЯЛ некоторые авторы называют некротический или субнекротический фунизит и связывают с отложением иммунных комплексов, состоящих из бактериального антигена амниотических оболочек и материнских иммуноглобулинов, диффундирующих из пупочных сосудов [21]. Через несколько недель клетки и эти аркуатные структуры могут исчезнуть, и смениться на эозинофильнуые преципитаты, микрокальцинаты, при этом нередко вовлекаются хориальные сосуды мелкого диаметра (рис. 2, А–Г).
Рис. 2. Воспалительные изменения пуповины и децидуальной пластинки (окраска гем. и эоз.). А–Г – Воспалительные изменения пуповины (воспалительная инфильтрация вартонова студня лимфоцитами, макрофагами и ПЯЛ) А – х40, Б – х100, В – х200, Г – х200. Д–Е – Воспалительные изменения базальной пластинки (очаговая и рассеянная инфильтрация преимущественно ПЯЛ), Д – х100, Е – х200
Степень, отражающая интенсивность воспаления фетального воспалительного ответа
Степень 1 (умеренно выраженная): разбросанные инфильтраты, образованные ПЯЛ, расположены субэндотелиально или стенках хориальных или пупочных сосудов.
Степень 2 (тяжелая): стенки сосудов хориальной пластинки (или сосудов пуповины) с выраженной инфильтрацией ПЯЛ и отёком, наличием повреждения гладкомышечной стенки сосудов на стороне, близкой к амниотической полости. Кроме того, часто отмечаются тромбозы фетальных сосудов (свежие тромбы в сосудах хориальной пластинки или пуповины). Все эти признаки являются отражением картины фетального воспалительного ответа – англ. fetal inflammatory response syndrome (FIRS) – по аналогии с SIRS (англ. Systemic inflammatory response syndrome). Важно отметить, что воспалительный ответ плода не всегда свидетельствует о фетальной инфекции, но является показателем иммунной активации, которая ассоциируется с высокими уровнями цитокинов плода, что приводит к увеличению риска повреждений головного мозга и заболеваний лёгких плода [22–24]. При 2 степени тяжести васкулиты хориальных сосудов ассоциированы с повышенным риском ишемического повреждения головного мозга плода; тромбы в их просвете являются также дополнительном фактором риска [25].
Другие специфические изменения
К другим специфическим изменениям плаценты, ассоциированным с ОХА, относится: периферический фунизит, диагностируемый на основании наличия мелкоточечных абсцессов с участками инфильтрации ПЯЛ на внешней стороне пуповины; острый виллит: присутствие ПЯЛ в строме ворсин и /или под трофобластом; острый интервиллузит / внутриворсинчатый абсцесс – ПЯЛ располагаются в пределах периворсинчатого фибриноида или периворсинчатого пространства, а также в ряде случаев отмечается инфильтрация ПЯЛ децидуальной пластинки (острый децидуит) (рис. 2, Д–Е).
Другие воспалительные изменения, ассоциированные с ОХА, особенно на ранних сроках гестации, включают лимфоплазматический децидуит, и свежие ретроплацентарные гематомы вызывающие диагностическую сложность из-за интенсивной инфильтрации ПЯЛ. В некоторых случаях ОХА могут быть вызваны специфическими микроорганизмами. Так, ОХА с острым интервиллузитом и образованием межворсинчатого абсцесса (так называемые септические инфаркты) чаще всего ассоциируются с Listeria monocytogenes [26, 27]. ОХА с ассоциации с периферическими абсцессами пуповины наиболее часты при инфекции Candida, и часто связаны с преждевременным разрывом плодных оболочек, истмико-цервикальной недостаточностью, а также присутствием внутриматочной спирали или вагинальных колец [28]. ОХА в сочетании с острым виллитом наблюдаются при врождённом бактериальном сепсисе, обычно вызванном стрептококками или грамотрицательными бактериями, в частности E. coli. ОХА в ассоциации с очаговым острым интервиллузитом и периворсинчатым отложением плодного фибриноида могут сочетаться с материнским сепсисом, нередко вызываемого стрептококками и грамотрицательной флорой [29]. Гибель плода редко является следствием непосредственно ОХА, гораздо чаще это происходит при развитии врождённого сепсиса. Преждевременные роды, связанные с ХО, имеют высокий риск рецидива. К возможным причинам этого относят наличие дефектов матки, подострого хронического эндометрита, вызванного стрептококками группы В, бактериального вагиноза, истмико-цервикальной недостаточности.
Изолированный фетальный васкулит может поражать артерии и вены пуповины, хориальной пластинки или крупных стволовых ворсин. Хотя обычно сопровождается острым хориоамнионитом или хроническим виллитом, эти повреждения иногда могут наблюдаться изолированно. Поражения с инфильтрацией ПЯЛ или смешанной воспалительной инфильтрацией (с примесью ПЯЛ) и/или эозинофилами чаще всего обусловлены воздействием мекония, более часто встречаются в стенке пупочной вены [30]. Наблюдения с лимфоцитарной или смешанной лимфоцитарной / эозинофильной инфильтрацией (эозинофильный Т-клеточный хорионический васкулит) имеют место в хориальных или крупных сосудах стволовых ворсин, но данный вопрос является недостаточно изученным [31, 32].
Хронический хориоамнионит (ХХ) встречается в двух различных клинико-патологических вариантах [33]: подострый (хронический) хориоамнионит, является преимущественно затяжной формой инфекционного хориоамнионита и связан чаще с микроорганизмами с низкой патогенностью, такими как микоплазма или вагинальные анааэробы [18]. Один из морфологических вариантов представлен преобладающей воспалительной инфильтрацией гистиоцитами, мононуклеарами с примесью единичных нейтрофилов под амнионом. Этот вариант сочетается с экстремально низкой массой тела детей при рождении и является одной из причин преждевременных родов, часто сочетается с хроническим виллитом. Второй морфологический вариант диагностируется как преобладание лимфоцитарной инфильтрации, по выявленной локализации в хорионе в средней части амниона в виде полос.
Хронический децидуит (ДХ) диагностируется на основании обнаружения инфильтрации мононуклеарами и/или с наличием плазмоцитов [34]. В ряде случаев обнаруживается также большое количество эозинофилов.
Есть предположение, что ДХ может быть результатом эндометритов низкой степени активности и подострых эндометритов, вызванных микоплазмой или другими микроорганизмами с низкой патогенностью, что может быть связано с нарушением микрофлоры влагалища [35]. Это может приводить к преждевременным родам во втором и третьем триместрах. ДХ часто сочетаются с ХО.
Известно, что при отсутствии лечения хронический эндометрит – фактор высокого риска при невынашивании беременности. Кроме того, хронические виллиты сочетаются в 25–30 % случаев с лимфоплазмоцитоидными хроническими децидуитами.
В этих случаях ДХ могут представлять собой неинфекционный воспалительный материнский ответ на аутоантигены или аллоантигены плода [36]. Пациенты с ДХ часто имеют высокий процент аутоиммунных заболеваний различного генеза [37]. Общая перинатальная смертность высока. Антенатальная гибель плода, привычное невынашивание беременности также часто ассоциированы с ДХ. У выживших младенцев нередко отмечается задержка роста и развития. Данное состояние следует также отличать от морфологической картины, при инфицировании Plasmodium falciparum во время беременности.
Децидуальный васкулит/периваскулит диагностируется по наличию выраженности воспалительной инфильтрации вокруг артериол децидуальной пластинки, включая децидуальную пластинку плодных оболочек [3, 38, 39]. Это поражение наиболее часто наблюдается у пациентов с преэклампсией, задержкой развития плода, при невынашивании беременности. Децидуальный васкулит может быть как изолированным, так и сочетаться с острым атерозом и гипертрофией стенок сосудов [39].
Хотя интраамниотическая инфекция обычно считается причиной острого хориоамнионита и фунизита, а также причиной преждевременного разрыва плодных оболочек, однако данные ряда авторов свидетельствуют о том, что «асептическое» внутриамниотическое воспаление (без выявленного микробного агента), может происходить в отсутствии видимых микроорганизмов, и повреждающее действие связано с молекулами повреждения или молекулы «опасности» (DAMP – от англ. Damage-associated molecular pattern или danger-associated molecular patterns), а также интерлейкинами, хемокинами и другими «сигналами опасности». В контексте внутриамниотической инфекции интерлейкины и хемокины (например, интерлейкин-8 и хемотаксические факторы гранулоцитов) создают градиент, который способствует миграции нейтрофилов из системы кровообращения матери или плода в плодные оболочки или пуповину, соответственно. Молекулы повреждения, которые высвобождаются в при повреждении и гибели клеток также в свою очередь могут способствовать высвобождению хемокинов и нейтрофилов [40].
Таким образом, восходящий тип инфекции, обусловленный воспалительным ответом, вызываемый микробными агентами вовлекает 2 типа иммунного ответа: (1) материнский, с инфильтрацией воспалительной инфильтрации (прежде всего ПЯЛ) хориоамниона и хориальной пластинки; и (2) фетальный, определяемый как воспалительная инфильтрация (преимущественно ПЯЛ) вартонова студня, стенок крупных сосудов хориальной пластинки и сосудов пуповины.