Гидролизуется это что значит
Гидролиз
По катиону, по аниону или нет гидролиза?
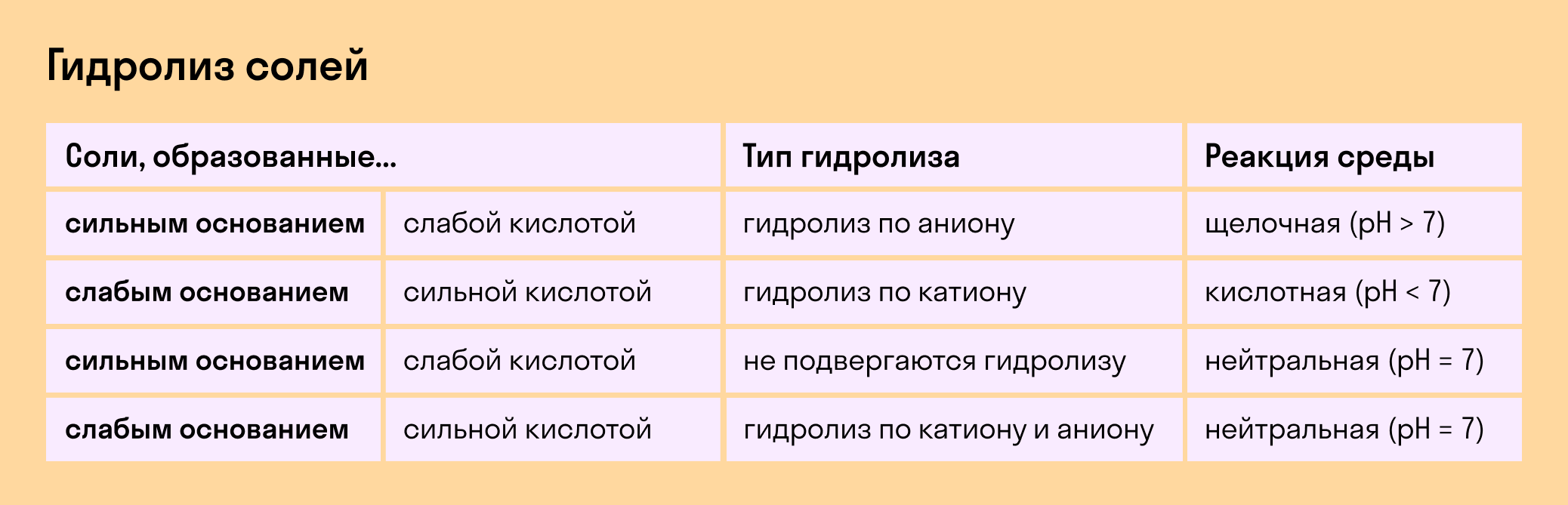
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
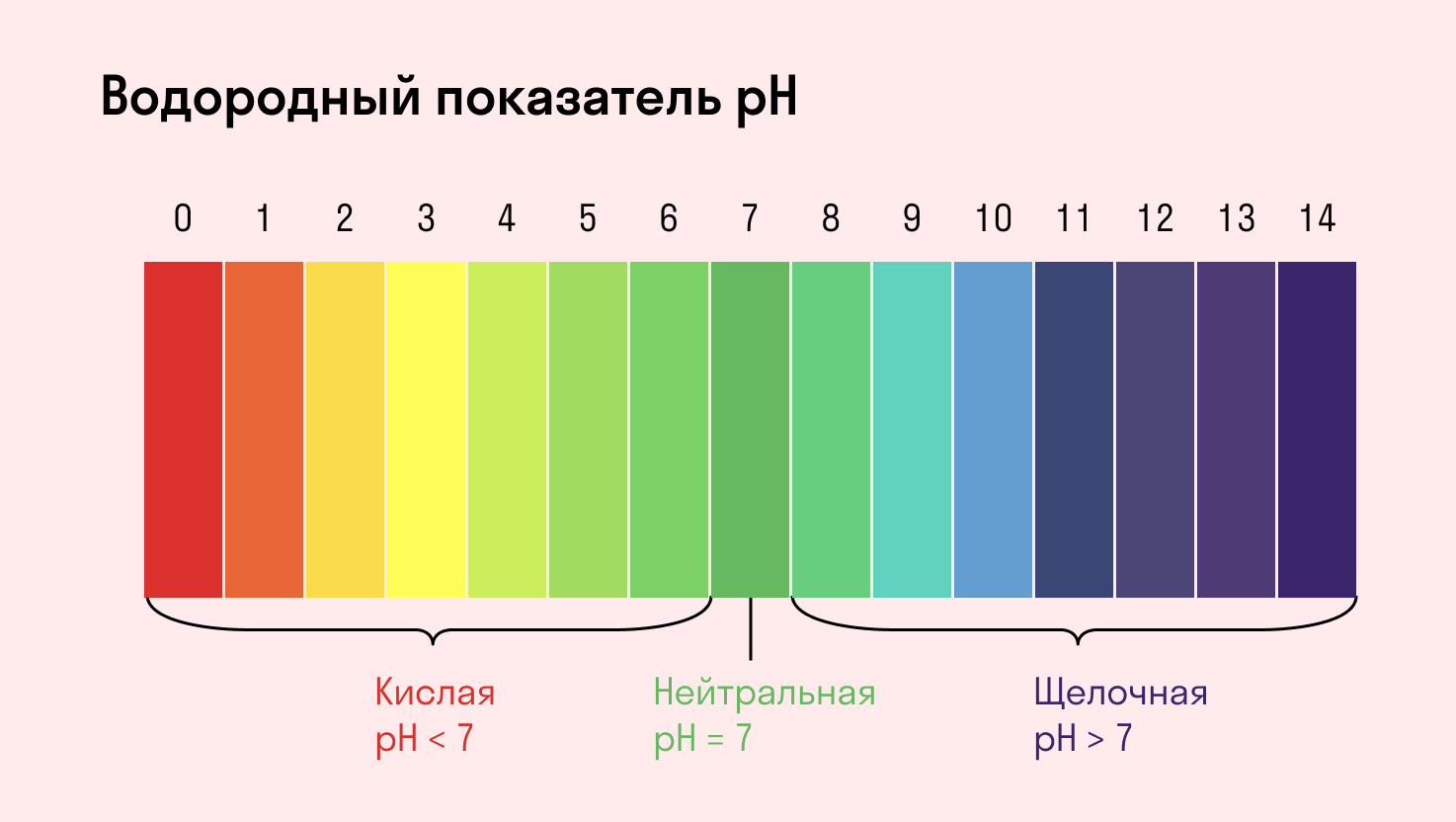
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
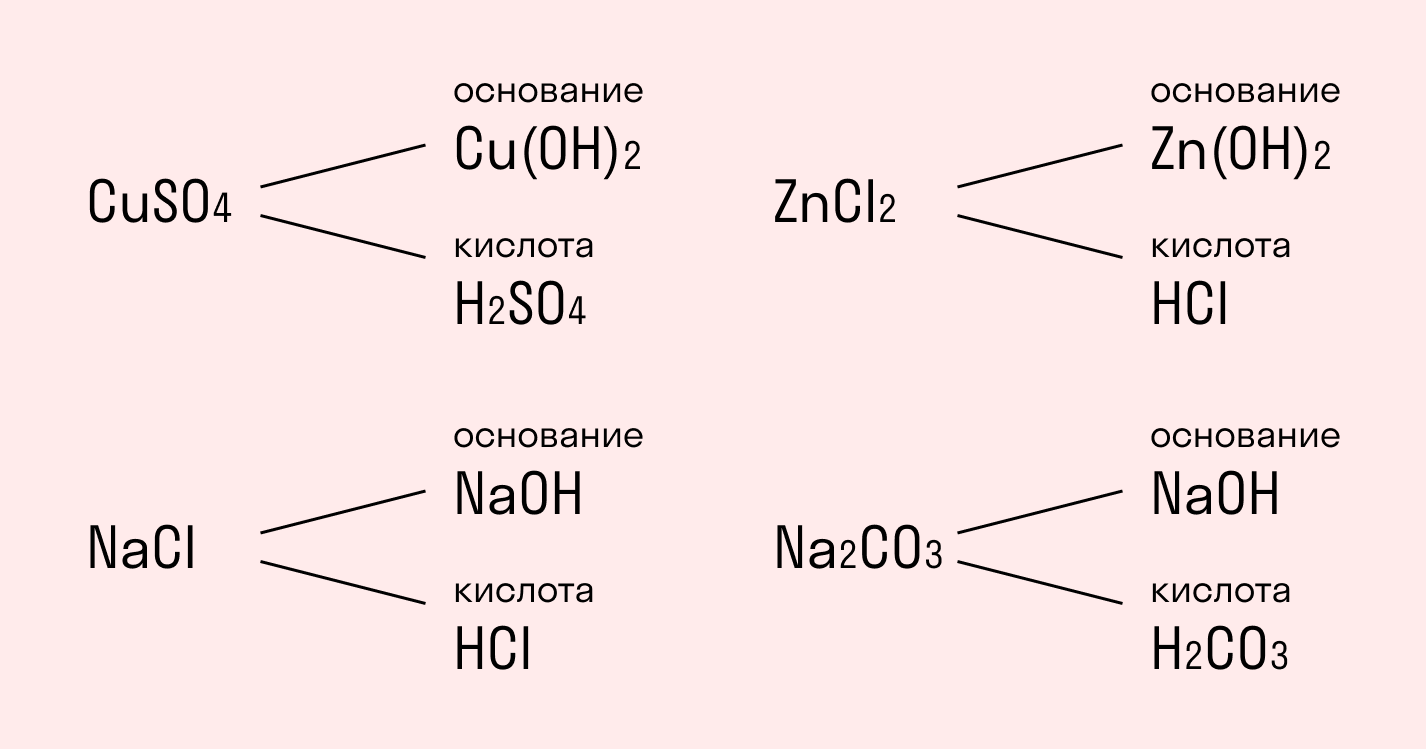
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
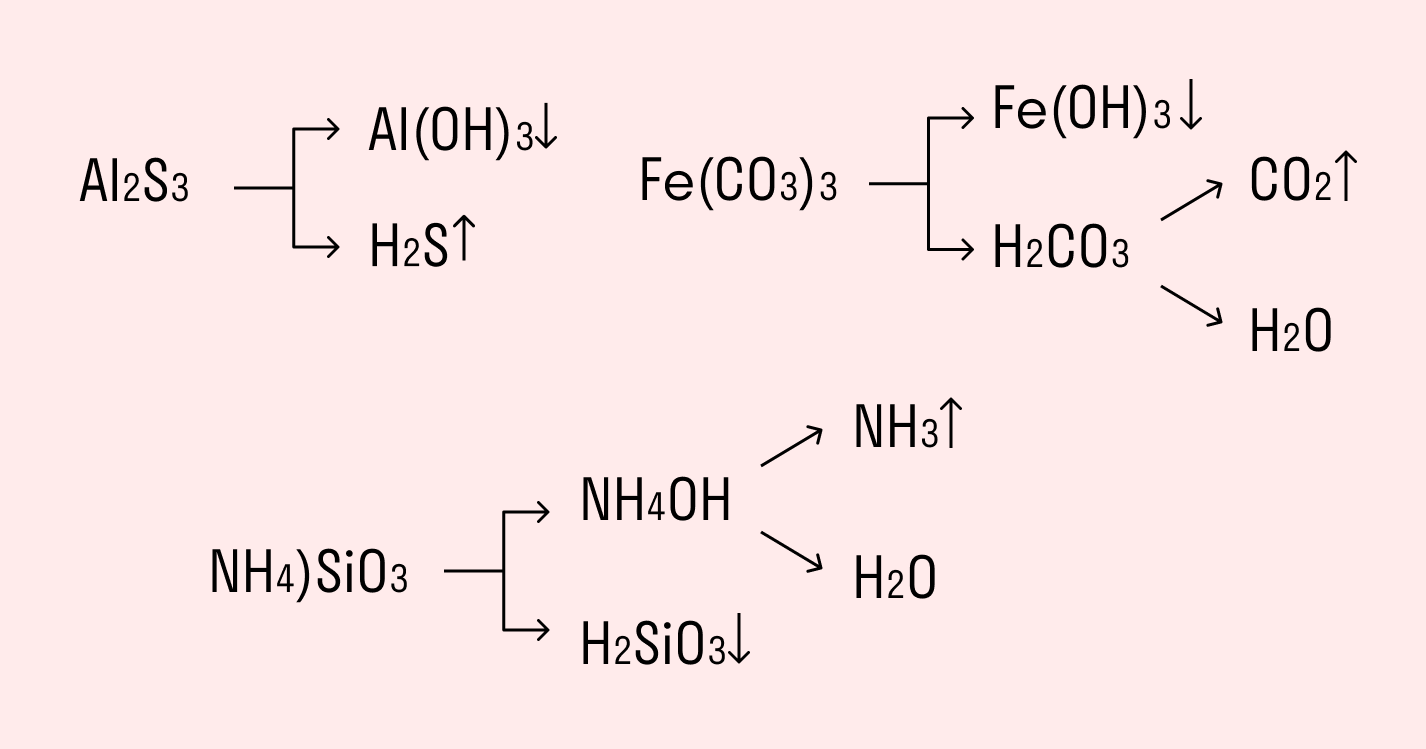
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Смеси на основе частично гидролизованного белка в питании детей первого года с функциональными нарушениями желудочно-кишечного тракта. Взгляд гастроэн

Грудное молоко является идеальным питанием для детей первого года жизни. В случае если грудное вскармливание невозможно, ребенок нуждается в назначении искусственной смеси. Выбор продукта проводится с учетом состояния здоровья младенца. Частые жалобы, с к
Abstract. Breast milk is ideal nutrition for babies in their first year of life. If breastfeeding is not possible, the child needs to be prescribed an infant formula. The choice of product is based on the health status of the infant. Frequent complaints that a gastroenterologist encounters in everyday practice are associated with gastrointestinal disorders. Functional disorders of the gastrointestinal tract are more often recorded. Timely relief/treatment of gastrointestinal symptoms is extremely important, since the potential benefits of this approach are obvious: prevention of the development of a vicious circle, possible complications and chronicity of the process. The basic strategy for the treatment of gastrointestinal disturbances in infants is nutritional modification, and the empirical product of choice in such situations may be formulas based on partially hydrolyzed protein. The ingredient composition of formula of this category is selected in such a way that conditions are created for the regulation of the gastrointestinal tract. The results of evaluating the clinical tolerance of the formula showed efficacy against colic and functional constipation in children of the first year of life: at the end of the observation period, these disorders were not recorded in children who received this product.
Резюме. Грудное молоко является идеальным питанием для детей первого года жизни. В случае если грудное вскармливание невозможно, ребенок нуждается в назначении искусственной смеси. Выбор продукта проводится с учетом состояния здоровья младенца. Частые жалобы, с которыми сталкивается гастроэнтеролог в повседневной практике, связаны с гастроинтестинальными нарушениями. Чаще регистрируются функциональные расстройства желудочно-кишечного тракта. Крайне важным является своевременное купирование/лечение гастроинтестинальных симптомов, поскольку потенциальные выгоды от этого подхода очевидны: профилактика развития порочного круга, возможных осложнений и хронизации процесса. Базовой стратегией терапии желудочно-кишечных нарушений у младенцев является коррекция питания. Эмпирическим продуктом выбора в подобных ситуациях могут быть смеси на основе частично гидролизованного белка. Ингредиентный состав смесей этой категории подбирается таким образом, что создаются условия для регуляции желудочно-кишечного тракта. Результаты оценки клинической переносимости смеси показали эффективность в отношении колики и запоров функционального характера у детей первого года жизни: в конце периода наблюдения указанные нарушения не регистрировались у детей, которые получали этот продукт.
Грудное молоко – уникальный источник питания для ребенка первого года жизни. С позиции доказательной медицины, грудное молоко обеспечивает гармоничное развитие ребенка, содержит спектр биологически активных веществ, которые способны модулировать постнатальную функцию кишечника, иммунной системы и развитие мозга. Всемирная организация здравоохранения (ВОЗ) рекомендует исключительно грудное вскармливание в течение первых шести месяцев жизни [1]. Несмотря на настоятельную рекомендацию грудного вскармливания, встречаются ситуации, когда это невозможно. Доступным вариантом питания ребенка в подобном случае становится детская смесь. Однако произвести продукт, идентичный грудному молоку, не представляется возможным. Тем не менее производители детского питания предпринимают немалые усилия, чтобы имитировать ингредиентный, биологический и функциональный профили грудного молока. При организации искусственного вскармливания здорового младенца рекомендуется использовать стандартные смеси на основе цельного белка коровьего молока. Если у ребенка отмечаются жалобы, которые приводят к нарушению состояния здоровья, выбор смеси будет отличаться. Гастроинтестинальные расстройства считаются самыми распространенными среди детей первого года жизни. Более чем у 50% младенцев регистрируется одно или несколько функциональных нарушений желудочно-кишечного тракта (ЖКТ) в течение первых месяцев жизни [2]. У 2–7% детей первого года жизни диагностируется аллергия к белкам коровьего молока (АБКМ), которая может протекать с вовлечением в процесс ЖКТ. Алгоритм выбора необходимой смеси рекомендуется проводить в соответствии с состоянием, которое привело к появлению гастроинтестинальных жалоб у ребенка.
Типичная ситуация, которая встречается на приеме у гастроэнтеролога.
Родители девочки (Эвелина П., 2,5 мес) обратились за консультацией по поводу жалоб у ребенка: тугой стул по типу «овечьего» в течение последних 2 недель. Стул 1 раз в 1–2 дня, как правило, самостоятельный, однократно применяли Микролакс. Из анамнеза известно, что девочка от первой беременности, протекавшей с токсикозам первой и второй половины; роды срочные, самостоятельные. Закричала сразу, оценка по Апгар 8/9 баллов. Масса тела 3450 г, рост 52 см. Меконий отошел в первые 12 часов жизни. Аллергологический семейный анамнез не отягощен. На первом месяце жизни получала смешанное вскармливание из-за гипогалактии у мамы: грудное молоко и стандартная молочная смесь на основе цельного белка коровьего молока. Стул был ежедневно 1–2 раза в день, оформленный. Прибавка в массе тела на первом месяце жизни +1 кг. Примерно к 1,5 месяцам грудное молоко у мамы исчезло, девочку полностью перевели на искусственное вскармливание ранее используемой стандартной молочной смесью. Через неделю после перевода на искусственное вскармливание появились жалобы на изменения со стороны стула. Других жалоб нет. Кожные покровы чистые. По внутренним органам и системам – без патологии. Массо-ростовые показатели в пределах возрастной нормы.
Какова же дальнейшая тактика гастроэнтеролога в описанном случае?
При определенных условиях жалобы на нарушение работы ЖКТ у ребенка первого года жизни со стороны родителей настолько выражены, что причиняют много хлопот семье и служат причиной обращения к гастроэнтерологу. Происхождение наиболее распространенных и типичных состояний – колика, срыгивания и запор – могут различаться. Чаще всего они носят функциональный характер и связаны с морфофункциональной незрелостью растущего организма, реже их причиной становятся АБКМ, первичные ферментопатии, наследственные нарушения обмена веществ, инфекционные заболевания или патология развития ЖКТ.
Крайне важным является своевременное купирование/лечение гастроинтестинальных симптомов, поскольку потенциальные выгоды от этого подхода очевидны: профилактика развития порочного круга, возможных осложнений и хронизации процесса. Базовой стратегией терапии желудочно-кишечных нарушений у младенцев является коррекция питания. В практике гастроэнтеролога встречаются ситуации, когда удовлетворительный контроль над желудочно-кишечными нарушениями у ребенка, особенно на искусственном вскармливании, достигается не сразу, поскольку не во всех случаях основная причина нарушений ясна. Использование алгоритмов упрощает подбор необходимой смеси, делает его обоснованным и позволяет определить последующие шаги в случае неэффективности на начальных этапах. Выбор эмпирической формулы следует осуществлять с точки зрения ее потенциального эффекта, экономических затрат и выгоды, особенно когда причина гастроинтестинальных нарушений не столь очевидна.
Во время первичного осмотра ребенка важно принимать во внимание следующие моменты:
1) подробный анамнез является ключом к выявлению основной причины желудочно-кишечных нарушений у ребенка;
2) состояние здоровья ребенка, возможные причины существующих жалоб определяют алгоритм действий/назначений врача;
3) состав смеси – модификация белкового и углеводного компонентов, наличие ингредиентов (пребиотики, пробиотики, загустители и т. д.) – влияет на выбор формулы.
К сожалению, распространено мнение, что правильный выбор искусственной смеси – легкая задача. Подобное суждение ошибочно, так как нередко это приводит к нерациональному назначению и частой смене одного продукта на другой. Чтобы сделать оптимальный выбор, следует учитывать особенности ингредиентного состава формулы, технологию производства, качество используемого сырья, а также место продукта в алгоритме питания ребенка.
Доступные смеси, которые способны влиять на ЖКТ ребенка, можно разделить на несколько групп в соответствии с современными представлениями:
1) смеси на основе частично гидролизованного белка с различными ингредиентами в составе (категория Комфорт);
2) смеси на основе глубоко гидролизованного белка и аминокислотные смеси;
3) молочные смеси на основе цельного белка коровьего молока с загустителем (камедь, крахмал);
4) молочные смеси на основе цельного белка без лактозы (безлактозные).
Отметим, что сравнивать эти группы смесей друг с другом не совсем корректно: каждая занимает то или иное место в алгоритме коррекции желудочно-кишечных нарушений у младенцев.
Смеси на основе частично гидролизованного белка
Пожалуй, эта группа смесей – самая обсуждаемая в современной научной литературе. С чем же связана актуальная дискуссия? Какое место в алгоритме питания младенцев, в том числе с гастроинтестинальными жалобами, они занимают?
Чтобы ответить на эти важные вопросы, остановимся на истории создания и технологии производства данных формул. Показательно, что смеси на основе частичного гидролизата белка существуют на рынке более 25 лет и доступны в 90 странах мира. Изначально они были разработаны с целью снижения аллергенности белка за счет его модификации путем термической обработки, использования химического или ферментативного гидролиза, приводящего к снижению молекулярной массы и размера пептидов. Известно, что молекулярная масса пептидов смеси на основе частично гидролизованного белка обычно составляет
* Медицинский центр «Андреевские больницы-Неболит», Москва, Россия
** ФГБОУ ВО НГМУ Минздрава России, Новосибирск, Россия
Смеси на основе частично гидролизованного белка в питании детей первого года с функциональными нарушениями желудочно-кишечного тракта. Взгляд гастроэнтеролога/ Е. А. Гордеева, Т. Н. Елкина, Е. А. Суровикина
Для цитирования: Лечащий врач № 9/2020; Номера страниц в выпуске: 44-49
Теги: кишечник, микробиота, билиарный тракт, питание
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.