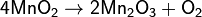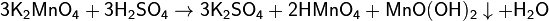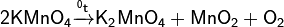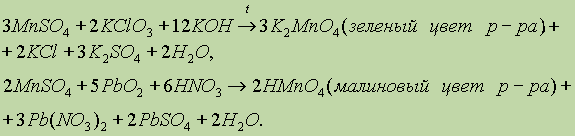Гидроксид марганца это что
Гидроксид марганца II
| Гидроксид марганца II | |
|---|---|
| Систематическое наименование | Гидроксид марганца II |
| Традиционные названия | Гидроокись марганца |
| Хим. формула | Mn(OH)2 |
| Состояние | светло-розовые кристаллы |
| Молярная масса | 88,95 г/моль |
| Плотность | 3,258 г/см³ |
| Растворимость | |
| • в воде | 0,0002 г/100 мл |
| Показатель преломления | 1,681; 1,723 |
| Рег. номер CAS | 18933-05-6 |
| PubChem | 73965 |
| Рег. номер EINECS | 606-171-3 |
| SMILES | |
| ChEBI | 143901 |
| ChemSpider | 66594 и 23354143 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид марганца II — неорганическое соединение, гидроксид металла марганца с формулой Mn(OH)2, светло-розовые кристаллы, не растворимые в воде.
Содержание
Описание
Гидроксид марганца II — студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет слабо основные свойства. Окисляется на воздухе.
Гидроксид марганца II образует светло-розовые кристаллы триклинной сингонии, пространственная группа P 3 m1, параметры ячейки a = 0,334 нм, c = 0,468 нм, Z = 1.
Оксиды и гидроксиды марганца
Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Оксиды и гидроксида марганца
| Оксиды | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | Сильно кислотные |
| Гидроксиды | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | сильно кислотные |
| Названия | гидроксид марганца (II); солиMn(II) | гидроксид марганца (III); солиMn(III) | гидроксид марганца (IV); манганаты(IV) | Марганцевая (VI) кислота; манганаты(VI) | марганцевая (VII)кислота;перманганаты |
Оксиды и гидроксиды марганца
Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)2, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда).
• В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями.
• Окисление оксида марганца(II):
• Восстановление оксида марганца(IV):
Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
Получение оксида марганца 4:
· В лабораторных условиях получают термическим разложением перманганата калия.
· но реакция, в действительности, следует по уравнению:
· Также можно получить реакцией перманганата калия с пероксидом водорода.
· При температуре выше 100 °C перманганат калия восстанавливается водородом:
Химические свойства
1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор)
3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении)
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII):
При нагревании выше 500 о С манганат (VI) распадается на продукты:
манганат (IV) и кислород:
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме:
При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску:
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %.
Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :

4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Применение цветов:
Гидроксид марганца(II)
| Гидроксид марганца(II) | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид марганца(II) |
| Традиционные названия | Гидроокись марганца |
| Химическая формула | Mn(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | светло-розовые кристаллы |
| Молярная масса | 88,95 г/моль |
| Плотность | 3,258 г/см³ |
| Химические свойства | |
| Растворимость в воде | 0,0002 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,681; 1,723 |
Гидроксид марганца(II) — неорганическое соединение, гидроокись металла марганца с формулой Mn(OH)2, светло-розовые кристаллы, не растворимые в воде.
Содержание
Описание
Гидроксид марганца(II) — студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет слабо основные свойства. Окисляется на воздухе.
Гидроксид марганца(II) образует светло-розовые кристаллы триклинной сингонии, пространственная группа P 3 m1, параметры ячейки a = 0,334 нм, c = 0,468 нм, Z = 1.
Химические свойства
Получение
См. также
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Гидроксид марганца(II)» в других словарях:
Гидроксид калия — Гидроксид калия … Википедия
Гидроксид лития — Гидроксид лития … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Гидроксид железа(II) — У этого термина существуют и другие значения, см. Гидроксиды железа. Гидроксид железа(II) … Википедия
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Нитрат марганца(II) — Нитрат марганца(II) … Википедия
Оксид марганца(II) — Общие … Википедия
Оксид марганца(VII) — Mn2O7 зеленовато бурая маслянистая жидкость (tпл=5,9 °C), неустойчив при комнатной температуре; сильный окислитель, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Получить оксид марганца(VII) Mn2O7 можно… … Википедия
Оксид марганца(IV) — Общие … Википедия
Карбонат марганца(II) — Карбонат марганца(II) … Википедия
Соединения марганца
Устойчивые оксиды и гидроксиды марганца:
Свойства соединений марганца, указанных выше, изменяются с ростом степени окисления марганца (сверху-вниз) следующим образом:
Оксид марганца MnO(II)
Гидроксид марганца Mn(OH)2(II)
Оксид (диоксид) марганца MnO2(IV)
Оксид марганца Mn2O7(VII)
Соли марганца (II)
Соли марганца получают растворением марганца в разбавленных кислотах, при этом получается бесцветный раствор, который при взаимодействии с щелочами мутнеет по причине выпадения в осадок гидроксида марганца (II), быстро темнеющего на воздухе с переходом в гидроксид марганца (IV) бурого цвета.
2Mn(OH)2+O2+2H2O = 2Mn(OH)4
Марганцовая кислота
Как уже было сказано выше, марганцовая кислота является сильной кислотой, существующей только в водном растворе. Соли марганцовой кислоты называются перманганатами, самым известным из которых является, конечно же, перманганат калия KMnO4, который в быту называют «марганцовкой».
Во времена СССР ампулу с марганцовкой можно было купить в любой аптеке. Сейчас, перманганат калия «простому смертному» практически не достать, и дело тут не в дефиците, а в специфических свойствах марганцовки, о которых мы не будем распространяться.
Свойства перманганата калия:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Марганец (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Следует отметить, что марганец менее склонен образовывать комплексные соединения по сравнению с его соседями по периоду – хромом и железом.
Соединения двухвалентного марганца
Оксид марганца (II) MnO изредка попадается в природе в виде минерала манганозит. Искусственно его получают восстановлением высших оксидов марганца под действием водорода или угарного газа:
Другой способ получения MnO – прокаливание гидроксида или карбоната двухвалентного марганца в инертной атмосфере:
В последнем методе очень важно избегать присутствия кислорода воздуха или других окислителей, иначе двухвалентный марганец окислится до трех- или четырехвалентного состояния.
Оксид марганца (II) обычно представляет собой порошкообразное вещество, цвет которого варьирует от зеленовато-серого до травянисто-зеленого. В воде и щелочах он не растворяется, по своим химическим свойствам относится к типичным основным оксидам и в соответствии с этим легко взаимодействует с сильными кислотами, образуя соли двухвалентного марганца:
Оксид двухвалентного марганца довольно легко окисляется, например, кислород воздуха уже при небольшом нагревании переводит его в Mn2O3, а при сильном прокаливании – либо в смешанный оксид Mn3O4, либо в диоксид MnO2. Получить металлический марганец из MnO очень трудно, для этого приходится нагревать оксид в атмосфере водорода до очень высоких температур (более 1000оС).
Гидроксид марганца (II) Mn(OH)2 выпадает в виде аморфного осадка, окрашенного в белый или светло-розовый цвет, при добавлении щелочей к растворам солей марганца (II):
Это основной способ получения Mn(OH)2. Кроме аморфной модификации, существует еще кристаллическая форма гидроксида марганца (II), которая встречается в природе в виде очень редкого минерала пирохроит, также имеющего белую или бледно-розовую окраску.
На воздухе гидроксид марганца (II), особенно во влажном состоянии, начинает менять свой цвет на коричневый. Это вызвано тем, что под действием кислорода двухвалентный марганец окисляется до четырехвалентного состояния:
Если к свежеосажденному гидроксиду двухвалентного марганца, содержащему небольшое количество примеси сильного основания, добавить какой-нибудь окислитель (например, пероксид водорода H2O2), то окисление происходит моментально:
Следовательно, гидроксид марганца (II) проявляет сильные восстановительные свойства.
Кроме восстановительных, Mn(OH)2 проявляет все свойства, характерные для слабых оснований: растворяется в сильных кислотах с образованием солей; разлагается при нагревании с отщеплением воды и пр.:
Последнюю реакцию необходимо проводить в отсутствие окислителей, иначе одновременно с разложением гидроксида будет происходить окисление марганца:
Кроме того, гидроксид марганца (II) может медленно взаимодействовать с концентрированными растворами щелочей. Конечными продуктами данной реакции являются комплексные соединения – гидроксоманганаты(II), окрашенные в красный цвет:
Значит, Mn(OH)2 присущи слабые кислотные свойства, но все же его основные свойства выражены гораздо сильнее. Поэтому не будет ошибкой называть его слабым основанием, а не амфотерным соединением.
Соли марганца (II) почти всегда окрашены в бледно-розовый цвет, характерный для гидратированного иона Mn2+ или, что более правильно, для комплексного иона [Mn(H2O)6]2+. В разбавленных растворах эта окраска практически не заметна и поэтому кажется, что такие растворы бесцветны.
Подавляющее большинство солей марганца (II) хорошо растворимо в воде; из плохо растворимых необходимо отметить карбонат MnCO3, сульфид MnS и фосфат Mn3(PO4)2. Фосфат марганца еще интересен тем, что не обладает характерной бледно-розовой окраской – он бесцветен.
Все соли двухвалентного марганца устойчивы только в контакте с сухим воздухом или в виде подкисленных водных растворов. В присутствии влаги кристаллические соли постепенно окисляются кислородом воздуха:
В щелочных водных растворах соли двухвалентного марганца разлагаются с выделением осадка Mn(OH)2, который также окисляется кислородом воздуха:
Аналогичный процесс очень медленно происходит в нейтральных водных растворах: на первых этапах из-за слабого гидролиза по катиону образуются следовые количества гидроксида марганца (II), который затем окисляется кислородом до Mn(OH)4.
Для получения растворимых солей двухвалентного марганца обычно исходят из металла, который растворяют в соответствующей кислоте:
Нерастворимые соли марганца чаще всего получают добавлением к растворимой марганцевой соли раствора, содержащего необходимый кислотный остаток:
Пожалуй, самым главным химическим свойством солей двухвалентного марганца является их сильная восстановительная способность в щелочной среде, когда они окисляются даже такими слабыми окислителями, как кислород воздуха. В кислой среде восстановительные свойства марганца (II) не выражены столь отчетливо, поэтому необходимо использовать очень сильные окислители, например оксид четырехвалентного свинца или пероксодисульфат калия:
Эти реакции очень чувствительны и применяются для определения даже небольших количеств катионов Mn2+, так как образующееся соединение – марганцевая кислота – обладает характерной фиолетово-малиновой окраской.
Хотя у двухвалентного марганца склонность к образованию комплексных соединений выражена значительно слабее, чем у своих соседей по периоду – железа (II) и хрома (II), он способен на образование комплексов как с молекулами воды, так и с некоторыми анионами, например с цианидами или роданидами:
Соединения четырехвалентного марганца
Оксид марганца (IV) MnO2 встречается в природе в виде минерала пиролюзит (важнейшая марганцевая руда). В лабораториях его получают прокаливанием на воздухе нитрата двухвалентного марганца или окислением соединений марганца (II) в щелочной среде:
Как природный, так и полученный искусственно оксид четырехвалентного марганца окрашен в цвета, варьирующие от серого до черного. Из всех соединений марганца (IV) он самый устойчивый, но все равно разлагается при нагревании: при температурах выше 530оС начинается отщепление кислорода и образование оксида трехвалентного марганца:
По кислотно-основным свойствам MnO2 относится к амфотерным соединениям, но соответствующие свойства выражены у него очень слабо. Гораздо сильнее проявляется его окислительно-восстановительная двойственность (способность выступать как в роли окислителя, так и восстановителя). Например, с разбавленными кислотами оксид марганца (IV) не взаимодействует; с холодными концентрированными кислотами образует очень неустойчивые соли четырехвалентного марганца, проявляя основный характер; но уже при небольшом нагревании начинает выступать как окислитель, что приводит к получению солей двухвалентного марганца: