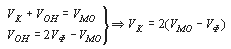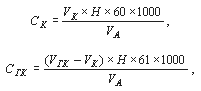Гидрокарбонаты в воде что это такое
Гидрокарбонаты в питьевой воде
Гидрокарбонаты в питьевой воде – это компоненты, определяющие ее щелочность. Их содержание в воде объясняется несколькими процессами:
Гидрокарбонаты в питьевой воде уменьшают количество водородных ионов, приводят к уменьшению кислотности и повышению щелочности. Благодаря высокой концентрации гидрокарбонатов некоторые минеральные воды могут использоваться для лечения гастритов и повышенной кислотности желудочного сока. В умеренных концентрациях гидрокарбонат-ионы необходимы качественной питьевой воде для поддержания нормальной щелочности, оптимального значения рН и приемлемых органолептических характеристик.
Зачем насыщать воду гидрокарбонатами
Гидрокарбонаты в воде нужны для того, чтобы корректировать водородный показатель pH воды и улучшить ее вкусовые свойства. Если щелочность низкая, уровень pH будет нестабилен вследствие низкой буферной емкости такой воды. Низкая (практически нулевая) щелочность и пониженные уровни рН характерны, в частности, для воды после очистки обратным осмосом.
Гидрокарбонаты в воде (природной) – это прежде всего соли кальция и магния (гидрокарбонаты этих элементов существуют только в растворенном состоянии). При нагреве и кипячении растворенные гидрокарбонаты элементов жесткости частично перейдут в нерастворимые карбонаты, и вода станет мягче.
При необходимости (например, после обратного осмоса) гидрокарбонаты в воде можно повысить, используя специально разработанные для этого модификации минеральной добавки «Северянка Бикарбонат». Помимо повышения щелочности питьевой воды и коррекции рН, эта добавка улучшает её вкусовые качества.
Гидрокарбонаты (мг/л) в питьевой бутилированной воде
Применение карбонатов
Нормальные соли угольной кислоты и щелочноземельных металлов в виде природного сырья используются в строительном деле для производства цементов, вяжущих смесей. Известные ископаемые: известняк, магнезит, витерит применяются для получения огнеупорных материалов. Под действием воды и атмосферного углекислого газа средние соли угольной кислоты легко преобразуются в гидрокарбонаты. После нагревания карбонаты превращаются в оксиды, которые обладают высокой термоустойчивостью.
Соли угольной кислоты используются на химических производствах, в коммунальных хозяйствах для нейтрализации промышленных стоков, загрязненных кислотами.
Кислые и средние карбонаты щелочных металлов известны под названием сода. При хлебопечении, в кондитерском производстве, разлагаясь с выделением диоксида углерода, они разрыхляют тесто, улучшают качество изделий.
Содержание в воде. Методы контроля
Концентрация минеральных солей в питьевой воде оказывает существенное влияние на метаболизм в организме человека. Соли угольной кислоты определяют показатели щелочности. Сдвиг значения рН в сторону увеличения изменяет скорость и направление обменных процессов. Оптимальная концентрация гидрокарбонатов, которые долгое время называли бикарбонатами, для благополучного функционирования физиологических процессов составляет минимум 30 мг/л, максимум – 400 мг/л. Вода со значениями концентраций в указанном диапазоне считается полноценной.
В бутилированной воде допускается содержание гидрокарбонатов в верхнем пределе диапазона, 400 мг/л. Расфасованная вода высшей категории подвергается более глубокой очистке, характеризуется содержанием гидрокарбонатов, полностью соответствующим нормам полноценности, от 30 мг/л до 400 мг/л. Регламентируемые показатели зафиксированы в СанПиН 2.1.4.1116-02.
Контроль концентраций солей угольной кислоты осуществляют по методикам ГОСТ 31957—2012, соответствующим международным подходам к определению щелочности. В основе определения лежит титриметрический метод, осуществляемый в два этапа. На первой стадии фиксируется точка оттитровывания карбонат-ионов при рН, равном 8,3. На втором этапе определяют общую щелочность при значении рН=4,5. Титрование можно контролировать по изменению цвета индикаторов или потенциометрически. Для фиксирования скачка значения рН на первой стадии используют фенолфталеин, на второй – метиловый оранжевый.
Расчет полученных показателей по формулам, приведенным в стандарте, позволяет получить полную информацию о содержании гидрокарбонатов в воде.
Влияние на здоровье человека
Для всех живых систем, в том числе организма человека, характерно постоянство среды. Это состояние называется гомеостазом, поддерживается естественными веществами буферного действия.
Изменение щелочности физиологических растворов: желудочного сока, лимфатической жидкости, крови и др, вызывает дисбаланс во всех метаболических процессах. В результате нарушается работа ферментов, ухудшается проницаемость мембран, наблюдаются комплексные изменения.
Возможные проявления могут наблюдаться в нарушениях работы пищевого тракта, сосудистой системы, слизистых оболочек и кожных покровов.
Источники загрязнения воды
Гидрокарбонаты – это естественные природные компоненты воды, попадающие туда из минералов, почвы. Избыточное содержание карбонатов может обнаруживаться в специфических геологических регионах, для которых характерна повышенная жесткость воды. Часто эти районы тесно прилегают к месторождениям известняка.
Техногенное повышение концентрации гидрокарбонатов может наблюдаться в местах расположения комплексов, производящих цемент, другие строительные материалы.
Защитить себя от всех рисков можно воспользовавшись службой доставки бутилированной воды. #ЗнайЧтоПьешь и будь здоров!
Полезные качества и показания к применению гидрокарбонатной минеральной воды
Каждый хоть раз сталкивался с симптомами гастрита или другими проблемами пищеварения. Для облегчения этих состояний приходится пить дорогостоящие препараты.
Но ведь легче предотвратить появление недуга. Гидрокарбонатная минеральная вода – альтернатива для профилактики и лечения отклонений в работе ЖКТ.
Что это за минералка?

Такие воды являются родниковыми, они обогащаются минеральными соединениями благодаря омовению и частичному растворению ископаемых, находящихся под землей.
Классификация
Прежде, чем отправиться в магазин, надо ознакомиться с разнообразием щелочных вод и разобраться в их отличиях.
Гидрокарбонатные воды делят по следующим признакам:
| Вид | Вместимость солей, г/л |
| Столовая | До 3 |
| Лечебно-столовая | 3-10 |
| Лечебная | Более 10 |
Среди всех вод 2 вида, выпускаемых в бутылках, гидрокарбонатные составляют приблизительно 30%. Они содержат много кислых солей угольной кислоты, до 15% хлоридов в виде поваренной соли.
По показателю вместимости солей и назначению применения двууглекислые воды делят на:
Польза от применения
Щелочная минералка:
Воду с бикарбонатами рекомендуют употреблять при нарушениях функций ЖКТ и мочевыделительной системы. Терапия помогает устранить такие неприятные симптомы, как изжога, отрыжка.
Как сделать выбор?
Минеральная вода предназначена для устранения различных отклонений, а не для утоления жажды. Применять ее следует по рекомендациям врача. Особенно дело касается лечебной воды.
В идеале пить минералку непосредственно из источника. Но для тех, у кого нет возможности отправиться на курорт, повсеместно продают минералку в бутылках.
Также существуют природные воды, изначально содержащие углекислоту. Их не подвергают искусственному газированию.

Желательно брать воду в стеклянной таре, так как пластик, при нарушении условий температурного режима хранения, выделяет вредные вещества, которые попадают в напиток.
Цена не является показателем высокого качества. Чаще всего, это признак отдаленности источника. Воды, разлитые в Европейских странах, стоят на порядок выше, чем добываемые в России и ближайшем зарубежье, ведь на их транспортировку затрачивают немалые средства.
Названия популярных марок
Некоторые бренды минералки заслужили доверие покупателей и высокую репутацию благодаря качеству и оздоровительным свойствам воды. Их названия используют как символ здоровья и долголетия.
Слабощелочные
Список лучших столовых вод:
Щелочные
Столово-лечебные воды пользуются наибольшей популярностью, имеют более насыщенный состав. Они помогают вылечить различные недуги, но при этом у них относительно мягкий вкус.
Самые знаменитые марки:
Сильнощелочные
Сильнощелочные воды обладают выраженным лечебным эффектом, применяются только по назначению врача. Для них характерен яркий специфический вкус. Пить такую воду следует в строго ограниченном количестве.
Наиболее распространенными являются:
От каких болезней помогает избавиться?
Если заболевание достаточно серьезное, одной водой вылечиться не удастся. Но при комплексной терапии, минералка дает положительные результаты и ускоряет выздоровление.
Ощелачивающие воды принимают при следующих болезнях:
Длительность, время приема и суточную норму указывает врач после осмотра, опроса пациента, тщательных исследований и постановки диагноза.
Противопоказания

Детям до трех лет также следует отказаться от этого лечебного напитка. Так как у малышей еще не сформированы ферменты, способные расщепить сложные элементы для полноценного усвоения.
Правила употребления для укрепления здоровья
Максимальную пользу несет свежая вода из источника, бутилированная – менее эффективна, но зато доступна в любом городе.
Важно принимать воду правильно. Для лучшего всасывания полезных компонентов следует пить ее неспеша в предписанном объеме.
Основные моменты при лечении минералкой:
| Диагноз | Когда пить |
| Профилактика | За 30 минут до еды |
| Язва желудка | После еды |
| Гастрит с пониженной кислотностью | Во время еды |
| Гастрит с повышенной кислотностью | Через час после еды |
При ухудшении состояния стоит перестать пить щелочную воду и записаться на прием к врачу.
Заключение
Устранение неприятных симптомов проще и приятней проводить натуральными средствами, чем медикаментами. Минеральные вещества необходимы для нормального функционирования ЖКТ. Но надо помнить, что минералка – это не просто жидкость, и что пить ее надо с учетом вышеприведенной информации.
Щёлочность, гидрокарбонат-ион
Щёлочность
Описание: многоуровневый интегральный параметр, отражающий концентрацию анионов слабых органических и неорганических кислот в воде, в основном — угольной. Характеризует направленность гидро- и геохимических процессов, коррозионной агрессивности воды по отношению к бетону, стали, отопительным котлам, парогенераторам.
Методы определения: титриметрия с использованием индикаторов, потенциометрическое определение.
Типы щёлочности
| Тип | Обусловленность |
|---|---|
| Свободная щелочность | Наличие в воде карбонат-ионов CO 2− 3 и гидроксильных ионов OH − в водах с pH > 8,3 |
| Карбонатная щелочность | Наличие в воде продуктов диссоциации угольной кислоты — карбонатов CO 2− 3 и гидрокарбонатов HCO − 3, находящихся в равновесии |
| Общая щелочность | Наличие в воде анионов слабых неорганических и органических кислот, титруемых сильной кислотой |
Методики, используемые в Испытательном центре МГУ определения концентрации гидрокарбонатов в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ГОСТ 31957-2012 | титриметрия | вспомогательное оборудование |
| РД 52.24.493-2006 | титриметрия | вспомогательное оборудование |
| Почва | ||
| ГОСТ 26424-85 | титриметрия | весы |
Распространённость: гидрокарбонаты HCO − 3, карбонаты CO 2− 3, гидроксид-ион OH − и ионы слабых органических и неорганических кислот появляются в природной воде естественным образом в процессе растворения в воде углекислого газа, минералов и вмещающих пород при контакте воды с почвой. Поэтому практически все типы вод характеризуются щёлочностью отличной от нуля. Щёлочность тесно связана с показателем pH, поэтому разные щёлочности могут не присутствовать в воде одновременно.
Нормирование
С нормированием щёлочностей дела обстоят сложно. Сама по себе эта группа параметров в воде не нормируется. Однако нормируются гидрокарбонаты (только в бутилированной воде), частично обуславливающие значение щёлочностей. Содержание карбонатов напрямую не нормируются, но, если учесть, что в питьевой воде строго нормируется pH, свободная щёлочность в питьевой воде должна быть равна нулю.
Предельно допустимая концентрация (ПДК) гидрокарбонатов в различных типах вод
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–400 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 30–400 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | — |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | — |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 | — |
| Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 | — |
Польза и вред
Несмотря на то, что щёлочность не нормируется в большей части типов вод (кроме бутилированной), у щёлочности есть физиологическое воздействие: при употреблении воды с повышенной щёлочностью неизбежны негативные последствия для организма. Наиболее опасна свободная щёлочность. Общую и карбонатную щёлочности (при отсутствии свободной) лучше контролировать по содержанию гидрокарбонатов. Их содержание не должно превышать 400 мг/л.
При повышенной щёлочности наблюдается:
Методы очистки воды
Появление в питьевой воде свободной щёлочности говорит о наличии загрязнения источника.
При загрязнении источника такими загрязнителями очистка воды, как правило, не целесообразна — необходимо проводить очистку самого источника. В случае, если без очистки воды не обойтись, предпочтительнее использовать обратный осмос.
Щёлочность — важный интегральный параметр состояния воды. Повышенное содержание свободной щёлочности говорит о загрязнении источника. Общая и карбонатная щёлочности позволяют судить о происходящих в воде процессах и о балансе карбонатов и гидрокарбонатов, а также о связи этого баланса с показателем pH. Также параметры используются для оценки пригодности воды для использования в технологических процессах и устройствах, например парогенераторах, отопительных котлах, бойлерах и т.д.
Гидрокарбонаты в воде что это такое
Как отмечалось выше (в разделе «Щелочность и кислотность»), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0–8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН 4,1–4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислоты (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации – 0,05 моль/л либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0–8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции:
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
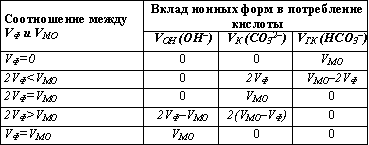
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (VМО) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты VМО содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (VФ) и метилоранжу (VМО). Рассмотрим несколько возможных вариантов, сопоставляя величины VФ и VМО.
VФ = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
VФ
VФ = VМО. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (СК) и гидрокарбонатами (СГК) в мг/л по формулам:
где:
VК и VГК – объем раствора соляной кислоты, израсходованный на титрование карбоната и гидрокарбоната соответственно, мл;
Н – точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.;
VА – объем пробы воды, взятой для анализа, мл;
60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях;
1000 – коэффициент пересчета единиц измерений.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в ммоль/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
Выполнение анализа
А. Титрование карбонат-аниона