Герпесный энцефалит что это
Герпесный энцефалит что это
Эти энцефалиты представляют особенно большой интерес для психиатров как в связи с большой распространенностью герпеса, так и в связи с высокой частотой психических нарушений. В существующей литературе имеется множество работ, в которых отмечается, что герпетические вирусные энцефалиты могут манифестировать психопатологическими синдромами, которые предшествуют появлению неврологической симптоматики, затрудняя правильную диагностику основного заболевания [Деконенко Е. П., Лебедев А. В., 1997].
Рассматриваемые энцефалиты вызываются вирусом простого герпеса ( herpes simplex ), типа 1 и 2, первый из которых чаще ведет к поражению головного мозга.
Психопатологическая симптоматика при герпетических вирусных поражениях мозга во многом определяется локализацией патологического процесса. В свое время А. С. Шмарьян (1940) отмечал в случаях геморрагических энцефалитов достаточно тонкие нарушения ткани височной доли мозга. В настоящее время в некоторых работах упоминается также нарушение дофаминергических структур и нейрогормональных центров.
В целях диагностики поражения ЦНС вирусом герпеса применяются иммунологические (серологические), морфологические и вирусологические методы исследования, а также анализ тканей для выявления вирусной ДНК.
Нейроморфологически при герпетическом энцефалите отмечаются признаки гиперемии и отека мозга, точечные геморрагии, очаги некроза (преимущественно в сером веществе височно-лобно-теменных областей); признаки дистрофии и набухания нейронов, периваскулярная клеточная инфильтрация. В типичных случаях обнаруживаются и характерные ацидофильные внутриядерные включения. На поздних стадиях могут обнаруживаться кисты после размягчения геморрагических очагов. Для проведения вирусологической идентификации герпетического поражения ЦНС применяются метод флюоресцирующих антител и исследование мозговых клеток в культуре ткани.
При КТ-исследовании выявляются зоны пониженной плотности значительной протяженности, не имеющие четких границ и чаще всего расположенные в коре головного мозга, височных, лобных и теменных долях. В некоторых случаях имеют место диффузное поражение мозга и признаки отека.
В типичных случаях клиническая картина герпетических энцефалитов в дебюте болезни характеризуется лихорадкой, умеренной интоксикацией и катаральными явлениями верхних дыхательных путей. Через несколько дней, как правило, наблюдается новый подъем температуры тела с нарастанием признаков интоксикации и развитием общемозговой симптоматики (головная боль, менингеальные явления, иногда повторные судорожные приступы и т. п.). На этом фоне возникают расстройства сознания разной глубины — от трудностей осмысления окружающего и неполной ориентировки до более выраженных состояний оглушения, сопора и комы. При повторных эпилептических припадках больные длительно остаются в состоянии постприпадочного оглушения, которое может переходить в сопор и кому. В этом периоде отмечается развитие и делириозных расстройств, проявляющихся эпизодами психомоторного возбуждения с элементарными зрительными галлюцинациями, аффектом страха. Усиление двигательного возбуждения и гиперкинезов при редукции галлюцинаторных расстройств характерно для варианта субкоматозного делирия.
Коматозное состояние чаще развивается на высоте болезни, нарастает тяжесть неврологических расстройств, в том числе очаговых — гемипарезы, пирамидные знаки, гиперкинезы, изменения мышечного тонуса по экстрапирамидному типу, децеребрационная ригидность и др. В этом случае обычно проводят реанимационные мероприятия, в том числе ИВЛ, трахеостомию. У выживших после пролонгированной комы пациентов в последующем могут развиваться, так же как и при черепно-мозговой травме, апаллический синдром и синдром акинетического мутизма.
Следующий за этим этап восстановления психических функций занимает от 2 до 24 мес и более. Постепенно уменьшается тяжесть психоорганических расстройств. При этом может обнаруживаться синдром Клювера—Бьюсси, характеризующийся грубыми гностическими расстройствами (невозможностью оптически или тактильно опознать предметы), склонностью брать все предметы (даже опасные) в рот, гиперметаморфозом (отвлечением внимания любым раздражителем), гиперсексуальностью, исчезновением чувства страха и стыда, деменцией. Впервые этот синдром был описан американскими исследователями H. Kliiver и Р. Вису после операций по удалению обеих височных долей (с лимбической системой).
Отдаленный этап перенесенного герпетического энцефалита характеризуется резидуальными симптомами энцефалопатии в форме астеноорганического, судорожного и психопатоподобного синдромов. Реже наблюдаются аффективные расстройства непсихотического уровня. Описаны случаи галлюцинаторно-параноидных и биполярных аффективных психозов, а также более сложные психопатологические синдромы шизофреноподобного типа (с кататоническими включениями). Лишь в 30 % случаев возможно достижение полного восстановления психического здоровья.
Герпетические энцефалиты, сопровождающиеся преимущественно психическими расстройствами, были подробно проанализированы в клиническом и дифференциально-диагностическом аспекте на основе данных литературы Е. П. Деконенко и А. В. Лебедевым (1997). На ранней стадии герпетических энцефалитов психопатологическая симптоматика может быть сходной с проявлениями шизофрении. В таких случаях после продромального периода на фоне субфебрильной температуры появляются расстройства мышления (разорванность, бессвязность) и кататонические симптомы. Неврологические нарушения при этом мало выражены или даже отсутствуют. Трудности дифференциальной диагностики усугубляются тем обстоятельством, что заболеванию нередко предшествует эмоциональный стресс [Himmelhoch J. et al., 1970; Wilson L. G., 1976]. На фоне назначения нейролептиков у таких больных могут развиться мутизм и кататонический ступор, а в дальнейшем аменция, приводящая к летальному исходу. У детей младшего возраста недиагностированная герпетическая инфекция может проявляться в виде «фебрильных припадков». Шизофреноподобная симптоматика при герпетических энцефалитах иногда имеет сходство с картиной фебрильной шизофрении, что редко учитывается при дифференциально-диагностическом подходе к последней. Кроме того, хроническая герпетическая инфекция утяжеляет течение шизофрении.
При отграничении психических нарушений при герпетических энцефалитах от эндогенных психозов важно обращать внимание на нарушения сознания (в том числе на ранний признак — нарушение ориентировки), возникновение судорожных припадков и других неврологических симптомов, свидетельствующих не только о наличии, но и о топике органических поражений мозга. Большое значение имеют и лабораторные исследования, позволяющие установить высокие титры антител к герпетическому вирусу.
При установлении вирусной природы заболевания необходимо как можно более раннее начало противогерпетического лечения — назначение видарабина, ацикловира (зовиракс), кортикостероидных препаратов (для предотвращения отека мозга), а также симптоматических психотропных средств (с большой осторожностью!).
Прогноз заболевания в случаях герпетических энцефалитов в большой мере определяется лечением. В зарубежной литературе есть данные, что при отсутствии адекватной терапии смертность больных может достигать 50— 100 %. После же активного лечения прогноз может быть благоприятным — почти полностью исчезают признаки психоорганического синдрома или имеются незначительно выраженные его проявления. Психические расстройства могут ограничиваться неглубокой депрессией и аутизмом. Есть случаи и полного практического выздоровления.
Герпетическая инфекция (HERPES SIMPLEX)
Этиология.
Возбудитель относится к семейству герпеса (Herpes viri-dae).E это семейство входят также вирусы ветряной оспы, опоясывающего лишая, цитомегаловирусы и возбудитель инфекционного мононуклеоза. Содержит ДНК, размеры вириона 100-160 нм. Вирусный геном упакован в капсид правильной формы, состоящий из 162 капсомеров. Вирус покрыт липидсодержащей оболочкой. Размножается внутриклеточно, образуя внутриядерные включения. Проникновение вируса в некоторые клетки (например, в нейроны) не сопровождается репликацией вируса и гибелью клетки. Наоборот, клетка оказывает угнетающее влияние и вирус переходит в состояние латенции. Через некоторое время может происходить реактивация, что обусловливает переход латентных форм инфекции в манифестные. По антигенной структуре вирусы простого герпеса подразделяются на два типа. Геномы вирусов 1 и 2-го типа на 50% гомологичны. Вирус 1-го типа обусловливает преимущественно поражение респираторных органов. С вирусом простого герпеса 2-го типа связано возникновение генитального герпеса и генерализованная инфекция новорожденных.
Эпидемиология.
Патогенез.
Воротами инфекции является кожа или слизистые оболочки. После инфицирования репликация вируса начинается в клетках эпидермиса и собственно кожи. Независимо от наличия местных клинических проявлений заболевания, репликация вируса происходит в объеме, достаточном для внедрения вируса в чувствительные или вегетативные нервные окончания. Считается, что вирус или его нуклеокапсид распространяется по аксону к телу нервной клетки в ганглии. Время, необходимое для распространения инфекции от ворот до нервных узлов, у человека неизвестно. Во время первой фазы инфекционного процесса размножение вирусов происходит в ганглии и окружающих его тканях. Затем по эфферентным путям, представленным периферическими чувствительными нервными окончаниями, активный вирус мигрирует, приводя к диссеминированной кожной инфекции. Распространение вирусов к коже по периферическим чувствительным нервам объясняет факт обширного вовлечения новых поверхностей и высокую частоту новых высыпаний, находящихся на значительном удалении от участков первичной локализации везикул. Это явление характерно как для лиц с первичным генитальным герпесом, так и для больных оральнолабиальным герпесом. У подобных больных вирус можно выделить из нервной ткани, находящейся далеко от нейронов, иннервируюших место внедрения вируса. Внедрение вируса в окружающие ткани обусловливает распространение вируса по слизистым оболочкам.
После завершения первичного заболевания из нервного ганглия не удается выделить ни активный вирус, ни поверхностные вирусные белки. Механизм латентной вирусной инфекции, а также механизмы, лежащие в основе реактивации вируса простого герпеса, неизвестны. Факторами реактивации являются ультрафиолетовое облучение, травма кожи или ганглия, а также иммуносупрессия. При исследовании штаммов вируса герпеса, выделенных у больного из различных мест поражения, установлена их идентичность, однако у больных с иммунодефицитами выделенные из разных мест штаммы существенно различались, что свидетельствует о роли дополнительной инфекции (суперинфекции). В формировании иммунитета против вируса герпеса играют роль факторы как клеточного, так и гуморального иммунитета. Улиц с ослабленным иммунитетом латентная инфекция переходит в манифестную, а манифестные формы протекают значительно тяжелее, чем у лиц с нормальной деятельностью иммунной системы.
Симптомы и течение.
Инкубационный период продолжается от 2 до 12 дней (чаще 4 дня). Первичная инфекция чаше протекает субклинически (первично-латентная форма). У 10-20% больных отмечают различные клинические проявления. Можно выделить следующие клинические формы герпетической инфекции:
— герпетические поражения кожи (локализованные и распространенные);
— герпетические поражения слизистых оболочек полости рта;
— острые респираторные заболевания;
— герпетические поражения глаз (поверхностные и глубокие);
— энцефалиты и менингоэнцефалиты;
— висцеральные формы герпетической инфекции (гепатит, пневмония, эзофагит и др.);
— герпес у ВИЧ-инфицированных.
Герпетические поражения кожи. Локализованная герпетическая инфекция обычно сопровождает какое-либо другое заболевание (острое респираторное заболевание, пневмония, малярия, менингококковая инфекция и др.). Герпетическая инфекция развивается в разгар основного заболевания или уже в периоде выздоровления. Частота герпеса при острых респираторных заболеваниях колеблется от 1,4% (при парагриппе) до 13% (при микоплазмозе). Общие симптомы отсутствуют или маскируются проявлениями основного заболевания. Герпетическая сыпь локализуется обычно вокруг рта, на губах, на крыльях носа (herpes labialis, herpes nasalis). На месте высыпания больные ощущают жар, жжение, напряжение или зуд кожи. На умеренно инфильтрированной коже появляется группа мелких пузырьков, заполненных прозрачным содержимым. Пузырьки расположены тесно и иногда сливаются в сплошной многокамерный элемент. Содержимое пузырьков вначале прозрачное, затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах герпес поражает, как правило, одни и те же участки кожи.
Распространенное герпетическое поражение кожи может возникнуть в связи с массивной инфекцией, например у борцов при тесном контакте вирус герпеса втирается в кожу. Описаны вспышки герпетической инфекции у борцов, которые возникали при наличии у одного из борцов даже небольших герпетических высыпаний. Эта форма (herpes giadiatorum) характеризуется большой зоной поражения кожи. На месте высыпания появляется зуд, жжение, боль. При обширной сыпи отмечают повышение температуры тела (до 38-39°С) и симптомы общей интоксикации в виде слабости, разбитости, мышечных болей. Сыпь локализуется обычно на правой половине лица, а также на руках и туловище. Элементы сыпи могут быть в разных стадиях развития.
Одновременно можно обнаружить везикулы, пустулы и корочки. Могут встречаться крупные элементы с пупковидным вдавлением в центре. Иногда элементы сыпи могут сливаться, образуя массивные корки, напоминающие пиодермию. Такой своеобразный путь передачи герпетической инфекции у спортсменов позволяет думать о возможности аналогичной передачи других инфекционных агентов, в частности, ВИЧ-инфекции.
Герпетические поражения слизистых оболочек полости рта проявляются в виде острого герпетического стоматита или рецидивирующего афтозного стоматита. Острый стоматит характеризуется лихорадкой, симптомами общей интоксикации. На слизистых оболочках щек, неба, десны появляются группы мелких пузырьков. Больные жалуются на жжение и покалывание в области поражений. Содержимое пузырьков вначале прозрачное, затем мутнеет. На месте лопнувших пузырьков образуются поверхностные эрозии. Через 1-2 нед слизистые оболочки нормализуются.
Заболевание может рецидивировать. При афтозном стоматите общее состояние больных не нарушено. На слизистых оболочках полости рта образуются единичные крупные афты (до 1 см в диаметре), покрытые желтоватым налетом.
Острые респираторные заболевания. Вирусы простого герпеса могут обусловить воспаление слизистых оболочек верхних отделов респираторного тракта. От 5 до 7% всех ОРЗ обусловлено герпетической инфекцией. Герпетическое поражение глотки проявляется в виде экссудативных или язвенных изменений задней стенки глотки, а иногда и миндалин. У многих больных (около 30%), кроме того, могут поражаться язык, слизистая оболочка щек, а также десны. Однако чаще всего по клиническим проявлениям герпетические ОРЗ трудно отличить от таковых другой этиологии.
Встречаются ректальные и перианальные герпетические высыпания, обусловленные вирусами герпеса 1 и 2-го типов, в частности у мужчин-гомосексуалистов. Проявлениями герпетического проктита служат боли в аноректальной области, тенезмы, запор, выделения из прямой кишки. При ректороманоскопии можно выявить гиперемию, отек и эрозии на слизистой оболочке дистальных отделов кишки (на глубину около 10 см). Иногда эти поражения сопровождаются парестезией в сакральной области, импотенцией, задержкой мочи.
Герпетический энцефалит. Герпетическая инфекция является наиболее частой причиной спорадических острых вирусных энцефалитов в США (до 20% энцефалитов обусловлено герпетической инфекцией). Чаще заболевают лица в возрасте от 5 до 30 лет и старше 50 лет. Почти во всех случаях (свыше 95%) герпетические энцефалиты бывают обусловлены вирусом типа 1. У детей и лиц молодого возраста уже первичная инфекция может привести к развитию энцефалита. У детей энцефалит также может быть составной частью генерализованной герпетической инфекции и сочетаться со множественными висцеральными поражениями.
В большинстве случаев у взрослых больных вначале появляются признаки герпетического поражения кожи и слизистых оболочек и лишь потом развиваются симптомы энцефалита. Нередко штаммы вируса герпеса, выделенные из ротоглотки и из тканей мозга, отличаются друг от друга, что свидетельствует о реинфекции, однако чаще причиной энцефалита является реактивация латентной инфекции, локализующейся в тройничном нерве.
Клиническими проявлениями герпетического энцефалита является быстрое повышение температуры тела, появления симптомов общей интоксикации и очаговых явлений со стороны центральной нервной системы. Течение болезни тяжелое, летальность (без применения современных этиотропных средств) достигала 30%. После перенесенного энцефалита могут быть стойкие резидуальные явления (парезы, нарушения психики). Рецидивы бывают редко.
Герпетический серозный менингит (0,5-3% всех серозных менингитов) развивается чаще улиц с первичным генитальным герпесом. Повышается температура тела, появляется головная боль, светобоязнь, менингеальные симптомы, в цереброспинальной жидкости умеренный цитоз с преобладанием лимфоцитов. Болезнь протекает относительно легко. Через неделю признаки болезни проходят. Иногда наблюдаются рецидивы с повторным появлением менингеальных признаков.
Висцеральные формы герпетической инфекции чаше проявляются в виде острых пневмоний и гепатита, может поражаться слизистая оболочка пищевода. Висцеральные формы являются следствием вирусемии. Герпетический эзофагит может быть следствием распространения вируса из ротоглотки или проникновения вируса в слизистую оболочку по блуждающему нерву (при реактивации инфекции). Появляются загрудинные боли, дисфагия, снижается масса тела. При эндоскопии выявляют воспаление слизистой оболочки с образованием поверхностных эрозий преимущественно в дистальном отделе пищевода. Однако такие же изменения могут наблюдаться при поражениях пищевода химическими веществами, при ожоге, при кандидозе и др.
Герпетическая пневмония является результатом распространения вируса из трахеи и бронхов на легочную ткань. Пневмония возникает часто при активации герпетической инфекции, что наблюдается при снижении иммунитета (прием иммунодепрессантов и др.). При этом почти всегда наслаивается вторичная бактериальная инфекция. Болезнь протекает тяжело, летальность достигает 80% (у лиц с иммунодефицитами).
Герпетический гепатит также чаще развивается у лиц с ослабленной иммунной системой. Повышается температура тела, появляется желтуха, повышается содержание билирубина и активность сывороточных аминотрансфераз. Нередко признаки гепатита сочетаются с проявлениями тромбогеморрагического синдрома, доходящего до развития диссеминированного внутрисосудистого свертывания.
Из других органов, которые могут поражаться при вирусемии, наблюдалось поражение поджелудочной железы, почек, надпочечников, тонкого и толстого кишечника.
Герпес новорожденных возникает в результате внутриутробного инфицирования преимущественно вирусом герпеса типа 2. Протекает тяжело с распространенными поражениями кожи, слизистых оболочек полости рта, глаз и центральной нервной системы. Поражаются также внутренние органы (печень, легкие). В большинстве случаев (у 70%) герпетическая инфекция протекает генерализованно с вовлечением в процесс головного мозга. Летальность (без этиотропной терапии) равна 65% и лишь у 10% в дальнейшем развитие протекает нормально.
Генерализованная герпетическая инфекция может наблюдаться не только у новорожденных, но и у лиц с врожденными или приобретенными иммунодефицитами (больные лимфогранулематозом, новообразованиями, получающие химиотерапию, больные гематологическими заболеваниями, лица, длительно получающие кортикостероиды, иммунодепрессанты, а также ВИЧ-инфицированные). Болезнь характеризуется тяжелым течением и поражением многих органов и систем. Характерны распространенные поражения кожи и слизистых оболочек, развитие герпетического энцефалита или менингоэнцефалита, гепатита, а иногда и пневмонии. Заболевание без использования современных противовирусных препаратов чаще заканчивается летальным исходом.
Герпес у ВИЧ-инфицированных развивается обычно в результате активации имевшейся латентной герпетической инфекции, при этом заболевание быстро приобретает генерализованный характер. Признаками генерализации является распространение вируса по слизистой оболочке из полости рта на слизистую оболочку пищевода, трахею, бронхи с последующим развитием герпетической пневмонии. Признаком генерализации является также появление хориоретинита. Развивается энцефалит или менингоэнцефалит. Поражения кожи захватывают различные участки кожи. Герпетическая сыпь обычно не исчезает, на месте герпетических поражений формируются изъязвления кожи. Герпетическая инфекция у ВИЧ-инфицированных не имеет тенденции к самопроизвольному излечению.
Диагноз и дифференциальный диагноз.
Распознавание герпетической инфекции в типичных случаях основывается на характерной клинической симптоматике, т.е. когда имеется характерная герпетическая сыпь (группа мелких пузырьков на фоне инфильтрированной кожи). Для подтверждения диагноза используют методы выделения (обнаружения) вируса и серологические реакции для выявления антител. Материалом для выделения вируса от больного человека могут служить содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки, жидкость из передней камеры глаза, кровь, цереброспинальная жидкость, кусочки биопсированной шейки матки, цервикальный секрет; при вскрытии берут кусочки мозга и различных органов.
Внутриядерные вирусные включения можно обнаружить при микроскопии окрашенных по Романовскому-Гимзе соскобов основания везикул. Однако такие включения обнаруживаются лишь у 60% больных герпетической инфекцией, кроме того, их трудно дифференцировать от аналогичных включений при ветряной оспе (опоясывающем лишае). Наиболее чувствительным и достоверным методом является выделение вируса на культуре тканей. Серологические реакции (РСК, реакция нейтрализации) имеют малую информативность. Нарастание титра антител в 4 раза и более можно выявить лишь при острой инфекции (первичной), при рецидивах лишь у 5% больных отмечается нарастание титра. Наличие положительных реакций без динамики титров можно выявить у многих здоровых людей (за счет латентной герпетической инфекции).
Лечение.
Герпетическая инфекция во всех клинических формах поддается воздействию противовирусных препаратов. Наиболее действенным из них является Зовиракс (Zoviraxum). Синонимы: Aciclovir, Виролекс. Американские врачи, имеющие наибольший опыт применения противогерпетических препаратов, разработали схемы лечения больных различными формами герпетической инфекции [L.Corey, 1989, 1994].
Герпетическое поражение кожи и слизистых оболочек. Больные с ослабленным иммунитетом.
Больные с нормальным иммунитетом. Герпетическая инфекция половых путей:
Герпетическая инфекция ротовой полости и кожи лица:
а) Первый эпизод: эффективность перорального применения ацикловира до настоящего времени не изучена.
б) Рецидивы: местное применение ацикловира не имеет клинического значения; пероральный прием ацикловира не рекомендуется.
Герпетический панариций: исследований по изучению противовирусной химиотерапии до настоящего времени не проводилось.
Герпетический проктит: ацикловир перорально по 400 мг 5 раз в сутки уменьшает длительность течения болезни. Больным с ослабленным иммунитетом или при тяжелых инфекциях рекомендуется внутривенное введение ацикловира в дозе 5 мг/кг каждые 8 ч.
Герпетическая инфекция глаз:
Герпетическая инфекция центральной нервной системы:
Герпетический энцефалит: ацикловир внутривенно в дозе 10 мг/кг каждые 8 ч (30 мг/кг в сутки) в течение 10 дней или видарабин внутривенно в дозе 15 мг/кг в сутки (снижает смертность). Предпочтительнее ацикловир.
Герпетическое поражение внутренних органов.
Профилактика и мероприятия в очаге.
Для предупреждения воздушно-капельного распространения инфекции следует проводить комплекс мероприятий как при ОРЗ (см. Грипп). Соблюдать меры предосторожности для профилактики инфицирования новорожденных. Для предупреждения генитального герпеса используют презервативы, но при наличии высыпаний этого может оказаться недостаточно. Разрабатывается убитая вакцина для профилактики рецидивов герпетической инфекции. Эффективность ее еще недостаточно изучена.
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
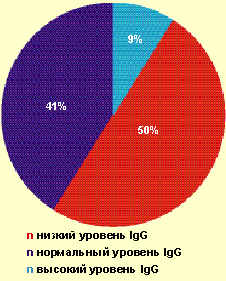 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
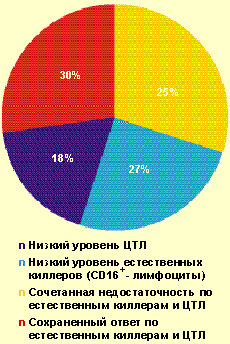 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва