Гепатит 2 типа что это такое простым языком
Диагностическая тактика и рекомендации по лечению больных хроническим гепатитом С, инфицированных генотипом 2 ВГС

В статье представлены рекомендации по лечению хронического гепатита С при инфицировании генотипом 2 ВГС и рекомбинантным вариантом вируса RF2k/1b, который при использовании коммерческих тест-систем типируется как генотип 2 в связи с особенностями организа
The paper presents the guidelines on treatment of chronic hepatitis c, in infecting with genotype 2 VHS and with recombinant variant of RF2k/1b virus which, in use of commercial test-systems, is classified as genotype 2B in connection with characteristics of its genome structure. The algorithm for diagnostic and therapeutic strategy in this category of patients was suggested.
Главной целью лечения хронического гепатита С (ХГС) является полное излечение от заболевания, что возможно только при условии эрадикации вируса из организма. Инфекция вирусом гепатита С (ВГС) излечивается у 99% пациентов после завершения курса противовирусной терапии (ПВТ) при наличии устойчивого вирусологического ответа (УВО) [1], который считается достигнутым, если РНК ВГС в организме пациента отсутствует через 12 (УВО12) или 24 (УВО24) недели после завершения курса лечения (Европейская ассоциация по изучению болезней печени, European Association for the Study of the Liver, EASL, 2015) [2].
В течение последних 20 лет тактика обследования и лечения больных ХГС существенно усовершенствовалась благодаря раскрытию многих аспектов патогенеза заболевания, повышению качества диагностических процедур (возможности определения генотипов и субтипов ВГС, определения стадий фиброза печени неинвазивными методами, определения вариантов полиморфизма генов человека, влияющих на успех терапии) и, наконец, вследствие значительного «прорыва» в создании противовирусных препаратов, мишенями для которых являются вирусные белки. Это новое поколение препаратов прямого противовирусного действия (ПППД) в буквальном смысле произвело революцию в лечении ХГС и позволило излечивать даже такую трудную категорию пациентов, как больные с циррозом печени, и больных, перенесших трансплантацию печени.
До 2011 г. в Европе, США и России для лечения ХГС была утверждена комбинация пегилированного интерферона (ПЕГ ИФН) и рибавирина (РИБ) с продолжительностью курса 24 или 48 недель в зависимости от генотипа ВГС. У пациентов, инфицированных генотипом 1 ВГС, частота достижения УВО в результате лечения данной комбинацией в течение 48 недель достигала приблизительно 50% у пациентов-европеоидов (не афроамериканцев и не азиатов). Более высокая частота УВО регистрировалась у пациентов, инфицированных генотипами 2 и 3 ВГС (до 80%, и в большей степени это относилось к пациентам с генотипом 2 ВГС) [3].
С внедрением в клиническую практику ПППД для лечения ХГС, вызванного ВГС 2-го генотипа, в Европе начиная с 2014 г. широкое применение получили схемы лечения, не содержащие ИФН. Для лечения пациентов, инфицированных генотипом 2 ВГС, одобрены для применения следующие ПППД: Софосбувир (SOF) — пангенотипный нуклеотидный аналог, ингибитор РНК-зависимой РНК-полимеразы NS5B ВГС (одобрен в январе 2014 г.), Даклатасвир (DAC) — пангенотипный ингибитор белка NS5A ВГС — (одобрен в августе 2014 г.). Применение комбинации SOF и РИБ рекомендовано больным ХГС при наличии инфицирования генотипом 2 ВГС (12 недель) или генотипом 3 ВГС (24 недели). Данная комбинация обеспечивает частоту УВО порядка 80–95% даже в случае предшествующей неудачи лечения ПЕГ ИФН + РИБ.
В то же время в рекомендациях EASL 2015 г. [2] указано, что, несмотря на то, что эта комбинация является оптимальным вариантом для пациентов, инфицированных генотипом 2 ВГС, можно использовать и другие схемы терапии (SOF + DAC ± РИБ), особенно для пациентов, не достигших УВО в результате лечения сочетанием препаратов SOF + РИБ. Например, для пациентов, не ответивших в прошлом на двойную терапию ПЕГ ИФН + РИБ, применять 12-недельный курс терапии комбинацией препаратов ПЕГ ИФН + РИБ + SOF, которая рекомендована для всех генотипов ВГС. А если нет возможности применения SOF и DAC, можно назначать сочетание ПЕГ ИФН + РИБ в соответствии с предыдущими рекомендациями Европейской ассоциации по изучению болезней печени [3] и Всемирной организации здравоохранения 2015 г. [4]. В табл. 1 представлены рекомендации Европейской ассоциации по изучению болезней печени 2015 г. по лечению больных ХГС, инфицированных генотипами 1, 2 и 3 ВГС.
Для пациентов с циррозом печени изменения в рекомендуемых Европейской ассоциации по изучению болезней печени (2015 г.) схемах лечения касаются в основном длительности курса и наличия/отсутствия в применяемой схеме рибавирина (табл. 2).
Для российских пациентов с ХГС, инфицированных генотипом 2 ВГС, в соответствии с российскими рекомендациями по лечению взрослых больных гепатитом С 2014 г. [5] и в связи с тем, что SOF начинает применяться в России в 2016 г., пока в основном доступно лечение ПЕГ ИФН + РИБ. Необходимо отметить, что эффективность лечения данной группы пациентов двойной терапией ПЕГ ИФН + РИБ в течение 24 недель превышает 80%, как показали регистрационные исследования этой терапии у больных ХГС, инфицированных данным генотипом [6, 7]. По данным исследований последних лет, эффективность остается очень высокой (87–97%) и при сокращении курса терапии до 12–16 недель по данным исследований NORDynamIC, CLEO и других исследований, опубликованных в период с 2007 г. по 2016 г., особенно при условии достижения быстрого вирусологического ответа (БВО) к 4-й неделе лечения [8–13]. Кроме того, на фоне высокой стоимости безинтерфероновых схем лечения (более миллиона рублей) двойная терапия ПЕГ ИФН + РИБ в течение 24 недель у пациентов без цирроза печени имеет значительное преимущество с фармакоэкономической точки зрения, поскольку затраты на ее проведение могут составлять не более 200 тысяч рублей, а эффективность лечения сопоставима с таковой при лечении безинтерфероновыми схемами (SOF + РИБ по данным исследований FISSION, POSITRON и VALENCE (97%, 93% и 97% соответственно)) [14–16]. Однако, принимая во внимание существенно меньшую эффективность лечения пациентов с циррозом печени (независимый от генотипа предиктор ответа на ПВТ), безусловно, безинтерфероновые схемы лечения являются предпочтительными для данной категории пациентов (по данным исследования VALENCE 92% достижения УВО после 24 недель лечения у пациентов с циррозом, не получавших ранее лечение).
По данным метаанализа исследований, посвященных оценке стоимость/эффективность ПВТ (C. Bickerstaff, 2015), наиболее оптимальным затратоэффективным вариантом для пациентов без цирроза печени, инфицированных генотипом 2 ВГС, является двойная терапия ПЕГ ИФН + РИБ даже с учетом наличия на рынке ПППД, а для пациентов с циррозом печени — 24-недельный курс лечения SOF + РИБ. Однако в данном исследовании анализировались не все безинтерфероновые режимы [17]. Таким образом, лечение пациентов, инфицированных генотипом 2 ВГС, в большинстве случаев не является сложной задачей и дорогостоящей опцией, если генотип ВГС идентифицирован правильно и отсутствуют данные за микст-инфекцию разными генотипами ВГС или инфицирование «необычным» вариантом вируса.
Исследования последних лет в области молекулярной генетики вирусов показали, что значительная гетерогенность популяции ВГС (6 генотипов, подразделенных на 88 субтипов) связана не только с высокой скоростью мутаций вирусного генома, но также с рекомбинациями, происходящими между «родительскими» геномами некоторых геновариантов вируса. Это может приводить к появлению вирусов с рекомбинантным геномом и новыми фенотипическими свойствами. Особенностью определенной группы природных межгенотипных рекомбинантов ВГС является принадлежность части их генома (область, кодирующая структурные белки ВГС) к генотипу 2 до рекомбинационного сайта, расположенного всегда в NS2/NS3 регионе. После рекомбинационного сайта область генома большинства рекомбинантных вариантов принадлежит к эпидемическим субтипам 1a или 1b. Достаточно широкое распространение получил только рекомбинант RF2k/1b, впервые обнаруженный в 2002 г. в Санкт-Петербурге [18] и который начиная с 2005 г. официально внесен в классификацию ВГС. Отличительной особенностью варианта RF2k/1b является принадлежность всех его структурных генов к субтипу 2k генотипа 2, а неструктурных генов — к наиболее трудно поддающемуся лечению интерфероном субтипу 1b. Изоляты природного рекомбинанта RF2k/1b идентифицированы на пяти территориях России (Санкт-Петербург, Москва, Московская область, Тамбовская область, Сибирь), а также в Эстонии, Узбекистане, Азербайджане, Швеции, Ирландии, Голландии, Франции, Кипре, США. При этом в Швеции, Ирландии, Голландии, Франции и Кипре изоляты RF2k/1b обнаружены только у эмигрантов из Грузии, Армении, Азербайджана или России (единичные случаи). Такая география выявления межгенотипного рекомбинанта RF2k/1b обусловлена его уникальными фенотипическими характеристиками, которые позволяют ему быстро распространяться в человеческой популяции, а филогенетический анализ в сочетании с доступными эпидемиологическими данными свидетельствует о том, что данный вариант ВГС успешно распространяется, а также происходит постоянный вброс изолятов RF2k/1b как в основную популяцию населения различных стран, так и в группы риска (лица, употребляющие внутривенно психоактивные вещества) [19–22].
К 2015 г. опубликованы данные по эффективности лечения ПЕГ ИФН + РИБ в целом только у 23 пациентов, инфицированных рекомбинантным вариантом RF2k/1b ВГС. Эффективность лечения в небольших группах пациентов описана в работах как российских авторов, так и исследователями из Грузии, где рекомбинатный вариант составляет 76% в структуре популяции генотипа 2 ВГС, а также исследователями из США, которые представили данные об эффективности лечения этого варианта не только ПЕГ ИФН + РИБ, но и SOF + РИБ. Эффективность лечения ПЕГ ИФН + РИБ варьировала от 20% до 48%, и только в 30% случаев достигнут успех в результате лечения SOF + РИБ по схеме лечения для генотипа 2–12 недель [23–25].
В исследовании, посвященном клиническому значению предикторов успеха терапии, в том числе генетически детерминированных (как со стороны ВГС, так и человека), выполняемом авторами статьи в течение двух лет, получены данные о том, что из 19 обследованных больных московской популяции больных ХГС, инфицированных генотипом 2 ВГС по данным коммерческих тест-систем, у 7 (37%) пациентов выявлен межгенотипный рекомбинант RF2k/1b по результатам генотипирования на основе анализа фрагментов NS5B области генома ВГС. При этом у пяти из них был опыт терапии ПЕГ ИФН + РИБ в течение 24–32 недель, и у всех (100%) не был достигнут УВО.
Проведенное нами в 2015 г. сравнительное исследование результатов типирования вариантов ВГС с использованием различных коммерческих тест-систем российского производства и результатов генотипирования на основе анализа фрагментов NS5B и core областей генома подтвердило невозможность идентификации в клинической лабораторной практике рекомбинантного варианта RF2k/1b ВГС, который при использовании коммерческих тест-систем типируется как генотип 2 в связи с особенностями организации его генома. Для идентификации этого варианта вируса необходимо проводить генотипирование, основанное на полимеразной цепной реакции с применением типоспецифических праймеров, соответствующих двум областям, вторая из которых должна находиться в области неструктурных генов, в частности, в гене, кодирующем РНК-зависимую РНК-полимеразу. К сожалению, пока такой подход не реализован ни в одной российской зарегистрированной коммерческой тест-системе, но в принципе реализуем в лабораторной практике.
Принимая во внимание, что генотип ВГС определяет схемы назначаемой терапии, а имеющиеся данные результатов ПВТ указывают на то, что комбинации противовирусных препаратов, используемых для генотипа 2 ВГС, не позволяют достичь УВО большинству пациентов, инфицированных рекомбинантным вариантом RF2k/1b, существует потребность включения в клиническую лабораторную практику субтипирования всех изолятов генотипа 2 на основе анализа фрагмента NS5B области генома. Такие мероприятия позволят успешно выявлять рекомбинантные формы ВГС и повысят эффективность ПВТ.
На рисунке приведен предлагаемый нами алгоритм по диагностике и лечению больных ХГС, у которых по данным коммерческих тест-систем выявлен генотип 2 ВГС.
Работа выполнена при поддержке Российского Научного Фонда (приоритетное направление деятельности РНФ «Проведение фундаментальных научных исследований и поисковых научных исследований отдельными научными группами», соглашение № 14-15-00546).
Литература
* ГБОУ ВПО МГМУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН СПбНИИЭМ им. Пастера, Санкт-Петербург
Гепатит C. Симптомы, диагностика, лечение, профилактика
Гепатит C – хроническое инфекционное заболевание, вызываемое вирусом HCV, который поражает в первую очередь печень. Инфекция часто протекает бессимптомно, так что большинство больных даже не подозревают о ее существовании в течение многих лет. Если лечение отсутствует, то инфекция может привести к серьезным осложнениям, таким как цирроз и рак печени. Вирус HCV передается в основном при прямом контакте с кровью.
Строение и функции печени
Печень при весе около 1,2-1,5 кг (около 2% от фактического веса тела) является не только самым большим органом человеческого тела, но и самой большой железой. Находится в правой верхней части живота, чуть ниже диафрагмы. Печень делится на две части: правую и левую доли. Обе доли печени хорошо различимы, потому что они разделены ленточной структурой, исходящей от диафрагмы. Печень состоит из эпителиальных клеток (гепатоцитов), которые выходят наружу из центральной вены. Между этими клетками находятся тончайшие кровеносные сосуды, которые переносят кровь к центральной вене.
Благодаря своему расположению вблизи органов пищеварения печень играет важную роль в утилизации пищевых компонентов. В минуту через печень проходит около 1,5 л крови, что составляет около ¼ части. Она фильтрует кровь, чтобы сохранить другие органы тела от повреждений. Важные вещества, такие как углеводы и белки, могут храниться в клетках печени, а вредные (яды, лекарства), обезвреживаться.
Важной функцией печени является выведение билирубина из кровотока. Гемоглобин, превращается в билирубин в кровотоке в несколько этапов. Конечный продукт направляется через желчный проток в кишечник, где он выводится со стулом. Если эта функция печени нарушена, билирубин не отфильтровывается. В организме образуется его избыток, так называемый затор, что приводит к желтухе.
Формы гепатита C
В зависимости от формы заболевания определяется ход лечения. При своевременном обращении к врачу вероятность полного выздоровления возрастает.
При отсутствии лечения происходит стремительное поражение гепатоцитов, что чревато развитием онкологических заболеваний или цирроза.
Гепатит 2 типа что это такое простым языком
Молекулярно-генетическое исследование для определения генотипа вируса гепатита С.
Применяемый набор реагентов может быть использован для диагностики вируса гепатита С и наиболее распространенных на территории России генотипов HCV (1a, 1b, 2, 3a и 4) in vitro.
Вирус гепатита С (ВГС).
Hepatitis C Virus (HCV) Genotyping, HCV Subtype.
Полимеразная цепная реакция с обратной транскрипцией в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Вирус гепатита С (ВГС) способен поражать клетки печени, а также некоторые клетки крови (нейтрофилы, моноциты, В-лимфоциты). В основном инфекция передается через кровь (препараты для переливания элементов крови и плазмы, донорские органы, нестерильные шприцы, иглы, инструменты), реже вероятно заражение половым путем.
Острый вирусный гепатит, как правило, протекает бессимптомно и в большинстве случаев остается невыявленным. У 60-85 % инфицированных развивается хроническая инфекция, которая увеличивает риск развития цирроза, печеночной недостаточности и гепатоцеллюлярной карциномы. За свое скрытое, но разрушительное действие инфекция получила неофициальное название «ласковый убийца».
ВГС обладает наибольшей вариабельностью среди всех возбудителей вирусных гепатитов и благодаря высокой мутационной активности способен избегать воздействия защитных механизмов иммунной системы. Геномы вируса значительно отличаются в разных странах мира и имеют различную чувствительность к препаратам интерферонов.
Противовирусная терапия, направленная на подавление прогрессирования заболевания, в редких случаях может ускорить развитие осложнений со стороны печени. Это происходит при неправильной оценке клинических и лабораторных показателей. Генотипирование РНК вируса гепатита С позволяет спрогнозировать эффект от планируемой терапии.
Генотип 1 хуже поддается лечению, чем генотипы 2 и 3. Кроме того, биопсию печени важнее провести именно при генотипе 1. Повышенные дозы препаратов интерферона рекомендованы для пациентов с 1-м и 4-м генотипами. Курс терапии у таких пациентов должен быть продлен до 48 недель даже при отсутствии вируса в крови более 24 недель. В случае успешности лечения, которая подтверждается снижением вирусной нагрузки крови ( Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: РНК HCV не обнаружена.
При обнаружении указывается генотип:
Результат
Значение
Очень высокий риск хронизации инфекции и развития тяжелых осложнений. Необходимо лечение более высокими дозами интерферона в течение 48 недель.
В большинстве случаев в течение 24 недель достигается планируемый терапевтический эффект.
Труднее поддается лечению, требует доз препаратов, отличных от применяемых при терапии с генотипами 2 или 3.
Что может влиять на результат?
Хронический гепатит С: клиника, диагностика, лечение
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Эпидемиология
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Популяция вируса неоднородна. Идентифицированы 6 генотипов (классификация по Simmonds), более 90 субтипов и множество вариантов вируса, обозначаемых как квазивиды. Зарегистрирована территориальная неравномерность циркуляции генотипов вируса гепатита С. В России чаще всего выявляются генотипы 1b и 3а этого вируса.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Патогенез
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Диагностика
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
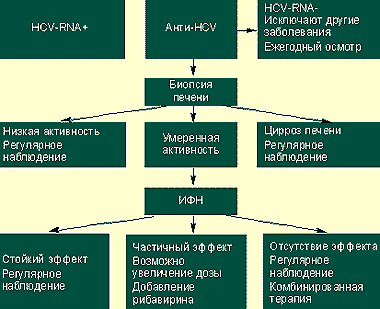 |
| Алгоритм ведения HCV-положительных больных |
Естественное течение и прогноз
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
Клиническая картина
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Внепеченочные проявления HCV-инфекции
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Заболевания, ассоциированные с HCV-инфекцией
Ассоциированные с продукцией или отложением иммуноглобулинов:
Ассоциированные с неизвестным механизмом:
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическое исследование печени
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
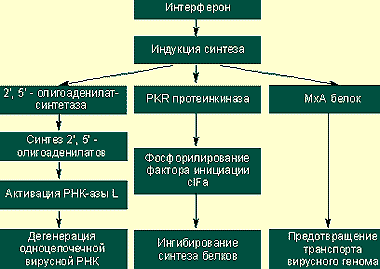 |
| Предотвращение вирусной транскрипции и трансляции |
Лечение
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
Согласно рекомендации согласительной конференции Европейской ассоциации по изучению печени (1999), больным с впервые установленным диагнозом «хронический гепатит С» и показаниями к лечению необходимо назначать ИФa в комбинации с рибавирином следующими курсами:
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Одним из наиболее перспективных пегилированных интерферонов является пегасис — ПЭГ-интерферон альфа-2а, соединенный с разветвленной молекулой полиэтиленгликоля, молекулярная масса которого составляет 40 kDa, общий вес молекулы — около 60 kDa. Особенности химической структуры данного препарата определяют его фармакокинетические свойства и клиническую эффективность. Молекула полиэтиленгликоля присоединена к альфа-интерферону посредством самой стабильной амидной связи, это делает молекулу пегасиса чрезвычайно устойчивой к действию петидаз и позволяет выпускать препарат в виде растворенной и готовой к употреблению лекарственной формы. Особенностью молекулы полиэтиленгликоля является способность активно связывать несколько молекул воды, что создает вокруг химически структурной единицы пегасиса эффект «водного облака», делая ее устойчивой во внутренней среде и сообщая препарату относительно небольшой объем распределения. Это, в свою очередь, способствует тому, что отпадает необходимость в коррекции дозы препарата в зависимости от массы тела пациента: пегасис вводится один раз в неделю в дозе 180 мкг. Существенными преимуществами препарата пегасис являются значительно лучшая переносимость и меньшая частота побочных реакций, ассоциированных с системным действием альфа-интерферона, что значительно улучшает качество жизни пациентов, получающих лечение по поводу хронического гепатита С. Кроме того, в отличие от других пегилированных интерферонов пегасис не требует существенной коррекции дозы в зависимости от функционального состояния почек, что делает препарат незаменимым у пациентов с сопутствующей хронической почечной недостаточностью.
Клиническая эффективность пегасиса оценена солидными широкомасштабными многоцентровыми рандомизированными исследованиями. Было показано, что частота доказанного ответа на лечение значительно превышает таковую по сравнению с «короткими» интерферонами как в схемах монотерапии, так и в сочетании с рибавирином. Особенно впечатляющими в этой связи являются результаты этиопатогенетической терапии с использованием пегасиса в сочетании с рибавирином у так называемой «трудной» категории пациентов, имеющих морфологические проявления цирроза печени, 1b-генотип вируса, высокую виремию: частота доказанного ответа на лечение у данной категории пациентов при использовании пегасиса в сочетании с рибавирином может составлять около 40%, у иных категорий пациентов этот показатель может превышать 75%, что ранее было практически немыслимым результатом.
Другие противовирусные препараты в лечении хронического гепатита С
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию
_575.gif)
_575.gif)
.gif)
