Генная терапия это что
Генная терапия это что
В настоящее время генотерапия является одним из самых перспективных направлений в современной медицинской науке для лечения многих наследственных и других заболеваний. Однако, как показывает мировой опыт, при использовании этого метода лечения не следует ожидать абсолютной безопасности. В отдельных странах Европы и мира уже действующие законы по генно-инженерной деятельности дополнены разделами по генной терапии. В Российской Федерации регуляторные аспекты, относящиеся к изучению и применению генно-терапевтических препаратов, значительно менее развиты. В связи с этим необходимо разработать критерии оценки безопасности применения таких лекарственных средств и решить вопросы их регистрации соответствующими надзорными органами.
В настоящее время наиболее перспективные направления в современной медицине связаны с бурным развитием таких высокотехнологичных методик, как нанотехнологии, использование стволовых клеток и создание генно-терапевтических препаратов. Министерство здравоохранения и социального развития Российской Федерации уделяет должное внимание развитию этих технологий с целью обеспечения населения доступной персонифицированной, высокоспецифичной и эффективной медицинской помощью. С целью регулирования вопросов качества и безопасности применения биомедицинских технологий Минздравсоцразвития России был разработан проект Закона «О биомедицинских клеточных технологиях», который уже прошел процедуру согласования с федеральными ведомствами [1]. Другим аспектом этого направления является необходимость совершенствования регулирующих правоотношений для обеспечения безопасности использования новых генно-терапевтических лекарственных продуктов.
В современной медицине принято определение генотерапии в качестве способа лечения (коррекции) заболеваний (наследственных, многофакторных, приобретенных (инфекционных), онкологических) путем введения в ткани или клетки больного чужеродной (отсутствующей у него) генетической информации (генов) с целью направленного изменения генных дефектов или придания клеткам новых функций [2]. Изначально генотерапия рассматривалась как средство лечения наследственных заболеваний на генетическом уровне, т.е. как коррекция генома на уровне молекулы ДНК. Однако в настоящее время применение генотерапии значительно расширилось и включает в себя не только методы коррекции наследственных патологий и приобретенных заболеваний, но также и лечение вирусных инфекций на генетическом уровне путем введения в клетки полноценных функционально активных (терапевтических) генов или последовательностей ДНК, регулирующих активность генов.
По основным подходам в реализации целей генной терапии можно выделить различные виды генотерапии.
По основной стратегии лечения применение генной терапии может быть разделено на:
— внесение нормального, здорового гена в клетки, дефектные по этому гену (например, при наследственных болезнях);
— подавление патологической функции гена внутри клетки;
— усиление иммунного ответа аутологичных клеток реципиента ex vivo с последующим возвратом их в организм [3].
Основываясь на типе клеток-мишеней, генную терапию можно разделить на соматическую генную терапию, где объектом выступают соматические клетки, и фетальную генную терапию, объектом которой служат клетки плода.
В основе действия генно-терапевтических препаратов лежит принцип воздействия на болезнь с помощью генов, переносимых в клетки организма больного. Привнесение генного материала в организм реципиента может быть осуществлено непосредственно с помощью вирусных векторов или невирусных систем, либо в виде предварительно генетически модифицированных (ex vivo) клеток (например, донорских стволовых клеток пуповинной крови или аутологичных стволовых клеток костного мозга). Процедуру генотерапии можно разделить на три основных этапа: генно-инженерный — получение нужных продуктов (рекомбинантных ДНК и векторов, модифицированных клеток), доставка их в организм реципиента в виде инъекций, аэрозолей или с помощью клеточной трансплантации и, наконец, клинические испытания и лечение.
Генотерапии свойственны следующие риски, влияющие как на эффективность самого лечения, так и представляющие угрозу здоровью больного:
— вирусы-переносчики могут содержать протоонкогены;
— встраивание внешнего генетического материала в геном реципиента происходит неконтролируемо, из-за чего может быть нарушена экспрессия собственных клеточных протоонкогенов либо супрессоров опухолевого роста;
— экспрессия трансгенов подавляется провоспалительными цитокинами, такими как IFN-? и IFN-?, чья продукция активируется в ответ на инфекцию;
— иммунная система реципиента либо уничтожает самих переносчиков, либо уничтожает инфицированные клетки, либо вырабатывает антитела к ним, что затрудняет повторную трансфекцию;
— у реципиента еще до проведения терапии в организме могут присутствовать антитела к определенным типам вирусов;
— введение больших доз переносчиков может оказывать токсическое воздействие на организм реципиента [4,5].
В настоящее время проводятся активные исследования и клинические испытания средств генной терапии. По социальной значимости протоколов генотерапии лидируют злокачественные новообразования, нейродегенеративные и кардиологические заболевания, наследственные болезни, инфекции. Однако успехи оказались довольно скромными. Пока лечение с помощью генотерапии в лучшем случае лишь очень немного улучшает состояние больного, иногда вообще не дает результата, часто клинические испытания прерываются из-за серьезных иммуногенных реакций.
В мире насчитывается множество лабораторий, занимающихся созданием генно-терапевтических препаратов. Исследования в этой области расширяются, несмотря на их дороговизну. Ведь только, по официальным сведениям, в США на генную терапию тратится 8 млрд долл. в год, не считая того, что вкладывают биотехнологические и биомедицинские фирмы. А сколько средств тратят эти компании, не знает никто. Одна небольшая лаборатория (5–10 человек) тратит в год несколько миллионов долларов. Однако, судя по всему, лечение с помощью генотерапии в ближайшие годы не принесет никакой прибыли — ни один человек не способен оплатить такое лечение.
НЦССХ им. А.Н.Бакулева и Институтом биологии гена РАН был разработан генный препарат Ангиостимулин на основе плазмидной конструкции, содержащей ген VEGF165 человека. Доклинические исследования были выполнены на модели ишемии задних конечностей крыс [6]. Достоверный прирост количества капилляров был обнаружен исследователями через 1 месяц после внутримышечного введения суспензии плазмиды (250 мкг плазмиды на одно животное).
В 2002 г. в НЦССХ им. А.Н.Бакулева было начато клиническое исследование эффективности Ангиостимулина у больных с ишемической болезнью сердца [7]. Препарат вводили интромиокардиально в ишемизированную зону в общей дозе 1 000 мкг на одно введение. У всех больных в течение 2 лет было отмечено значимое клиническое улучшение в сравнении с дооперационной картиной.
В 2008 г. в ФГУ «Российский кардиологический научно-производственный комплекс МЗСР РФ» проведены I и IIа фазы клинического исследования препарата Корвиан у больных с критической ишемией нижних конечностей (20 человек) [8]. Корвиан представляет собой суспензию плазмиды, несущей кДНК фактора VEGF165, в физиологическом растворе (1 доза – 4 мл суспензии). Плазмида разработана в Институте экспериментальной кардиологии (ФГУ РКНПК Росздрава, Москва). В доклинических исследованиях было показано, что препарат стимулирует неоангиогенез и не токсичен. В случае получения положительных результатов испытаний I/IIa фаз планируется применение препарата при других патологиях, связанных с нарушением трофики тканей.
В том же году МГУ им. М.В.Ломоносова совместно с НИИЭМ им. Н.Ф.Гамалеи РАМН представили проект «Создание генно-терапевтических лекарственных препаратов для лечения заболеваний, обусловленных недостаточным кровоснабжением тканей и органов», рассчитанный на 3 года. В данном проекте использованы конструкции с генами шести факторов: фактор роста эндотелия сосудов (VEGF-А165), фактор роста гепатоцитов (HGF), ангиопоэтин-1, тромбоцитарный фактор роста (PDGF-BB), урокиназа, а также ген, кодирующий синтез белка нейрегулина-1 (NRG1). Выбор генов обусловлен свойствами кодируемых ими белков, которые взаимно дополняют друг друга во влиянии на ангиогенез и могут обеспечить достижение необходимых терапевтических эффектов. Авторы проекта надеются, что в результате будет создано опытно-промышленное производство по международным стандартам GMP.
В рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2012 гг.» планируется разработка и выпуск опытных партий новых эффективных направленно-модифицированных терапевтических и диагностических средств постгеномной генерации для лечения рака легкого и пищевода. Проект объединяет крупнейшие научные центры страны: Институт молекулярной генетики РАН, Российский онкологический научный центр им. Н.Н.Блохина РАМН, Институт биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова, Новосибирский государственный университет, Институт биологии гена РАН, Институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН, а также биотехнологические компании ЗАО «Евроген» и ЗАО «Биннофарм». В рамках проекта созданы конструкции, позволяющие осуществлять специфическую экспрессию терапевтических генов в раковых клетках, а также системы доставки терапевтических генов в опухоли.
В Новосибирском институте биоорганической химии разрабатываются подходы к созданию на основе олигонуклеотидов ген-направленных биологически активных веществ и терапевтических препаратов, открывающих возможность инактивации геномов инфекционных агентов и избирательного подавления экспрессии генов, ответственных за злокачественное перерождение клетки. Одним из разработчиков этой программы является академик РАН Евгений Свердлов, который 3 года назад возглавил проект по созданию первого в России противоракового препарата на основе методов генной терапии.
Таким образом, создание специфических препаратов для генотерапии может оказаться делом уже не столь отдаленного будущего, но говорить о радужных перспективах этого нового направления в медицине пока не представляется возможным, так как для доказательства эффективности хотя бы одного препарата нужно провести более широкие клинические исследования. Кроме того, не разработаны критерии оценки безопасности применения таких лекарственных средств и не решены вопросы их регистрации соответствующими надзорными органами.
Более того, вокруг генетической диагностики и терапии появилось множество околомедицинских мошенников и шарлатанов, которые выдают отдаленные перспективные ожидания и прогнозы ученых за уже свершившийся и активно используемый в медицине факт. По этому поводу группа ученых Evans J.P., Meslin E.M., Marteau T.M., Caulfield T. из США, Великобритании и Канады в своей недавней статье в журнале Science обратила внимание читателей на раздувающийся «генетический пузырь» – пока недостаточно обоснованные надежды людей на то, что достижения генетической медицины будут в ближайшее время воплощены в жизнь и найдут свое практическое применение. Авторы статьи призывают не поддаваться «генетической эйфории» [9].
На настоящий момент FDA не выдало ни одного разрешения на широкое клиническое применение генно-терапевтических лекарственных препаратов [10]. При этом Национальным институтом здоровья США официально опубликованы данные о проведении почти 2 тыс. клинических исследований с использованием генно-терапевтических препаратов на уровне от первой до третьей фаз [11].
Существующий нормативно-правовой «вакуум» в области генотерапии в России в начале ее становления был ей на благо, так как не становился преградой для новаторских исследований. Однако развитие и все более широкое овладение методами генной инженерии, возможность заниматься генотерапией в негосударственных структурах, общее нарастание криминальных тенденций в биомедицине настойчиво и безотлагательно требуют разработки механизмов контроля научной и клинической деятельности в области генотерапии.
Опубликовано: журнал «Вестник Росздравнадзора» №4 (2011)
Медицинские интернет-конференции
Языки
Медико-этические аспекты генотерапии
Ворфоломеев С.А., Юпатов В.Д., Ялиева Л.К., Фахрудинова Э.Р.
Резюме
В этой статье освещены основные морально-этические и этико-правовые вопросы генной инженерии и, в частности, генотерапии. Данная тема является более чем актуальной, в связи со стремительным развитием молекулярной генетики и расшифровкой структуры ДНК. Здесь мы пытаемся ответить на вопрос: имеет ли место вмешательство человека в естественные механизмы существования живых организмов.
Ключевые слова
Статья
Ворфоломеев С., Юпатов В., Ялиева Л., Фахрудинова Э.Р.
Министерство здравоохранения Российской Федерации
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России
Кафедра философии, гуманитарных наук и психологии
Медико-этические аспекты генотерапии
Стремительное развитие молекулярной генетики, расшифровка структуры ДНК, появление методов генной инженерии и генной терапии вполне ожидаемо столкнули человечество с рядом морально-этических и этико-правовых вопросов, связанных с прямым вмешательством человека в механизмы существования живых организмов.
Большее количество этих вопросов еще далеко от разрешения. Некоторые из них нашли свои ответы в международных и отечественных этико-правовых документах. Свое мнение относительно этих проблем выразили и представители ряда религиозных конфессий. Многие вопросы являются предметом длительных дискуссий и на сегодняшний день:
Может ли человек стать творцом направленной биоэволюции?
Может ли «цепочка из нескольких нуклеотидов» стать показателем личностных качеств индивидуума?
Применима ли генетическая модификация путем избирательной селекции определенных генов к человеку и человеческому роду в целом? И возможно ли таким образом подготовить основу для создания «сверхчеловека»?
Имеет ли место государственное и общественное регулирование процесса научных исследований?
Также встает вопрос и о доступности методов генной инженерии для отдельных слоев населения.[4]
Генная терапия представляет собой новый метод лечения генетически обусловленных заболеваний, основанный на замене «больного» гена (ответственного за заболевание) геном «здоровым». Целью генной терапии является внесение изменений в генетический аппарат клеток человека в целях лечения конкретных заболеваний.
В частности, открыты новейшие технологии, позволяющие участвовать в направленном мутагенезе, а в 2013 г. разработаны высокоизбирательные методы активирования и ингибирования генов с помощью системы CRISPR/Cas9, которые дают возможность исправлять неправильные последовательности генов и таким образом лечить наследственные заболевания человека.
CRISPR/Cas9 — это уникальная технология изменения геномов, в основе которой лежит собственная иммунная защита бактерий. Эта система основывается на особых участках бактериальной ДНК. Вирус, проникая в клетку бактерии, тут же обнаруживается с помощью специальных Cas-белков, связанных с CRISPR РНК. Если фрагмент вируса «записан» в бактериальной CRISPR РНК, Cas-белки разрезают вирусную ДНК и уничтожают ее, защищая клетку от инфекции.[9]
Для исправления «дефектного» гена, необходим очень точный «молекулярный скальпель», который отыщет мутантную последовательность нуклеотидов и вырежет ее из ДНК. Этим «скальпелем» и является Cas9. Используя гид РНК, последовательность нуклеотидов которого комплиментарна искомому месту, производят разрез в нужном месте генома. Узнавание «мишени» осуществляется на участке ДНК длиной в 20–30 нуклеотидов. Участки ДНК этой длины встречаются в геноме человека не более одного раза, поэтому использование этой технологии позволяет с наибольшей точностью произвести замену дефекта. Клетка не погибнет от внесения разрыва в молекулу ДНК, т.к. в работу включатся системы репарации, достроив вторую цепь ДНК, на основе первой.
Открытие этого метода дало основание ученым утверждать, что в ближайшем будущем для любого генетика не составит труда вырезать, удалять и встраивать новые гены в матрицу ДНК, исцеляя генетические заболевания, изменяя человеческие качества и их потенции (лидерство, способность к познанию, творческий потенциал и т.д.)
По мнению И.В. Силуяновой, решение проблем, связанных с вмешательством в генетический аппарат живых существ, способствовало формированию внутри биоэтики двух подходов, которые условно можно назвать «либеральным» и «консервативным».[1]
Главным аргументом «либералов» в этой полемике является рассмотрение данного метода как потенциально универсального подхода к лечению широкого спектра заболеваний. В первую очередь с помощью CRISPR/Cas9 мы сможем лечить «простые», моногенные генетические заболевания: гемофилию, муковисцидоз, лейкемию; вирусные (в том числе ВИЧ-инфекции и герпесвирусных инфекций); аллергии и иммунологические заболевания (в том числе аутоиммунные), онкологические, сердечно-сосудистые заболевания и даже ревматизм, а также наследственных расстройств — таких, как синдром Дауна, серповидно-клеточная анемия и β-талассемия.
Консерваторы, в свою очередь, озабочены тем, что генетик может взять на себя роль своеобразного «бога» и попытается вмешаться в действия законов природы.
Во-вторых, учитывая концепцию евгеники (гены имеют решающее значение в процессе формирования человека), существуют опасения по поводу существования одобренных правительствами программ «улучшения расы» и использования медицинских технологий в немедицинских целях.[3] Другими словами, основными критериями генотерапии являются уважение личности человека, его автономии и соблюдение принципа невмешательства в его частную жизнь.
В-третьих, технология нуждается в совершенствовании, она недостаточно точная. В 2015 году китайские ученые предприняли попытку исправить геном человеческого эмбриона. В результате эксперимента в 5–10% эмбрионов мутация, ответственная за возникновение β-талассемии у взрослых людей, действительно была исправлена, однако во всех клетках пролеченных эмбрионов возникло большое количество непредвиденных мутаций.[10]
Именно поэтому по-прежнему сохраняется значительная напряженность в отношении эффективности генной терапии, возможности развития негативных последствий. Различные «этические комитеты» безустанно поднимают эту проблему, пытаясь найти «идеальные» условия, при которых это возможно реализовать. В основном на первое место выдвигаются такие параметры, как:
1) Доказательство того, что ген, принесенный в клетку-мишень будет достаточное время функционировать, не теряю свою эффективность.
2) Нужна абсолютная гарантия того, что этот ген не повлечёт за собой неблагоприятные последствия.
Несмотря на кажущуюся простоту, указанные условия не могут быть достаточно конкретизированы, чтобы стать универсальным правилом. Для каждого случая применения этой технологии придется определять, какие сроки сохранения эффективности гена будут считаться достаточными, каков может быть потенциальный риск для пациента, и как он будет соотноситься с предполагаемым положительным лечебным эффектом.[6]
Д. Нейсбит также отмечает, что использование генетической информации страховыми компаниями приводит к отказу от оказания медицинской помощи в ряде случаев. Основанием здесь служит генетическая предрасположенность к некоторым заболеваниям, которая присутствует у человека с рождения.[2]
Поэтому на сегодняшний день существует множество морально-этических норм и требований к генетическим технологиям и методам, которые закреплены в ряде международных этико-правовых документов, а также в законодательстве РФ.
Главным документом в этой области является «Конвенция о биомедицине и правах человека» 2005 года, в которой отражены основные принципы регулирования генетических исследований, генной инженерии и терапии. Так, статья 13 «Конвенции» гласит: «Вмешательство в геном человека, направленное на его модификацию, может быть осуществлено только в профилактических, терапевтических или диагностических целях и только при условии, что подобное вмешательство не направлено на изменение генома наследников данного человека».
Существует большое количество иных международных документов, относящихся к этой сфере: «Всеобщая декларация о геноме человека и правах человека» (ЮНЕСКО, 1997), «Всеобщая декларация о биоэтике и правах человека» (ЮНЕСКО, 2005), «Декларация о клонировании человека» (ООН, 2005) и другие.
В нашей стране основные аспекты этико-правового регулирования генной инженерии и генной терапии отражены в Федеральном законе «О государственном регулировании в области генно-инженерной деятельности» от 05.07.1996 N 86-ФЗ (действующая редакция, 2016). В нем говорится, что одним из основных направлений в области государственного регулирования генно-инженерной деятельности является улучшение условий жизни человека и охрана его здоровья, а также определяется ответственность за нанесенный человеку и окружающей среде вред.
Резюмируя все вышесказанное, можно сделать вывод, что технология CRISPR/Cas9 может быть весьма перспективной в лечении многих заболеваний. Но нельзя забывать, что сами методы диагностики этих заболеваний еще не совершенны. Так многие заболевания кодируются не одним геном, а сотнями и тысячами генов, и идентификация этих генов также требует высокой точности, чего сегодня еще не смогли добиться.
Диагностика многих генетических заболеваний затруднена вследствие того, что гены, отвечающие за возникновение этих заболеваний, являются рецессивными и фенотипически не проявляются. Поэтому, на данный момент, на первое место нам необходимо поставить разработку методов диагностики, а уже потом внедрять методы генотерапии.[8]
Не стоит забывать и о правовом регулировании данной сферы деятельности. Вмешательство в геном человека, прежде всего, должно быть безопасным как для него, так и для окружающей среды. Важную роль в вопросах правового регулирования должны играть как государство, так и международные научные сообщества. Направленность генетических исследований, методы генной инженерии и терапии должны сопоставляться с морально-этическими принципами и нормами современных биотехнологий.
Литература
3. Жарова М.Н. Этические проблемы современных генетических технологий// RELGA №11 [209] 01.08.2010.
4. Шумская Е.И. Социально-этические и правовые проблемы в медицинской генетике// Личность в меняющемся мире: здоровье, адаптация, развитие. №3 (10), 2015.
5. Моров А.В. Природно-генетическая основа лидерства и биоэтика III тысячелетия.// Современные проблемы науки и образования №1-2, 2015.
6. Салмина А.Б., Шнайдер Н.А. Этические вопросы новых медицинских технологий.// Сибирское медицинское обозрение. №3, том 40, 2006.
7. Мамедова Н.Д., Нуржанова А.Б., Табачкова О.А., Живайкина А.А. Постчеловек: иллюзия или реальность? // Бюллетень медицинских интернет-конференций. – 2013. – Т. 3. – № 2. – С. 399.
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 4. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 8. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
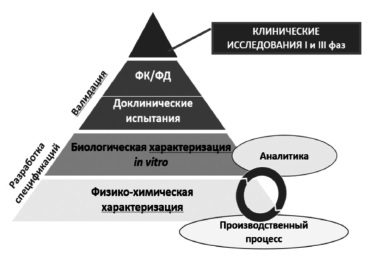
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 19 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.