Генная терапия что это такое и последствия
Генная терапия что это такое и последствия
Препарат Zolgensma был разработан швейцарской фармацевтической компанией Novartis. Он применяется одноразово и стоит 2 млн долларов. Врачи считают, что лекарство может дать начало массовому применению генной терапии: только за первые три месяца 2019 года было зарегистрировано 372 новых клинических испытания генно-терапевтических препаратов.
Для многих наследственных заболеваний нет эффективного лечения, существующие препараты помогают облегчить жизнь пациентов. Причиной таких заболеваний являются изменения генетического материала – мутации. В результате мутаций с гена синтезируется либо изменённый белок, который не может правильно выполнять свою функцию, либо белок не синтезируется вовсе. Для полного излечения пациентов необходимо исправить в их клетках мутации. Задачу немного упрощает тот факт, что для многих наследственных заболеваний неработающий белок оказывается критически важен только в одном месте организма. Поэтому достаточно исправить ген только в этом органе или ткани.
Генно-терапевтический подход к лечению наследственных заболеваний разрабатывается уже 40 лет. Основная технология генной терапии основана на замещении гена с мутацией правильно функционирующей копией этого гена. Но есть еще две стратегии: выключение неправильно работающего гена и введение нового гена, который поможет организму победить заболевание.
Надо подчеркнуть принципиальное отличие генной терапии от редактирования генома, которое сейчас тоже активно разрабатывается для лечения наследственных заболеваний. Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента.
В зависимости от цели генная терапия бывает соматической и фетальной. В первом случае вирус с геном вводят в клетки тела, во втором – в эмбрион на ранней стадии развития. В результате фетальной генной терапии генетический материал попадает во все клетки и может быть передан детям.
В ходе клинических испытаний препарат Zolgensma показал хорошие результаты у пациентов со спинальной мышечной атрофией: из 21 пациентов 19 смогли начать двигать головой и самостоятельно сидеть.
Препараты генной терапии могут стать эффективным средством лечения многих наследственных заболеваний, для которых не существовало лечения до этого. Так, в ближайшее время ожидает одобрения международного регулятора еще один новый генно-терапевтический препарат для лечения талассемии и серповидноклеточной анемии. Оба этих заболевания связаны с мутациями, результатом которых является синтез неправильно работающего гемоглобина – белка, переносящего кислород в крови.
Прежде всего, препараты генной терапии разрабатываются для заболеваний, причиной которых является одна в мутация в одном гене. Таких болезней 10 000. В связи с большими затратами на разработку генно-терапевтических препаратов, они очень дорогие. Но постепенно отработка технологии позволит значительно снизить стоимость таких лекарств и сделать их доступными большинству пациентов.
Генная терапия что это такое и последствия
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
Генная терапия — метод лечения заболеваний, основанный на переносе в клетки организма определённых генов. Основная проблема генной терапии — разработка эффективного и безопасного способа переноса необходимых генов в дефектные клетки организма. В качестве «средств доставки» генов используют различные векторы, наиболее часто — различные вирусы (см. ниже). В настоящее время разработки генной терапии касаются только соматических клеток.
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
В 1992 г. в США осуществили введение в клетки печени человека гена белка-рецептора, адсорбирующего липопротеины низкой плотности в гепатоциты женщины, страдающей выраженным атеросклерозом (патология была связана с дефицитом липопротеинов вследствие генных нарушений). Посредством трансфекции ген был введён в гомогенизированные клетки печени, которые затем переносили в печень пациентки. После такой процедуры состояние женщины улучшилось, хотя до пересадки «генно-инженерной печени» она перенесла инфаркт (в 16 лет) и операцию на сердце (в 26 лет).
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Просто о сложном: как работает генная терапия и что она лечит
Natalia Kudryavtseva
Порядка двухсот миллионов жителей планеты являются потенциальными кандидатами для генной терапии, а несколько тысяч уже стали пациентами-пионерами и в рамках испытаний получили лечение от ранее неизлечимых заболеваний. Кандидат медицинских наук, врач-терапевт Лаборатории регенеративной медицины Медицинского центра МГУ, старший научный сотрудник Факультета фундаментальной медицины МГУ, победитель «Научных боев» Политеха — 2015 Павел Макаревич объяснил T&P, как работает генная терапия и с какими проблемами сталкиваются ученые, разрабатывая этот принципиально другой метод лечения многих серьезных болезней.
Павел Макаревич
200 миллионов потенциальных кандидатов — это очень много. До половины случаев, в которых помогает генная терапия, это наследственные заболевания: гемофилия, иммунодефициты, болезни накопления, энзимопатия, 25–30% случаев — это онкологические заболевания, оставшиеся 20% — все остальное: кардиология, неврология, болезни нервной системы и даже травмы, например повреждения нерва или другие, более тяжелые случаи. Такое распределение связано с тем, что наследственные заболевания протекают крайне тяжело и зачастую имеют летальный исход, и там нет другого лечения в принципе, за исключением генной терапии.
В качестве лечебного действующего вещества в генной терапии используется генетическая информация, а точнее молекулы, которые ее несут: нуклеиновые кислоты РНК (реже) и ДНК (чаще). В каждой клетке есть «ксерокс» — экспрессионный аппарат — механизм, с помощью которого клетка переводит генетическую информацию в белки, позволяющие ей правильно функционировать. То состояние, когда есть правильный ген и хорошо работающий «ксерокс» (который вообще-то должен работать всегда, иначе такая клетка нежизнеспособна), с точки зрения генной терапии можно условно назвать здоровьем клетки. В любой клетке есть полная библиотека этих оригиналов — генов, которые клетка использует для правильной экспрессии белков и нормального функционирования. При патологии возможны самые различные ситуации. Например, когда по причине потерян важный оригинал (ген) или большая его часть и восстановить такую потерю уже невозможно. В такой ситуации развиваются такие заболевания, как, например, миодистрофия Дюшенна, которая приводит к прогрессивному параличу всех мышц тела и заканчивается смертью в 25–27 лет — как правило, от остановки дыхания.
Другой пример — небольшая «поломка», не такая фатальная, но тем не менее приводящая к тому, что этот белок не работает — не выполняет своей биологической функции. И если это, например, VIII фактор свертывания крови, то у человека развивается гемофилия. В обеих этих ситуациях наша задача — доставить в ткань «нормальную», рабочую копию гена, то есть как бы подложить в этот «ксерокс» правильный оригинал, чтобы наладить работу клетки и, может быть, целого организма, продлевая таким образом ему жизнь. Работает ли это? Да, такие подходы эффективны в экспериментах на животных и уже проходят стадии клинических испытаний на пациентах, хотя следует признать, что трудностей на пути хватает.
Мы также разрабатываем подходы для лечения ишемических заболеваний, которые гораздо более распространены, чем наследственная патология, хотя, несомненно, для них существует и множество других способов лечения. Дело в том, что каждый человек, который болеет ишемической болезнью сердца или конечностей, рано или поздно оказывается в состоянии, когда единственным способом лечения для него может оказаться генная терапия.
С помощью генной терапии лечится большая группа заболеваний, связанных с поражением центральной нервной системы, — болезнь Паркинсона, Альцгеймер, боковой амиотрофический склероз. Существуют вирусы, которые имеют склонность атаковать центральную нервную систему, и это свойство можно использовать во благо. Например, вирус герпеса живет в нервах, и с его помощью в нервную систему можно доставлять факторы роста и цитокины, которые замедляют развитие этих заболеваний. Это как раз пример того, когда вирус, вызывающий заболевание, редактируется, лишается белков, отвечающих за его патогенное действие, и используется как кассета, а факторы роста защищают нейроны от гибели, которая происходит при этих заболеваниях и становится причиной гибели больного. Таким образом получается, что вирусы, несущие гены факторов роста, замедляют прогресс болезни и продлевают жизнь пациента.
Или, например, слепота — состояние, которое полностью лишает человека зрительных образов на всю жизнь. Одна из причин слепоты — так называемая врожденная атрофия Лебера, которая развивается из-за мутации в гене RPE 65. В мире сейчас уже около 80 людей обрели минимальные зрительные возможности благодаря генной терапии — модифицированному аденовирусу, который доставил «рабочий» RPE 65 в ткани глаза и повысил его чувствительность к свету.
Как мы доставляем генетическую информацию в ткани: локально, в конкретный орган, или сразу в весь организм? Есть два варианта. Первый — это плазмида, то есть кольцевая молекула ДНК. Она супер спирализуется, становится очень маленькой и компактной, и мы «упаковываем» ее в химический полимер, чтобы облегчить ее проникновение в клетку. В чем здесь проблема? Плазмидная ДНК через 12–14 дней будет удалена из клетки, и продукция белка остановится. В такой ситуации мы можем предпринять два решения: первое — ввести дополнительную дозу плазмидной ДНК (благо она не иммуногенна), второе — ввести туда сразу несколько генов (например, для усиления эффектов цитокинов на регенерацию ткани), чтобы увеличить силу действия в тот короткий период времени, в течение которого будет идти продукция белков.
Получается, что у нас есть два очень мощных способа доставки гена, и вирус явно выглядит более предпочтительным, потому что он сам может находить свои мишени в организме: например, вирус гепатита найдет печень, а вирус герпеса — нейроны. Плазмида, кольцевая ДНК, работает только там, куда ее ввели. Возникает вопрос: почему мы до сих пор вообще пользуемся плазмидами, если есть вирусы? Ответ такой: вирусы иммуногенны, они вызывают иммунный ответ. И, как вариант, они могут быть либо уничтожены иммунной системой до того, как успеют сработать, либо, как худший вариант, они могут вызывать побочные действия — мощные иммунные реакции на введение вируса. Получается очень хрупкий баланс между эффективностью и безопасностью, который определяет судьбу препаратов, которые мы разрабатываем, и, если препарат показал себя небезопасным на этапе разработки, это тупик.
Чтобы разработать, получить и протестировать новый препарат для генной терапии, лаборатория или даже целый институт должны работать несколько лет. Это, мягко говоря, недешево, пока это штучное производство, и протоколы, если они не спонсируются разработчиком, очень дорогие. Есть два или три препарата, зарегистрированных в Европе, один в Японии, в России пока только один — «Неоваскулген», препарат для стимуляции роста сосудов.
Препараты, которые используются для генной терапии, имеют не изученную ранее фармакокинетику, фармакодинамику. Вся проблема в том, что на данный момент об этом накоплено очень мало информации по сравнению с тем, сколько ее вокруг обычных препаратов. Это означает, что все риски, связанные с генной терапией, теоретически должны учитываться при разработках. Допустим, мы знаем, что не нужно испытывать тысячекратную дозу аспирина на практике, и мы этого не делаем. В отношении генной терапии, поскольку мы пока не знаем фармакокинетику (а значит, и многих особенностей действия препаратов), мы должны учитывать все существующие возможные эффекты, и это сильно растягивает исследование во времени.
Вторая проблема заключается в том, что каждый препарат имеет свой уникальный тип действия. Это означает, что нужно доказывать его безопасность и эффективность на уникальных моделях, а это тоже растягивает период, после которого можно сказать: «Да, лекарство может быть выведено в клинику или на рынок, и это безопасно». Поэтому я считаю, что это во многом вопрос времени и опыта человечества в этой области, который, как и в любом drug-девелопменте, будет накапливаться ценой больших проблем: остановленных исследований, побочных эффектов. Но я также знаю, что это вопрос затраченных усилий сотен исследователей и потенциальный способ помочь миллионам людей. В настоящее время уже накоплен опыт и извлечены некоторые уроки, которые помогают идти дальше.
Курс лечения за €1 млн: как появилась, с чем борется и сколько стоит генная терапия Статьи редакции
История генной инженерии и обзор её методов.
Каждый из живых организмов на Земле носит в клетках наследственный материал своих предков. Эти данные называются геномами, и они нужны непосредственно для создания и поддержания деятельности организма.
Свой геном есть у банана, свиньи и тутового дерева. Геном человека состоит из 23 пар хромосом в ядре клетки и митохондриальной ДНК. А хромосомы представляют собой сложный комплекс ДНК (дезоксирибонуклеиновая кислота) и белков.
ДНК имеет двухцепочечную структуру, где каждая цепь — последовательность нуклеотидов: цитозина, гуанина, аденина, тимина. Она обеспечивает сохранение и передачу генетической информации от клетки к клетке и регуляцию всех процессов в ней.
Молекула ДНК хранит биологическую информацию в виде генов. Белки обеспечивают основную работу внутри клетки, например, поддерживают метаболизм или реализуют её деление.
Генная инженерия (ГИ) работает над изменением наследственной информации. При помощи разных методов и инструментов она работает с генами и вводит их в другие организмы.
Методы ГИ работают точнее и быстрее:
Возможности инженерии позволяют вводить конкретный ген, ответственный за тот или иной признак, в другой организм, что повышает эффективность метода.
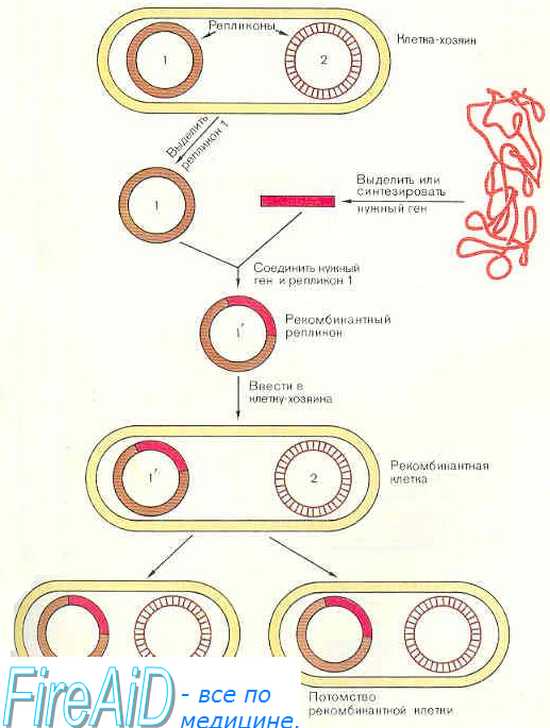
Генная инженерия появилась в 1970-х годах. В 1972 году команда стэнфордского учёного Пола Берга впервые провела сплайсинг генов — сшила фрагменты ДНК разного происхождения, получив рекомбинантную ДНК: в её состав вошли участки геномов онкогенного вируса SV40 и бактериофага (вируса, способного уничтожать бактерии).
Эксперименты вызвали опасения учёных относительно безопасности введения такой ДНК в клетки живых организмов, поэтому исследования остановили ещё до испытаний в естественных условиях.
В 1973 году команда учёных под руководством Герберт Бойера и Стэнли Коэна сообщила о первом в мире организме (Escherichia coli, или кишечная палочка), полученном с помощью рекомбинантной ДНК. Исследования показали, что ген определённого организма можно с помощью особых ферментов вставить в иное генетическое окружение.
Через два года состоялась международная встреча по проблеме рекомбинантных ДНК, организованная Полом Бергом, чтобы обсудить потенциальные опасности и регулирование биотехнологии. Группа из 140 биологов, юристов и врачей приняла участие в конференции — для разработки принципов безопасности при работе с рекомбинантной ДНК.
Спустя годы конференция вместе с публичными дебатами по этой проблеме увеличила общественный интерес к биомедицинским исследованиям и молекулярной генетике.
В 1977 году Фредерик Сенгер разработал метод секвенирования ДНК, который позволял установить последовательность нуклеотидов — веществ, составляющих ДНК.
За год до этого Роберт Свонсон и Герберт Бойер основали компанию Genentech, которая через несколько лет в сотрудничестве с университетскими коллективами получила первые в мире генно-инженерные лекарства: человеческие инсулин и гормон роста.
В 1990 году официально стартовал проект «Геном человека», координируемый Министерством энергетики и Национальными институтами здравоохранения США.
Цель проекта — определить последовательности из 3 млрд пар химических оснований, составляющих ДНК человека, и выявить приблизительно 20–25 тысяч генов, чтобы открыть новые пути к успехам в медицине и биотехнологии.
Первоначально планировалось, что проект продлится 15 лет, но технический прогресс ускорил дату завершения до 2003 года.
Производство высококачественной «готовой» последовательности, которая охватывает 95% генома с точностью 99,99%, — трудоёмкий процесс с высокими затратами. С тех пор стоимость секвенирования значительно снизилась и упростилась.
В современной биологии направленная генная инженерия (НГИ) представлена как одна из лидирующих отраслей в фундаментальных и прикладных исследованиях. Первым методом, который показал весь потенциал НГИ, стал Zinc Finger Nuclease (ZFN) в 1996 году, или «цинковые пальцы». Это белковые домены, по форме напоминающие палец.
«Цинковые пальцы» встречаются и в составе человеческих белков. Благодаря этому методу можно сконструировать цепь ZFN так, что она будет узнавать определённый участок ДНК. Это даёт возможность точечного воздействия на заданные участки в составе сложных геномов.
Однако метод имеет серьёзные недостатки: это долгий, трудоёмкий и дорогой процесс, также он может вызвать множественные дополнительные мутации в ДНК. Только несколько специализированных лабораторий смогли сконструировать свои собственные ZFN, при этом коммерчески доступные «цинковые пальцы» относительно дорогостоящие.
В 2011 году журнал Nature Methods назвал систему TALEN (Transcription Activator-like Effector Nucleases) «методом года» благодаря широкому спектру возможных применений в разных областях фундаментальной и прикладной науки.
Роль ДНК-распознающих структур в TALEN играют белковые домены, каждый из которых «узнаёт» только один нуклеотид. Такой механизм «узнавания» ДНК гораздо проще, и получение конструкции, необходимой для редактирования последовательности, становится более эффективным.
С помощью искусственных нуклеаз TALEN оказалось теоретически возможным внести двунитевой разрыв в любой участок ДНК. Такой подход позволяет восстанавливать последовательности ДНК, удалять, добавлять части гена или целые гены.
Проблемами этого метода всё так же остаются дороговизна и трудоёмкость процесса. Однако некоторые исследования указывают на большой терапевтический потенциал TALEN для лечения вируса папилломы человека и связанного с ней рака шейки матки.
В 2013 году в НГИ разработали ещё один метод: CRISPR/Cas. Он открыл новые возможности для манипуляций на уровне генома высших организмов. Несмотря на то, что все три вышеописанных метода сопоставимы по многим параметрам, CRISPR/Cas благодаря своей простоте оставил конкурентов позади.
Метод обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
В основе этой системы — особые участки бактериальной ДНК — CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, или короткие палиндромные кластерные повторы). Разделяют эти повторы спейсеры — короткие фрагменты чужеродной ДНК. Последние встраиваются в геном после того, как ДНК рекомбинирует с её геномом.
Основная проблема технологии в том, что при использовании появляются незапланированные ошибки, приводящие к появлению нежелательных мутаций. Например, белки Cas9 редактируют ДНК в неожиданных местах. Для широкого внедрения метода в медицинскую практику вопрос должен быть подробно исследован.
Генная терапия — совокупность биомедицинских технологий лечения дефектов генов с помощью введения в организм генетических конструкций, способных восстановить или заменить дефектный ген, экспрессировать полноценный генный продукт или блокировать работу мутантных и чужеродных генов.
Генная терапия (ГТ) может работать по нескольким механизмам:
Для внедрения в клетки новых генов в ГИ применяются векторы — молекулы ДНК, используемые как «транспортное средство» для искусственного переноса генетической информации.
Например, вирусы обладают естественной способностью доставлять генетический материал в клетки и могут использоваться в качестве векторов. Прежде чем использовать вирус для переноса терапевтических генов в клетки, его модифицируют, чтобы устранить способность вызывать заболевания.
Но они не подходят для системной доставки и применяются только для локального введения в небольшой участок ткани. Кроме того, они могут вызывать побочные эффекты из-за встраивания в нежелательные места генома.
Использование технологии CRISPR/Cas9 в генной терапии позволяет точно изменять ДНК клеток. Если совместить CRISPR/Cas9 с доставкой при помощи «векторов», это позволит системно воздействовать на организм и изменять геном большого числа клеток.
Генная терапия может быть использована для модификации клеток внутри или вне организма. Когда это делается внутри тела, врач вводит несущий ген в ту его часть, которая имеет дефектные клетки. Для модификации клеток вне организма кровь, костный мозг или другую ткань можно взять у пациента, а конкретные типы клеток можно выделить в лаборатории.
Новый ген вводится в эти клетки. Клетки оставляют для размножения в лаборатории, а позже вводят обратно пациенту, где они размножаются дальше и в конечном счёте дают желаемый эффект. Заменённые работающие клетки излечат человека. Но это не помешает их детям наследовать исходный дефектный ген.
Чтобы гарантировать, что будущие поколения семьи пациента не будут затронуты генетическим заболеваниями, его половые клетки должны пройти генную терапию. Но в связи с этическими вопросами сейчас перспектива отдалённая.
Генная терапия имеет свои риски. Например, если гены внедряются в неправильном месте генома, они могут создать вредные мутации и инициировать развитие опухоли. К основным проблемам относят иммунный ответ организма, влияние на работу других генов и стоимость.
Первый препарат для генной терапии в Европе Glybera одобрили ещё в 2012 году, но власти Германии дали окончательное разрешение на продажу лишь к 2015 году. Glybera лечит дефицит липопротеинлипазы, болезнь, вызывающую накопление жира в крови, что приводит к сердечно-сосудистым заболеваниям, диабету и приступам панкреатита.
Компания установила розничную цену в €53 тысячи за ампулу. Курс лечения для одного пациента стоил более €1 млн, что сделало его самым дорогим лекарством в мире в то время. С 2012 года всего один пациент прошёл курс лечения этим препаратом. В апреле 2017 года компания UniQure, владеющая Glybera, объявила, что не будет продлевать разрешения на продажи.
Большинство препаратов ГТ создаётся для онкобольных. До 2023 года эта ниша сохранит первенство на рынке. Одна из лидеров отрасли — компания Amgen. Она имеет 37 препаратов в стадии клинических испытаний, 20 из них относятся к лечению опухолей и заболеваний крови. За лекарствами от рака следуют препараты от сердечно-сосудистых заболеваний и инфекций.
Материал написан при поддержке сотрудников лаборатории геномики Института молекулярной и клеточной биологии и Института цитологии и генетики СО РАН.
Комментарий удален по просьбе пользователя
Комментарий удален по просьбе пользователя
уверен, что будут. на масмаркете больше денег, чем в премиуме.
Однако, это не помогло ни Стиву Джобсу, ни Цукербергу, ни Медведеву
Стив Джобс сам отказался от лечения, ему и обычная химиотерапия помогла бы
Комментарий удален по просьбе пользователя
но сначала он морковкой лечился вроде
Зато Путину помогло
https://vk.com/wall-35598590_63556
На фоне последних событий в области генетики иногда кажется, что геном человека — это нечто вроде конструктора, система, свободно открытая к изменениям без какой-либо защиты собственной стабильности. Новое исследование вносит коррективы в эту точку зрения.
После открытия CRISPR, технологии по редактированию генов, казалось, что сейчас она изменит в медицине все, а ученые и врачи смогут без проблем менять геном, излечивая все виды генетических заболеваний без особых проблем с помощью простой неинвазивной процедуры. Таков был план, но CRISPR — это довольно сложная процедура, а при испытании на людях она и вовсе требует сложной инженерии. А тут еще ученые из Стэнфорда выяснили, что большинство людей могут иметь к CRISPR врожденный иммунитет.
Результаты пока находятся в стадии препринта, а значит, они еще не отрецензированы и не опубликованы в журнале, но сама статья уже привлекла огромное внимание экспертов в вопросах генетики.
Часть системы CRISPR происходит от бактерий. Конечно, CRISPR был модифицирован, но в основе своей он по-прежнему сохраняет бактериальную основу. А значит наша иммунная система может на него реагировать и атаковать.
В центре проблемы белок Cas9, именно он таргетирует и вырезает определенные отрезки ДНК. Без Cas9 CRISPR работать не будет, но именно с этим белком наши тела могут сражаться. Cas9 обычно находится во вредоносных бактериях, вроде Staphylococcus aureus и Streptococcus pyogenes, которые соответственно вызывают стафилококковые и стрептококковые инфекции, и обычно это хорошо, что наши тела блокируют его действие.
То есть при реакции человеческой иммунной системы все модификации с генами, сделанные с помощи CRISPR, могут просто не сработать. Существуют уже несколько трюков, которые исследователи используют для обхода иммунных реакций. Например, использовать CRISPR только вне тела или в местах, которые иммунные клетки достичь не могут. Тем не менее, возможно ученым придется заменить Cas9 на другой протеин, не активирующий иммунные системы организма. И если так будет, все исследования подобного рода будут отброшены на несколько лет назад.