Что во что превращается химия
ПРЕВРАЩЕНИЯ ВЕЩЕСТВ
Полезное
Смотреть что такое «ПРЕВРАЩЕНИЯ ВЕЩЕСТВ» в других словарях:
Обмен веществ — или метаболизм, лежащий в основе жизни закономерный порядок превращения веществ и энергии в живых системах, направленный на их сохранение и самовоспроизведение; совокупность всех химических реакций, протекающих в организме. Ф. Энгельс,… … Большая советская энциклопедия
Обмен веществ и энергии — (у микробов) одно из кардинальных св в у всех организмов, выражающееся в совокупности процессов превращения веществ и энергии, направленных на сохранение и воспроизведение жизни. О. в. э. у микробов принципиально сходен с таковым у высших… … Словарь микробиологии
Обмен веществ — см. Метаболизм. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989. Обмен веществ превращения веществ (и энергии) в организмах, обеспечивающие их жизнеспособнос … Экологический словарь
обмен веществ и энергии — (син. метаболизм) совокупность процессов превращения веществ и энергии в живом организме и обмена организма веществами и энергией с окружающей средой … Большой медицинский словарь
Обмен веществ — и энергии – совокупность процессов превращения веществ и энергии в животном организме и их обмена с окружающей средой; рассматривается по составляющим компонентам: белковый, липидный, углеводный, энергетический, водно солевой, витаминный … Словарь терминов по физиологии сельскохозяйственных животных
Круговорот веществ — на Земле, повторяющиеся процессы превращения и перемещения вещества в природе, имеющие более или менее выраженный циклический характер. Эти процессы имеют определённое поступательное движение, т. к. при так называемых циклических… … Большая советская энциклопедия
ОБМЕН ВЕЩЕСТВ — метаболизм, совокупность протекающих в живых организмах химич. превращений, обеспечивающих их рост, жизнедеятельность, воспроизведение, постоянный контакт и обмен с окружающей средой. Благодаря О. в. происходит расщепление и синтез молекул,… … Биологический энциклопедический словарь
Обмен веществ в растении — Этим выражением (представляющим перевод немецкого термина Stoffwechsel английские физиологи заменяют его термином метаболизм) обозначают совокупность превращений вещества, обуславливающих жизненную деятельность организма. Следует, прежде всего,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
круговорот веществ — на Земле, повторяющиеся процессы превращения и перемещения вещества в природе, имеющие более или менее циклический характер. Общий круговорот веществ складывается из отдельных процессов (круговорот воды, газов, химических элементов), которые не… … Энциклопедический словарь
КРУГОВОРОТ ВЕЩЕСТВ — в природе, относительно повторяющиеся взаимосвязанные физические, химические и биологические процессы превращения и перемещения вещества в природе. До создания В. И. Вернадским биогеохимии и учения о биосфере в науке бытовало представление о… … Биологический энциклопедический словарь
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ПРЕВРАЩЕНИЯ ВЕЩЕСТВ
ПРЕВРАЩЕНИЯ ВЕЩЕСТВ. Вещества могут претерпевать два типа превращений: физические и химические.
Физические превращения.
Когда с веществом происходит физическое изменение, состав его молекул остается прежним, т.е. вещество сохраняет свою химическую индивидуальность. Существует три типа основных физических превращений – плавление, испарение и замерзание. Лед – твердое вещество – при плавлении превращается в воду – жидкость, которая при замерзании снова становится льдом. Молекулы льда и воды состоят из одних и тех же элементов (H и O), находящихся в одинаковых пропорциях. Когда лед тает, никаких химических реакций не происходит. Другой тип физических превращений – изменение формы вещества, например при его резании, шлифовании, измельчении, растворении, эмульгировании и т.д. Еще один тип физического превращения – сублимация (возгонка), переход твердого вещества непосредственно в газообразное. Именно это превращение имеет место, когда мокрое белье сохнет на морозе.
Химические превращения
происходят постоянно и повсюду; при этом изменяется химическая индивидуальность веществ, одни вещества превращаются в другие с иными свойствами. Так, при ржавлении железа образуется новое вещество – ржавчина (оксид железа). Химические превращения могут сопровождаться физическими изменениями. При горении древесины (твердое вещество) образуются диоксид углерода (газ), вода (жидкость) и углерод (твердое вещество). Химические превращения чрезвычайно многообразны, их изучением и классификацией занимается наука химия. Вот некоторые типы превращений, принятые в химии.
Реакции присоединения.
Объединение молекул двух или нескольких веществ с образованием молекулы одного нового вещества. Примером служит горение магния на воздухе: 2Mg + O2 ® 2MgO.
В органической химии этим термином часто пользуются для обозначения таких реакций, как взаимодействие этилена С2H4 с бромом с образованием дибромэтана:
Реакции разложения.
Распад исходного вещества на два или более простых. Так, при разложении оксида ртути образуются элементная ртуть и кислород: 2HgO ® 2Hg + O2.
Реакции замещения.
Замена атомов в молекулах сложного вещества атомами простого вещества. Например, железо замещает медь в растворе сульфата меди:
Реакции обмена.
Образование двух новых веществ при взаимодействии двух исходных. Например, иодид натрия NaI и нитрат свинца Pb(NO3)2 обмениваются своими составными частями с образованием иодида свинца и нитрата натрия:
Атом хлора обменивается с одним или более атомами водорода в молекуле углеводорода, например метана СН4, следующим образом:
Реакция гидролиза.
Гидролиз (расщепление с участием воды) – это реакция двойного разложения, когда одним из исходных компонентов является вода. При гидролизе хлорида аммония NH4Cl образуется гидроксид аммония NH4OH и соляная кислота HCl:
Реакция нейтрализации.
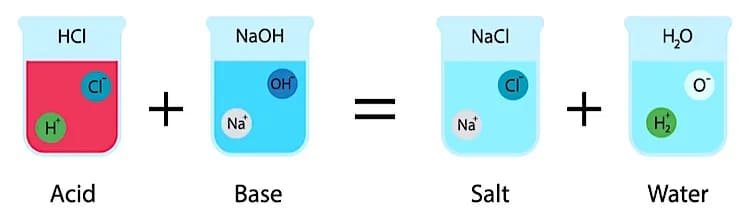
Особый случай реакции обмена – взаимодействие кислоты с эквивалентным количеством основания с образованием соли и воды. Соляная кислота HCl и гидроксид натрия NaOH нейтрализуют друг друга с образованием хлорида натрия NaCl и воды:
HCl + NaOH ® NaCl + H2O
Ма Ш. Современная теория критических явлений. М., 1980
Дикерсон Р. и др. Основные законы химии. М., 1982
11 лучших примеров химических изменений в повседневной жизни
Химические изменения происходят в результате химических реакций. В ходе химической реакции происходит перегруппировка атомов, и реакция сопровождается изменением энергии, поскольку образуются новые вещества.
Хотя существуют сотни тысяч различных химических реакций, большинство из них имеют схожие свойства. Эти сходства позволяют нам разделить химические изменения на три широкие категории.
Чтобы объяснить этот процесс более подробно, мы перечислили несколько наиболее распространенных примеров химических изменений, которые вы видите в повседневной жизни.
11. Выпечка торта
Тип: неорганическое изменение
Когда вы печете пирог, его ингредиенты (мука, яйцо, сахар, пекарский порошок и т.д.) претерпевают химические изменения. Это происходит в процессе выпечки:
Поскольку этот процесс выпечки требует тепла, это эндотермическая реакция. Она не может быть обращена вспять, поскольку сахар и дрожжи создали новые вещества. Это означает, что после выпечки пирога вы не сможете разделить его на исходные компоненты (муку, яйца, сахар).
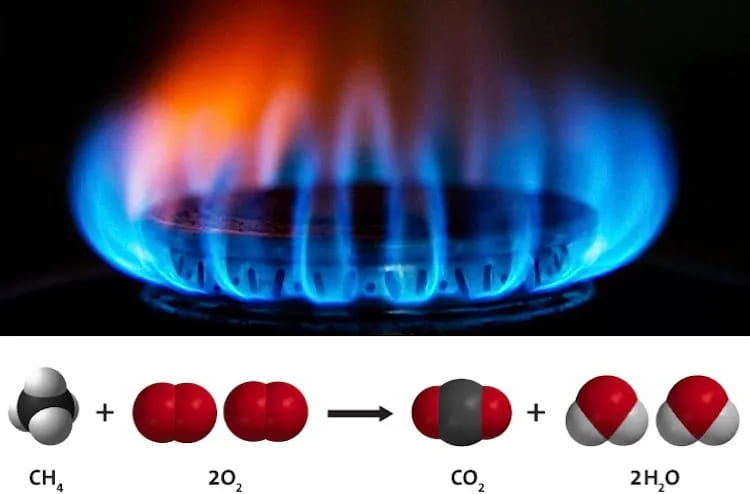
10. Сжигание природного газа
Тип: Органическое изменение
Тип: Неорганические изменения
Точнее, высокоэнергетические соединения, плотно упакованные внутри фейерверка, сгорают с кислородом воздуха и превращаются в другие соединения, выделяя при этом звук, тепло и газы (такие, как угарный газ, углекислый газ и азот).
8. Созревание плодов
Тип: Органическое изменение
Созревание связано с изменениями в составе (например, превращение крахмала в сахар). Это процесс, в результате которого плоды приобретают желаемый вкус, цвет, качество и другие характеристики. По характеру созревания фрукты можно разделить на две группы:
Поскольку созревание включает образование новых углеродсодержащих химикатов, которые приводят к изменению цвета и вкуса, можно смело назвать процесс созревания органическим химическим изменением.
7. Переваривание пищи
Тип: Органическое
Более конкретно, большие молекулы пищи редуцируются до субъединиц, которые достаточно малы для поглощения слизистой оболочкой пищеварительного тракта.
Это достигается с помощью различных ферментов (таких, как ферменты слюны, желудка, щеточной каймы и ферменты поджелудочной железы) посредством гидролиза.
6. Гальваническое покрытие металла
Тип: неорганическое изменение
В этом процессе раствор, содержащий ионы металлов, помещается в резервуар, а подложка, на которую наносится покрытие, подключается к электрической сети, чтобы сделать ее катодом. Ионы металла в растворе движутся к катоду, где они приобретают электроны и образуют металлическое покрытие.
Распространенная форма гальванического покрытия используется для производства монет. Например, американский пенни сделан из цинка, покрытого слоем гальванической меди.
5. Прокисание молока
Тип: Органическое изменение
Испорченное молоко кислое, с неприятным запахом и вкусом. Со временем оно становится комковатым и свертывается. В процессе скисания образуются новые молекулы, и этот процесс нельзя обратить вспять.
Сырое молоко содержит сахар лактозу. Если оставить молоко на несколько часов при комнатной температуре, содержащиеся в нем бактерии лактобактерии начинают превращать лактозу в молочную кислоту, которая имеет кислый вкус. Бактерии Lactobacillus часто встречаются в молоке, и они не причиняют никакого вреда.
Кислое молоко также получают путем добавления кислоты (с добавлением или без добавления микробных организмов). Такое молоко называется подкисленным. По вкусу оно отличается от молока, полученного путем бактериальной ферментации, поскольку кислоты, добавляемые в процессе промышленного производства, имеют другой вкус, чем молочная кислота.
4. Смешивание кислоты с основанием
Тип: Неорганическое изменение
Например, в результате реакции между соляной кислотой (сильная кислота) и гидроксидом натрия (сильное основание) образуется хлорид натрия (поваренная соль).
HCl + NaOH → NaCl + H2O + тепло
В таких реакциях катион H(+) кислоты соединяется с анионом OH(-) основания, образуя соль и воду.
В некоторых реакциях образуются газы. Например, если смешать уксус (слабую кислоту) с пищевой содой (слабым основанием), то вместе с ацетатом натрия (солью) образуется углекислый газ.
3. Ржавое железо
Тип: Неорганическое изменение
Этот процесс также является хорошим примером коррозии, когда металлические поверхности разлагаются на более химически устойчивые оксиды.
2. Варка яйца
Тип: Неорганические изменения
Сырые яйца содержат сложные сети белка и воды. На каждую молекулу белка приходится почти тысяча молекул воды.
Молекулы белка относительно велики и содержат сотни аминокислот, связанных между собой в длинные цепочки. Цепочки складываются в компактные шарики, которые удерживаются вместе слабыми химическими связями (нековалентными).
Когда вы нагреваете яйца, их молекулы движутся быстрее и сталкиваются. При повышении температуры скорость столкновения увеличивается. Слабые связи (которые удерживают цепочки аминокислот) начинают разрываться, и белки яйца разворачиваются. В конце концов, белковые нити запутываются в трехмерную паутину.
В вареном яйце теперь содержится вода, которая диспергируется в белковой паутине, так что она больше не может сливаться воедино. В результате жидкое яйцо превращается в полутвердое.
По сути, вы изменили химические вещества, из которых состоит яйцо, применив тепло. Это необратимое изменение, а значит, вареное яйцо нельзя превратить обратно в сырое.
1. Фотосинтез
Тип: Биохимическое изменение
Растения являются основными продуцентами, которые составляют основу нашей экосистемы и подпитывают следующие трофические уровни. Они используют фотосинтез для преобразования солнечного света, воды, углекислого газа в кислород и простой сахар.
Поскольку для фотосинтеза требуется внешняя энергия (солнечный свет), чтобы привести в движение химические изменения, это эндотермическая реакция. Этот процесс не только используется растениями для получения пищи и роста, но и оказывает огромное влияние на нашу атмосферу и океаны, поскольку поглощает углекислый газ и производит кислород.
Часто задаваемые вопросы
В чем разница между химическим изменением и физическим изменением?
Физическое изменение влияет на форму вещества. Он включает в себя изменения таких свойств, как прочность, долговечность, температура плавления, форма кристаллов, объем, плотность, форма, размер, цвет и текстура. Хорошим примером может служить закалка стали для изготовления лезвия ножа.
Химическое изменение, с другой стороны, включает в себя изменения в составе вещества. Оно происходит, когда различные вещества соединяются, образуя новые вещества с новыми свойствами. Эти химические реакции необратимы и сопровождаются изменением энергии.
Как определить химическое изменение?
Не всегда легко определить, произошло ли химическое изменение (в отличие от физического). Однако можно обратить внимание на такие признаки, как:
Какое вещество не может быть изменено обычными химическими реакциями?
Химический процесс
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число,изотопный состав химических элементов.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Самопроизвольное превращение веществ осуществляется при условии, что они обладают энергией, достаточной для преодоления потенциального барьера, разделяющего исходное и конечное состояния системы (Энергия активации).
Содержание
Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
По изменению степеней окисления реагентов
В данном случае различают
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продутов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах участвующие вещества сохраняют неизменными свои свойства, но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.