что способна к фагоцитозу эритроциты или лейкоциты
Что способна к фагоцитозу эритроциты или лейкоциты
Современные методы лечения
Лейкоциты
ГБУ РО «КБ им. Н.А. Семашко»
Врач КЛД Е.В.Коровченко
Содержание лейкоцитов в крови в норме 4,0 – 9,0 x 10 9/л.
Количество лейкоцитов (WBC) в циркулирующей крови – важный диагностический показатель.
Содержание лейкоцитов в крови не является постоянным, а динамически изменяется в зависимости от времени суток и функционального состояния организма. Так, количество лейкоцитов обычно несколько повышается к вечеру, после приёма пищи, а также после физического и эмоционального напряжения.
К лейкоцитам относятся:
Нейтрофилы
Нейтрофилы – наиболее многочисленные из лейкоцитов – первыми начинают бороться с инфекцией и первыми появляются в месте повреждения тканей. Нейтрофилы имеют ядро, разделенное на несколько сегментов, поэтому их еще называют сегментоядерными нейтрофилами или полиморфноядерными лейкоцитами. Эти названия, однако, относятся только к зрелым нейтрофилам. Созревающие формы (юные, палочкоядерные) содержат цельное ядро.
Чаще всего уровень нейтрофилов повышен при острых бактериальных и грибковых инфекциях. Иногда в ответ на инфекцию продукция нейтрофилов увеличивается столь значительно, что в кровяное русло выходят незрелые формы нейтрофилов, увеличивается количество палочкоядерных (ядро в виде палочки). Это называется сдвигом лейкоцитарной формулы влево и свидетельствует об активности ответа костного мозга на инфекцию.
Встречается и сдвиг лейкоцитарной формулы вправо, когда количество палочкоядерных форм уменьшается и увеличивается количество сегментоядерных. Так бывает при мегалобластных анемиях, заболеваниях печени и почек.
Другие причины повышения уровня нейтрофилов:
Количество нейтрофилов может уменьшаться при:
Лимфоциты.
Лимфоциты – одно из важнейших звеньев иммунной системы, они имеют большое значение в уничтожении вирусов и борьбе с хронической инфекцией. Существует два вида лимфоцитов – Т и В (в лейкоцитарной формуле подсчета видов лейкоцитов по отдельности нет). B-лимфоциты вырабатывают антитела – специальные белки, которые связываются с чужеродными белками (антигенами), находящимися на поверхности вирусов, бактерий, грибов, простейших. Окруженные антителами клетки, содержащие антигены, доступны для нейтрофилов и моноцитов, которые убивают их. Т-лимфоциты способны разрушать зараженные клетки и препятствовать распространению инфекции. Также они распознают и уничтожают раковые клетки.
Причины повышенного уровня лимфоцитов:
Причины снижения уровня лимфоцитов:
Моноциты
Моноцитов в организме не очень много, однако они осуществляют крайне важную функцию фагоцитоза. После непродолжительной циркуляции в кровяном русле (20-40 часов) они перемещаются в ткани, где превращаются в макрофаги. Макрофаги способны уничтожать клетки, так же как нейтрофилы, и держать на своей поверхности чужеродные белки, на которые реагируют лимфоциты. Они играют роль в поддержании воспаления при некоторых хронических воспалительных заболеваниях, таких как ревматоидный артрит.
Причины повышения уровня моноцитов:
Причины снижения уровня моноцитов:
Эозинофилы
Эозинофилов в крови содержится небольшое количество, они тоже способны к фагоцитозу, однако в основном играют другую роль – борются с паразитами, а также принимают активное участие в аллергических реакциях.
Наиболее распространенные причины повышения уровня эозинофилов:
Более редкие причины их повышения:
Количество эозинофилов может снижаться при:
Базофилы
Базофилов в крови также немного. Они перемещаются в ткани, где превращаются в тучные клетки. Когда они активируются, из них выделяется гистамин, обусловливающий симптомы аллергических заболеваний. Увеличение содержания базофилов встречается редко: при онкологических заболеваниях костного мозга и лимфоузлов, истинной полицитемии, аллергических заболеваниях.
Лейкоцитарная формула имеет возрастные особенности, поэтому её сдвиги должны оцениваться с позиции возрастной нормы (это особенно важно при обследовании детей). При интерпретации результатов также следует помнить, что повышение или понижение может быть как абсолютным (меняется именно количество лейкоцитов, относящихся к данной популяции), так и относительным (меняется процентное соотношение клеток в лейкоцитарной формуле из-за изменения количества клеток, относящихся к другим субпопуляциям). Количество лейкоцитов в крови зависит от скорости притока клеток из костного мозга и скорости выхода их в ткани. Увеличение количества лейкоцитов в периферической крови выше 10,0 x10 9/л называют лейкоцитозом, уменьшение – ниже 4,0 x 10 9/л – лейкопенией.
Лейкоцитоз наблюдается при следующих заболеваниях и состояниях:
Лейкопения наблюдается при следующих заболеваниях и состояниях:
Таким образом, определение уровня лейкоцитов в крови имеет большое диагностическое значение. Низкое или высокое содержание лейкоцитов может сигнализировать о протекающей в организме патологической реакции. Правильная расшифровка анализа крови дает возможность ранней диагностики и более эффективного лечения.
Клетки осуществляющие фагоцитоз
Фагоцитоз – это явление захвата и переваривания чужеродных вредных частиц, попавших в организм, особыми клетками-защитниками. Притом к фагоцитозу способны не только «специально обученные» фагоциты, цель жизни которых заключается в защите здоровья человека, но и клетки, выполняющие в нашем теле совершенно иные задачи… Итак, какие же существуют клетки, способные к фагоцитозу?
Моноциты
Моноциты – одно их первых названий, которые всплывают 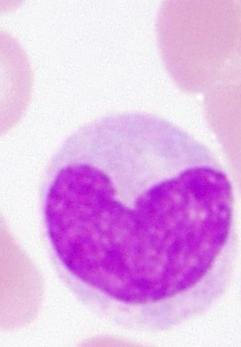
При фагоцитозе моноцит справляется с вредными объектами всего за 9 минут. Иногда он поглощает и расщепляет клетки и субстраты, превышающие его по размерам в несколько раз.
Нейтрофилы
Фагоцитоз нейтрофилов осуществляется похожим образом, с той лишь разницей, что они работают по принципу «Светя другим, сгораю сам». Это значит, что, захватив патоген и уничтожив его, нейтрофил погибает.
Макрофаги
Макрофаги – это осуществляющие фагоцитоз лейкоциты, образовавшиеся из моноцитов крови. Они располагаются в тканях: как непосредственно под кожей и слизистыми, так и в глубине органов. Существуют особые разновидности макрофагов, которые находятся в конкретных органах.
Например, в печени «живут» клетки Купфера, задача которых состоит в разрушении старых компонентов крови. В легких располагаются альвеолярные макрофаги. Эти клетки, способные к фагоцитозу, захватывают вредные частицы, проникшие в легкие с вдыхаемым воздухом, и переваривают их, разрушая своими ферментами: протеазами, лизоцимом, гидролазами, нуклеазами и т.д.
Обычные тканевые макрофаги обычно погибают после встречи с патогенами, то есть в этом случае происходит то же, что и при фагоцитозе нейтрофилов.
 Дендритные клетки
Дендритные клетки
Эти клетки – угловатые, ветвистые – совершенно не похожи на макрофаги. Тем не менее, они являются их родственниками, так как тоже образуются из моноцитов крови. К фагоцитозу способны только молодые дендритные клетки, остальные в основном «работают» с лимфоидной тканью, обучая лимфоциты правильно реагировать на некоторые антигены.
Тучные клетки
Помимо того, что тучные клетки запускают реакцию воспаления, эти лейкоциты способны к фагоцитозу. Особенность их работы состоит в том, что они уничтожают только грамотрицательные бактерии. Причины такой «разборчивости» не совсем понятны, видимо, у тучных клеток есть к этим бактериям особое сродство.
Они могут уничтожить сальмонеллу, кишечную палочку, спирохету, многих возбудителей ЗППП, но совершенно равнодушно воспримут возбудителя сибирской язвы, стрептококка и стафилококка. Борьбой с ними займутся другие лейкоциты.
Перечисленные выше клетки – это профессиональные фагоциты, об «опасных» свойствах которых известно всем. А теперь несколько слов о тех клетках, для которых фагоцитоз – не самая типичная функция.
Тромбоциты
Тромбоциты, или кровяные пластинки, занимаются главным образом тем, что отвечают за свертываемость крови, прекращают кровотечения, формируют тромбы. Но, помимо этого, у них обнаружены и фагоцитарные свойства. Тромбоциты могут образовывать ложноножки и уничтожать некоторые вредные компоненты, попавшие в организм.
Клетки эндотелия
Оказывается, клеточная выстилка сосудов тоже представляет 
Гистиоциты
Под этим собирательным названием объединяют все клетки тканей: соединительной ткани, кожи, подкожной клетчатки, паренхимы органов и так далее. Раньше этого никто не мог предположить, но оказывается, при определенных условиях многие гистиоциты способны менять свои «жизненные приоритеты» и тоже приобретать способность к фагоцитозу! Повреждения, воспаление и другие патологические процессы пробуждают в них эту способность, которая в норме отсутствует.
Фагоцитоз и цитокины:
В процессе фагоцитоза клетки образуют цитокины. Это так называемые сигнальные молекулы, при помощи которых фагоциты передают информацию другим компонентам иммунной системы. Самыми важными из цитокинов являются трансфер факторы, или факторы передачи – белковые цепочки, которые можно назвать самым ценным источником иммунной информации в организме.
Чтобы фагоцитоз и другие процессы в иммунной системе проходили благополучно и полноценно, можно использовать препарат Трансфер Фактор, действующее вещество которого и представлено факторами передачи. С каждой таблеткой средства организм человека получает порцию бесценных сведений о правильной работе иммунитета, полученных и накопленных многими поколениями живых существ.
При приеме Трансфер Фактора нормализуются процессы фагоцитоза, ускоряется ответ иммунной системы на проникновение возбудителей, повышается активность клеток, защищающих нас от агрессоров. Кроме того, через нормализацию работы иммунитета улучшаются функции всех органов. Это позволяет повысить общий уровень здоровья и, если это необходимо, помочь организму в борьбе с практически любым заболеванием.
Что способна к фагоцитозу эритроциты или лейкоциты
Гранулоциты крови включают в себя нейтрофильные лейкоциты, а также эозинофилы и базофилы. Как известно, доминирующей популяцией гранулоцитов в периферической крови являются нейтрофильные лейкоциты, диапазон содержания которых в периферической крови постоянно изменяется и составляет в настоящее время в среднем от 47 до 75 % в лейкоцитарной формуле.
Менее представительной популяцией клеток гранулоцитарного ряда в периферической крови являются эозинофилы, относительное содержание которых в лейкоцитарной формуле колеблется от 1 до 5 %.
И крайне скромно представлено содержание в крови базофилов, максимальный уровень которых составляет не более 1–2 %.
Касаясь морфологических особенностей нейтрофилов и их биологической значимости следует отметить, что эти клеткиотносят к категории полиморфноядерных лейкоцитов, созревание которых в костном мозге сопряжено со значительными изменениями структуры, метаболизма и свойств. Динамика морфологических изменений заключается в постепенном уменьшении ядра с увеличением цитоплазматически-ядерного отношения, исчезновением ядрышек, сегментацией ядер нейтрофилов. Зрелые сегментоядерные нейтрофилы задерживаются в синусах костного мозга в течение 3–4 дней. Количество депонированных в синусах костного мозга нейтрофилов превышает число циркулирующих клеток в 10–20 раз. Изменение процентных взаимоотношений между циркулирующими и депонированными нейтрофилами лежит в основе всех перераспределительных лейкоцитозов и лейкопений. Одна из отличительных характеристик этих реакций является их кратковременность, наличие четкого этиологического фактора, отсутствие изменений функциональной активности гранулоцитов. Время их нахождения в кровеносном русле очень мало (в среднем 6–8 часов), так как эти клетки быстро мигрируют в ткани. Покинувшие сосудистое русло нейтрофилы в кровоток не возвращаются и разрушаются в тканях. Часть нейтрофилов удаляется из организма через желудочно-кишечный тракт.
Зрелые сегментоядерные нейтрфилы представляют собой клетки округлой формы, диаметром 7–12 мкм. Ядро клеток состоит из 3–4 сегментов, соединенных тонкими нитями хроматина. При окраске по Романовскому ядро окрашивается в сине-фиолетовый цвет, а цитоплазма – в розовый.
У нейтрофилов мало митохондрий, рибосом, комплекс Гольджи невелик, эндоплазматический ретикулум редуцирован. Главный источник энергии – гликоген, основная форма метаболизма – гликолиз. В процессе фагоцитоза и метаболического респираторного взрыва при участии гексозомонофосфатного шунта потребляется до 30 % метаболизированной глюкозы. Кратковременность существования нейтрофилов (до 4-х суток) обусловлена генетически детерменированным апоптозом.
У практически здоровых людей иногда выявляются и врожденные изменения структуры ядра нейтрофилов, среди них отмечают наличие так назывемой пельгеровской аномалии лейкоцитов, характеризующейся преобладанием нейтрофилов с двухлопастным ядром, а также наличием клеток с недостаточно четко разграниченными сегментами ядра, напоминающим палочкоядерные нейтрофилы. Пельгеровская аномалия – часто встречающийся гематологический признак; наблюдается у одного из 1000 человек. Аномалия наследуется по доминантному типу. Значительно реже встречается врожденная гиперсегментация ядер нейтрофилов, при которой в ядрах имеется более 5 сегментов. Описан врожденный макроцитоз нейтрофилов, когда средний размер клетки составляет около 17 мкм. При всех этих изменениях функциональная активность нейтрофилов существенно не изменяется, и аномалии обнаруживаются случайно.
В цитоплазме нейтрофилов содержится большое количество мелких гранул двух типов. Первичные гранулы составляют 30 % всех гранул, содержат набор ферментов, главным обазом гидролитических, и являются типичными лизосомами. Лизосомы характеризуются высоким содержанием миелопероксидазы, катионных белков, мукополисахаридов. В лизосомах локализована примерно 1/3 лизоцима, обеспечивающего деполимеризацию мукополисахаридов бактериальных клеток, способствующего последующему гидролитическому расщеплению бактерий при участии лизосомальных ферментов. В случае развития фагоцитоза нейтрофилы активно выделяют содержимое лизосом в окружающую среду, где проявляются эффекты лизосомальных гидролаз. Вторичные гранулы образуют типичную специфическую зернистость нейтрофилов и содержат гликоген, липиды, ряд ферментов, а также лизоцим.
Характерной особенностью метаболизма нейтрофилов является их способность получать энергию за счет анаэробного гликолиза, что обеспечивает их функции даже в крайне неблагоприятных условиях (в тканях, бедных кислородом, воспалительных, отечных, плохо кровоснабженных). Основным субстратом для гликолиза в нейтрофильных лейкоцитах является глюкоза, в меньшей степени – галактоза и фруктоза, а также гликоген. Расщепление глюкозы в нейтрофилах может осуществляться по пентозофосфатному пути. Роль дыхания в жизнедеятельности нейтрофилов невелика. В нейтрофилах имеется достаточный набор ферментов гликолиза, пентозо-фосфатного окисления глюкозы, причем энергия гликолиза используется для реализации фагоцитарной и двигательной активности, а пентозофосфатный путь окисления глюкозы играет роль в обеспечении реакций синтеза жирных кислот. Последние, как и углеводы, используются нейтрофилами в качестве источников энергии.
Нейтрофильные лейкоциты, наряду с друими лейкоцитарными элементами, являются центральным звеном неспецифической резистентности организма. От их деятельности зависит интенсивность фагоцитоза и продукция гумолальных неспецифических факторов защиты – комплемента, лизоцима, интерферона, обеспечивающих бактерицидную активность сыворотки крови, а также миелопероксидазы, лактоферрина, катионных белков.
Способность к фагоцитозу нейтрофильных лейкоцитов обусловлена рядом особенностей, в частности высокой двигательной активностью. Нейтрофилы первыми прибывают в место повреждения тканей за счет целенаправленного движения клеток к объектам фагоцитоза (хемотаксис).
Амебовидная подвижность обусловлена образованием «двигательных» псевдоподий, а также, по данным электронно-микроскопических исследований, наличием в нейтрофильных лейкоцитах актомиозиновых структур.
Направленное движение индуцируется рядом хемотаксических факторов или соединений. Значительная их часть выделяется бактериями. Эти факторы могут иметь различную молекулярную массу от 2000 до 60000 D. Хемотаксические факторы с низкой молекулярной массой оказывают непосредственное хемотаксическое действие на нейтрофилы. Факторы с большой молекулярной массой опосредуют хемотаксический эффект через сывороточные белки (кофакторы). Хемотаксической активностью обладают и некоторые продукты разрушения клеток, а также кинины, каллекреины, пептиды, образующиеся при расщеплении третьего (С3) и пятого (С5) компонентов комлемента. Хемотаксические факторы вызывают уменьшение отрицательного заряда поверхности нейтрофила, что облегчает их адгезию и агглютинацию.
Активированный нейтрофил имеет около 120 000 рецепторов для Fc-фрагмента IgG, формирующих кластеры на клеточной поверхности и около 40 000 рецепторов для фракции комплемента (С3в). Некоторые частицы могут прикрепляться к поверхности фагоцита без участия этих рецепторов.
Реакции фагоцитоза неразрывно связны с деятельностью кислородзависимы антимикробных систем, сопровождаются увеличением поглощения кислорода и выработкой перекиси водорода, супероксид-анион-радикала, гидроксильных радикалов. Активность данной системы киллинга бактерий сопряжена с ферментом миелопероксидазой.
Существуют также кислороднезависимые антимикробные системы, проявляющие бактерицидное действие в фагосомах при отсутствии кислорода. К компонентам этой системы относятся: закисление среды, лизоцим, лактоферрин, катионные белки и некоторые другие соединения.
Касаясь характеристики лизоцима, необходимо отметить, что это низкомолекулярный катионный белок, расщепляющий В-гликозидные связи мукополисахаридов, обладает сильным антимикробным действием в отношении многих бактерий, а особенно грамположительных. В нейтрофильных лейкоцитах лизоцим не синтезируется, а только депонируется.
Наряду с фагоцитозом защитная функция нейтрофилов обеспечивается выделением в окружающую среду лизосомальных энзимов с гидролитическими свойствами, катионных белков, молочной кислоты, которое оказывают бактериостатическое и бактериолитическое действие, участвуют в разрушении поврежденных при воспалении тканей и клеток организма.
Участие нейтрофильных лейкоцитов в механизмах неспецифической резистентности обеспечивается и фактором противовирусной защиты – интерфероном.
Помимо противовирусного эффекта интерферон оказывает антипролиферативное и противоопухолевое действие, подавляет бласттрансформацию лимфоцитов и выработку антител, а также активизирует макрофаги, усиливает цитотоксичесое действие сенсибилизированных лимфоцитов. Одновременно его можно рассматривать и в качестве медиатора иммунного ответа.
В нейтрофильных лейкоцитах обнаружены соединения, являющиеся производными арахидоновой кислоты, получившие название лейкотриены. Лейкотриены оказывают выраженное влияние на течение иммунных процессов, являются важнейшими медиаторами воспаления, стимулируют продукцию анионов супероксида, освобождение лизосомальных ферментов, повышают сосудистую проницаемость.
В последние годы обсуждается участие нейтрофилов в регенераторных проессах и, соответственно, наличие у них репаративной функции. Не менее важным является участие нейтрофильных лейкоцитов в гемостатических реакциях организма. Известно, что нейтрофилы обладают способностью активировать контактную фазу процесса свертывания крови, так как содержат кининазы и ферменты, стимулирующие кининогенез. Нейтрофильные лейкоциты легко вступают во взаимодействие с кининогеном и XII фактором, что способствует освобождению из гранул эластазы. В то же время нейтрофильная эластазоподобная протеаза значительно тормозит процесс свертывания крови, а катепсин С при длительной инкубации инактивирует XII фактор.
Нейтрофилы являются одним из источников синтеза транскобаламина – белка, связывающего витамин В12.
Нейтрофилопоэз. В условиях нормы содержание нейтрофильных лейкоцитов в периферической крови составляет от 2300 до 4500 в 1 мкл3. В первые сутки после рождения ребенка отмечается лейкоцитоз (15 000–30 000 в 1 мкл3), содержание нейтрофилов составляет около 65 %. К концу первого года жизни количество нейтрофилов в крови достигает миниума, после чего вновь возрастает и достигает значений взрослого человека к периоду полового созревания (13–15 годам).
Период созревания нейтрофилов в костном мозге составляет 8–14 суток, в то время как первоначальная фаза созревания нейтрофилов от миелобласта до метамиелоцита продолжается 6 суток. Дальнейшие этапы постмитотического созревания могут продолжаться до 14 суток, когда нейтрофилы приобретают способность к адгезии, фагоцитозу, а на их мембране появляются рецепторы к хемотоксинам. Ежедневно из костного мозга в кровоток поступает 1010 нейтрофилов. В крови содержится около 6×1010 нейтрофилов, в равной мере рапределенных между циркулирующим и маргинальным пулом. Содержание нейтрофилов в 1 мкл в норме составляет 3500 клеток, уменьшение их количества ниже 500 в 1 мкл приводит к развитию иммунодефициту и инфекции. Полупериод циркуляции нейтрофилов в крови 6 часов, после чего они мигрируют в ткани и в кровь не возвращатся.
Касаясь участия нейтрофилов в метаболизме тканей и межклеточном взаимодействии, необходимо отметить, что нейтрофилы располагают большим количеством кислых гидролаз, способных разрушить коллаген, эластин, фибриноген, фибрин, способны продуцировать IL-1, IL-3, IL-8, TNFα, колониестимулирующие факторы.
Нейтрофилы способны взаимодействовать с клетками разного типа: эозинофилами, фибробластами, базофилами, тучными клетками, секретируют сигнальные молекулы.
В функциональном отношении нейтрофилы представляют собой гетерогенную популяцию: различают нативные (покоящиеся) нейтрофилы, праймированные, подготовленные к последующей активации и активированные. Праймированные лейкоциты интенсивно продуцируют свободные радикалы и цитокины (TNFα, IL-8), обладают выраженным повреждающим действием на различные органы и ткани за счет активации фосфолипазы А2.
Морфологические и фукциональные особенности эозинофилов
У здоровых лиц количество циркулирующих в периферической крови эозинофилов составляет 0–5 % и не превышает 1 % от общего количества эозинофилов, содержащегося в костном мозге и периферических тканях. Кровь для них, как и для других видов лейкоцитов, является лишь транспортной системой. Основные функциональные свойства эозинофилов реализуются вне кровотока в периферических тканях.
Для эозинофильных лейкоцитов характерно наличие суточных колебаний, что связано с уровнем секреции глюкокортикоидов корой надпочечников. Установлено, что максимальное их количество в крови отмечается в утренние часы, а минимальное количество – в вечернее время.
Стимуляторами продукции эозинофилов в костном мозге являются IL-3 и IL-5, эозинофилы проходят те же стадии развития, что и нейтрофилы.
Эозинофилы созревают в костном мозге в течение 24 часов, а затем в течение 3–4 суток зрелые эозинофилы остаются в костном мозге. По мере созревания клеток уменьшается ядро, исчезают ядрышки, увеличиваются количество и размеры эозинофильных гранул, повышается активность многих гидролитических ферментов.
Выходящие в кровоток эозинофилы циркулируют там не более 5 часов и постепенно переходят в ткани. Максимальное их количество обнаруживается в подслизистом слое желудочно-кишечного тракта. Повторно в кровоток они не возвращаются, разрушаются в тканях и выделяются через желудочно-кишечный тракт.
Эозинофилы имеют округлую форму, диаметр в пределах 12 мкм, ядро двулопастное, цитоплазма почти полностью заполнена специфическими гранулами, которые окрашиваются в ярко-красный или оранжевый цвет при окраске по Романовскому. Гранулы содержат в большом количестве пероксидазы, β-глюкоронидазу, а также полисахариды, аминокислоты, кислую фосфатазу и могут рассматриваться как лизосомы.
Эозинофильные гранулы содержат особую группу бактерицидных веществ, в частности эозинофильный катионный протеин, белковые кристаллы Шарко-Лейдена. Последние имеют вытянутую шестиугольную форму и обладают активностью лизофосфолипазы, подавляющей повреждающее действие некоторых лизофосфолипидов на ткани.
Основную часть энергии для жизнедеятельности эозинофилы получают в результате аэробного и анаэробного гликолиза. В качестве энергетического субстрата используется глюкоза, ее метаболизм осуществляется гликолитическим путем и выделяемая энергия утилизуется в виде АТФ, креатифосфата и гликогена.
Установлено повышение количества эозинофилов в крови (за пределы суточных колебаний – эозинофилия) при различных аллергических реакциях, глистных инвазиях и аутоиммунных заболеваниях, что указывает на роль эозинофильных лейкоцитов в развитии воспалительных, иммуноаллергических реакций организма, гиперчувствительности немедленного и замедленного типов, причем установлена максимальная концентрация эозинофилов в тех тканях, которые являются местом развития вышеуказанных реакций.
Функции эозинофилов обеспечиваются, прежде всего, их способностью к амебовидному перемещению под действием различных хемотаксических факторов, образующихся при сенсибилизации и аллергизации организма. Ряд факторов освобождается из гранул базофилов и тучных клеток. Они называются эозинофильными хемотаксическими факторами анафилаксии. Вторая группа соединений, вызывающих хемотаксис эозинофилов, выделется Т-лимфоцитами при их взаимодействии с макрофагами. Установлена способность сегментоядерных нейтрофилов выделять стимулятр хемотаксиса эозинофилов. Определенной хемотаксической активностью обладает также гистамин.
Таким образом, хемотаксис эозинофилов приводит к их скоплению в очагах воспаления, в местах развития иммунологических реакций, где они принимают участие в метаболизме гистамина. Эозинофилы обладают способностью фагоцитировать гранулы с гистамином, выделяемые тучными клетками и базофилами. Кроме того эозинофилы содержат фермент гистаминазу с высокой активностью, вызывающую инактивацию поглощенного гистамина. Есть данные, что эозинофилы обеспечивают также простой транспорт гистамина к органам выделения. В эозинофилах обнаружен фактор, тормозящий выделение гистамина из базофилов и тучных клеток.
В участках воспаления эозинофилы обеспечивают инактивацию брадикинина и ряда других биологически активных вещест. Таким образом, за счет функциональных особенностей эозинофилы предотвращают развитие воспалительных и аллергических реакций.
Следующая функция эозинофилов – их способность к фагоцитозу в отношении микробных клеток, комплексов антиген-антитело, благодаря чему они рассматриваются в роли микрофагов наряду с нейтрофильными лейкоцитами. Бактерицидное действие эозинофилов не является идентичным таковому у нейтрофилов, хотя оно также связано с активацией пероксидазы, усилением окисления глюкозы, утилизации кислорода и т.д.
Эозинофилы принимают участие в процессах свертывания крови и фибринолиза в связи со способностью синтезировать плазминоген.
Миграция эозинофилов в кровь при воспалении регулируется в основном IL-5, адгезию вызывают IL-1, TNF, IL-4, индуцирующие экспрессию эндотелиальных адгезивных молекул.
Морфологические и функциональные особенности базофилов
Базофилы представляют собой наименьшую популяцию гранулоцитов периферической крови и костного мозга; их содержание в крови взрослых лиц составляет 0–1 %. Созревание базофилов в костном мозге занимает около 1,5 суток. В течение нескольких суток зрелые базофилы депонируются в синусах костного мозга и в периферическую кровь выходят через 2,5–7 дней. В периферической крови базофилы циркулируют в среднем около 6 часов.
Зрелый базофил – клетка с диаметром 8–10 мкм, ядро неправильной формы или трехлопастное, цитоплазма имеет голубоватую окраску, но она заполнена гранулами пурпурного цвета, занимающими всю цитоплазму. Гранулы очень богаты гистамином, содержат половину гистамина, находящегося в периферической крови. В гранулах также содержатся в большом количестве мукополисахариды, среди которых различают гепарин, гиалуроновую кислоту и небольшое количество гликогена.
Продукция энергии в базофилах осуществляется главным образом за счет окислительного фосфолирирования, процессы которого обеспечиваются высоким содержанием в базофилах митохондрий и окислительных ферментов.
Функции базофилов связывают с их участием в аллергических и воспалительных реакциях за счет содержания в них биологически активных веществ, в частности, гистамина и гепарина.
Дегрануляция и освобождение гистамина из базофилов осуществляется под воздействием гуморальных факторов, в частности иммуноглобулинов Е, реже G. На мембране базофила имеется от 30 000 до 100 000 рецепторов для IgE, причем от 10 000 до 40 000 этих рецепторов могут фиксировать на себе IgЕ с помощью Fc-фрагмента. Процесс дегрануляции может осуществляться и под действием неиммуных факторов, в частности ц-3,5-АМФ. Уменьшение содержания его в клетках сопровождается освобождением внутриклеточного гистамина.
В сенсибилизированном организме дегрануляция базофилов происходит в кровеносном русле, в костном мозге, тканях, что определяет клинику крапивницы, сенной лихорадки и других аллергических заболеваний.
Рассматривая роль базофилов в развитии гиперчувствительности немедленного и замедленного типов, необходимо отметить их способность к направленному движению, что обеспечивает их поступление в зоны иммунологических реакций.
Важнейшими хемотаксическими факторами базофилов являются лимфокины, выделяемые сенсибилизированными Т-лимфоцитами.
Базофильные лейкоциты обладают также способностью к фагоцитозу, хотя данная функция и не является ведущей. Описана способность базофилов захватывать частички и сенсибилизированные эритроциты с формированием фагосомы.
Базофилы могут оказывать влияние на системы свертывания крови и фибринолиза. В базофилах содержатся ряд прокоагулянтных факторов, калликреин, вазоактивные амины.
В то же время гепарин является антикоагулянтом, обеспечивающим наряду с антитромбином III около 85 % всей антикоагулянтной активности крови.
Следующая не менее важная функция базофилов – это их участие в регуляции жирового обмена, так как выделяющийся при дегрануляции базофилов гепарин способен активировать липопротеиновую липазу, регулирующую расщепление В-липопротеидов.
Анализируя в целом биологическую значимость гранулоцитов периферической крови, следует прежде всего отдать должное фагоцитарной активности нейтрофилов, обеспечивающих не только развитие неспецифической резистентности против пиогенной микрофлоры, но и формирование синдрома системного воспалительного ответа с участием эндокринной, иммунной систем, а также ряда внутренних органов и тканей. В то же время базофильные лейкоциты, носители значительного количества вазодилататорных субстанций, играют важную роль в развитии локальных и системных гиперергических воспалительных реакций. Между тем эозинофилы, выполняя определенную фагоцитарную функцию, обеспечивают в значительной мере инактивацию многих медиаторов альтерации.











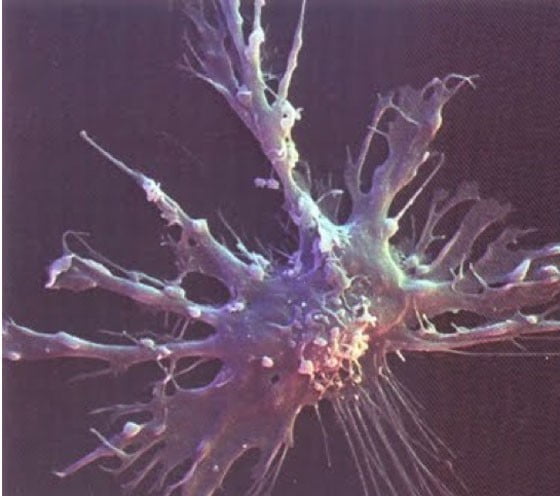 Дендритные клетки
Дендритные клетки